2. 军事科学院军事医学研究院辐射医学研究所, 北京 100850
2. Beijing Institute of Radiation Medicine, Beijing 100850, China
脑是微波辐射的重要敏感靶器官之一[1-2]。微波辐射可导致焦虑行为产生、脑组织病理学改变等[3-4],但作用机制尚未完全阐明,缺乏有效的防治药物。纹状体是脑部参与情绪调节的重要区域。关于微波辐射对纹状体结构和功能影响的研究报道尚不多见[5-6]。
钙信号异常是微波辐射脑损伤的重要机制之一。微波辐射可激活电压门控钙离子通道(voltage-gated calcium channel, VGCC)[7-8]。粉防己碱(tetrandrine, TET)是从防己根部提取的双苄基异喹啉类生物碱,其作为新型天然钙离子拮抗剂,可作用于L、T、N等多种钙离子通道,且可透过血脑屏障发挥神经保护作用[9-12]。前期研究发现,TET对于微波辐射致海马损伤具有一定治疗作用,且其作用机制与VGCC基因表达改变有关[13-14]。有关TET对微波辐射致纹状体损伤的治疗作用尚不清楚,作用机制也有待进一步研究。
本研究在前期工作基础上,建立微波辐射动物模型,着重探讨TET对微波辐射致纹状体结构和功能改变的影响及其机制,旨在进一步明确微波辐射对纹状体结构和功能的影响,阐明TET对微波辐射致纹状体损伤的治疗作用,以期为微波辐射脑损伤防治提供新思路。
材料与方法1. 实验动物及分组:采用40只8~10周龄C57BL/6N小鼠[北京维通利华实验动物技术公司,许可证号:SCXK(京)2016-0006],雌雄各半,体重23~25 g,动物饲养于军事医学研究院实验动物中心,饲养温度18~22℃,食水充足。按随机数表法分为空白对照组、辐射对照组、TET组及TET+辐射组,每组10只。动物实验伦理由军事医学研究院实验动物中心医学伦理委员会审核通过(伦理号:IACUC-DWZX-2021-685)。
2. 药物配置与给药方法:精密称取粉防己碱标准品(西安昊轩生物科技公司,纯度≥98%)0.6 g于100 ml烧杯中,加入0.1 mol/L HCl溶解,采用0.1 mol/L NaOH调节pH值为5.5~6.5,移至容量瓶中,加入去离子水定容至100 ml,配置成6 g/L的粉防己碱溶液。TET组及TET+R组分别于辐射后即刻、辐射后1、2 d腹腔注射给药,每天给药1次,连续3 d,给药剂量为60 mg·kg-1·d-1。空白对照组和TET组给予等体积生理盐水。
3. 微波辐射方法:采用军事医学研究院自建微波辐射源对小鼠进行全身辐照。将小鼠置于方形透明带孔有机玻璃盒中,自由体位。辐射中心频率2.856 GHz,平均功率密度8 mW/cm2,比吸收率9.4 W/kg,辐射源距动物体表距离85 cm,单次辐射15 min。空白对照组和TET组进行同等条件伪辐射。
4. TET结构确证:采用液质色谱仪(美国安捷伦科技公司,HPLC1200)联用紫外检测器(美国安捷伦科技公司,G1314B)进行药物结构验证。配置100 μg/ml标准浓度TET溶液,溶剂为50%乙腈。色谱液相流动相为A ∶10 mmol的乙酸铵甲醇水溶液(V甲醇 ∶V水=5 ∶95);B:乙腈,流速0.45 ml/min,柱温40℃,自动进样器温度15℃,进样量5 μl。
5. 旷场行为学实验检测小鼠焦虑情绪:采用40 cm × 40 cm × 40 cm旷场箱,中央16 cm × 16 cm设置为旷场箱中央区域。实验前连续3 d将小鼠置于实验室环境中,并对其抓取适应环境30 min。采用Anymaze(Version 6.32,美国Stoelting公司)视频分析软件记录小鼠行为学轨迹数据。分析小鼠5 min内进入中央区域的时间及路程。分别于微波辐射前和辐射后7 d进行实验,检测小鼠焦虑情绪。
6. 纹状体组织病理学分析:微波辐射后7 d,小鼠经0.5 %戊巴比妥钠(50 mg/kg)腹腔注射麻醉,断头取脑。将脑组织经4 %多聚甲醛固定两周后,进行梯度乙醇脱水、二甲苯透明、浸蜡,石蜡包埋切片,切片厚度为3 μm,经苏木素-伊红(HE)染色后,采用Pannoramic MID Ⅱ数字切片扫描仪观察纹状体组织形态结构改变,并采用3D Histech′s Slide Converter软件采集图像。
冰上剥离纹状体组织,取1 mm3纹状体GP区组织块置于2.5 %戊二醛固定2 h,1 % 锇酸固定2 h,乙醇和丙酮梯度脱水,Epon812树脂包埋,半薄切片定位后制作超薄切片。切片厚度为70 nm,采用醋酸铀和柠檬酸铅双重染色,HITACHI H7800透射电镜(日本日立公司)下观察纹状体组织超微结构变化并摄像。
7. 实时荧光定量PCR检测纹状体组织VGCC基因表达:微波辐射后7 d,小鼠经腹腔注射戊巴比妥钠麻醉后,断头取脑,冰上剥离纹状体组织。采用TRIzol(南京诺唯赞生物科技公司)提取纹状体组织总RNA,利用超微量紫外分光光度仪(N60-Touch,德国因普恩公司)测定RNA浓度以及A260/A280、A260/A230比值。取1 μg总RNA,利用HiscriptIII RT SuperMix for qPCR(+Gdna Wiper)试剂盒(南京诺唯赞生物科技公司)将RNA反转录为cDNA,并进行PCR扩增。PCR反应体系为20 μl;其中cDNA模板1 μl,上下游引物各1 μg,2×Taq Pro Universal SYBR Qpcr Master Mix 10 μl,ddH2O加至20 μl。PCR扩增程序为95℃ 30 s,95℃ 10 s,60℃ 30 s,40个循环,4℃终止。以GAPDH为内参照。采用Primer bank数据库设计引物,利用NCBI blast软件进行比对,由日本TaKaRa公司合成,引物序列见表 1。
|
|
表 1 引物序列 Table 1 Primer sequence |
8. 统计学处理:采用SPSS 22.0统计学软件进行数据分析,GraphPad Prism 8作图。实验数据符合正态分布,以x±s表示。组间比较采用双因素方差分析和配对t检验。P<0.05为差异具有统计学意义。
结果1. TET结构确证:在联用紫外检测器的液质色谱仪进样口加入100 μg/ml,体积5 μl粉防己碱溶液。紫外检测器检测到其最大吸收波长为282 nm。于加样后1 min左右检测到单峰,与TET标准图谱一致。
2. TET对微波辐射致小鼠情绪行为改变的影响:旷场行为学实验结果显示,与辐射前相比,辐射对照组小鼠进入中央区域时间、中央区域路程均较辐射前减少,差异具有统计学意义(t=4.60、5.18,P<0.01)。空白对照组、TET+辐射组、TET组小鼠辐射前后进入中央区域时间、中央区域路程差异均无统计学意义(P>0.05)。提示微波辐射可导致小鼠焦虑样行为产生。同时,TET+辐射组小鼠进入中央区域时间、中央区域路程较辐射对照组小鼠显著增加(F=1.43、4.37,P<0.05)。辐射后,辐射对照组小鼠进入中央区域路程显著低于空白对照组(F=9.77,P<0.01),见图 1。以上结果表明,TET给药可明显改善微波辐射致小鼠焦虑情绪产生。
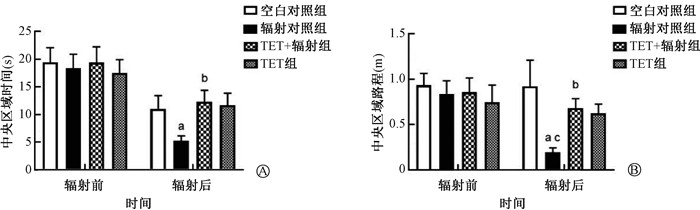
|
注:a与辐射前辐射对照组相比,t=4.60、5.18,P<0.01;b与辐射后辐射对照组相比,F=1.43、4.37,P<0.05;c与辐射后空白对照组相比,F=9.77,P<0.01 图 1 TET对微波辐射致小鼠焦虑情绪行为改变的影响 A.TET给药及微波辐射对小鼠旷场实验中央区域时间的影响;B.TET给药及微波辐射对小鼠旷场实验中央区域路程的影响 Figure 1 Effect of TET on the anxious mood behavior changes induced by microwave radiation A, B. Effects of TET and microwave radiation on the time (A) and distance (B) of mice approaching to the central region in the open field experiment |
3. TET对微波辐射致小鼠纹状体组织结构改变的影响:微波辐射后7 d,空白对照组小鼠纹状体组织结构基本正常;辐射对照组小鼠纹状体组织可见部分神经元变性,主要表现为神经元核固缩、深染,胶质细胞水肿,血管周隙增宽,以苍白球区(GP)区较为明显;TET+辐射组纹状体组织病理学改变较辐射对照组明显改善;TET组小鼠纹状体组织结构变化不明显,见图 2。
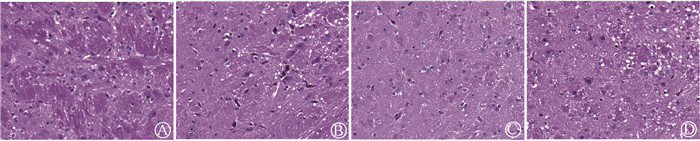
|
图 2 TET对微波辐射致小鼠纹状体苍白球区组织结构改变的影响 HE染色×60 A.空白对照组;B.辐射对照组;C.TET+辐射组;D.TET组 Figure 2 Effect of TET on the structural changes of mice striatum caused by microwave radiation HE staining ×60 A. Blank control group; B. Radiation group; C. TET group; D. TET combined with radiation group |
超微结构观察显示,微波辐射后7 d,空白对照组小鼠纹状体GP区神经元超微结构基本正常,核膜边界清晰,胞浆粗面内质网和游离核糖体含量丰富。辐射对照组小鼠纹状体GP区可见部分神经元核型不整、核沟形成,核染色质凝聚、沿核膜边集,线粒体嵴断裂或消失,粗面内质网扩张、脱颗粒;胶质细胞线粒体肿胀、局灶性空化;突触双层膜结构不清、间隙模糊;血管周隙增宽等。TET+辐射组上述超微结构改变较辐射对照组明显改善。TET组小鼠纹状体GP区超微结构未见明显变化,见图 3。以上提示,微波辐射可导致纹状体GP区组织形态病理学改变,TET对微波辐射所致纹状体组织结构损伤具有明显治疗作用。
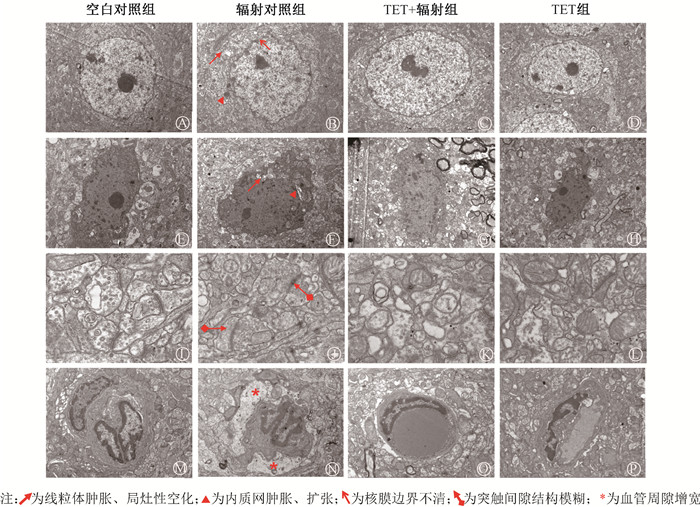
|
图 3 TET对微波辐射致小鼠纹状体苍白球区组织超微结构改变的影响 A~D.神经元,A~C ×4 000,D ×3 000;E~H.胶质细胞,E~G ×4 000,H ×3 000;I~L.突触,I和K ×2 500,J和L ×2 000;M~P.血管×600 Figure 3 Effects of TET on the ultrastructural changes of mouse striatal tissue caused by microwave radiation A-D. Neurons, A-C, ×4 000, D, ×3 000;E-H. Glial cells, E-G, × 4 000, H, × 3 000; I-L. Synapses, I, K ×2 500, J, L ×2 000;M-P. Blood vessels ×600 |
4. TET对微波辐射后小鼠纹状体VGCC基因表达的影响:实时荧光定量PCR实验结果显示,微波辐射后7 d,各实验组小鼠纹状体VGCC亚型Cav1.2、Cav1.3、Cav1.4、Cav2.1、Cav2.2、Cav2.3、Cav3.1、Cav3.2、Cav3.3 mRNA表达差异均无统计学意义(P>0.05)。提示微波辐射及TET给药对纹状体VGCC亚型基因表达均无显著影响(P>0.05)。
讨论多项研究表明,长期低剂量微波辐射可引起人、动物情绪行为改变[2, 4]。流行病学结果显示,长期暴露于电磁辐射下造成的脑损伤以脑功能障碍为主要特征,表现为人体神经系统症状发病率较高(即头痛、头晕、失眠、焦虑、记忆力衰退等)[2]。有关微波辐射对动物情绪行为的研究较多,如900 MHz、1.8 GHz、2.45 GHz、2.856 GHz等多个微波频率。由于辐射参数和辐射条件不一致、实验对象的多样性,辐射对动物情绪行为的研究结果不尽一致,但多数研究结果均表现出不同程度的焦虑、应激行为,且伴随学习记忆功能下降。Varghese等[15]将大鼠采用频率2.45 GHz、功率密度7.88 W/m2微波辐射4 h/d,连续辐射45 d。结果发现,大鼠从38 d开始出现焦虑样情绪,高架十字迷宫、浅色暗盒实验均表明,大鼠焦虑行为产生,且伴有学习记忆能力下降。Niu等[16]研究表明,以中心频率2.856 GHz、平均功率密度30 mW/cm2微波辐射大鼠15 min,辐射后大鼠中央区域路程占比、活动总路程、平均速度均显著下降,表明微波辐射可引发动物焦虑样情绪。本实验以2.856 GHz中心频率微波辐射小鼠,平均功率密度为8 mW/cm2,时长15 min,旷场实验结果显示,微波辐射可引起小鼠焦虑样行为,与以往的研究报道一致。
关于微波辐射对脑组织结构的影响,以往的研究报道主要涉及海马、皮层、血脑屏障等[17-18]。微波辐射对纹状体组织结构影响的研究报道较少,已有的研究涉及纹状体多巴胺受体及转运体表达,NO、丙二醛、过氧化氢酶水平下降,自噬基因表达升高等[5-6, 19-21]。Kim等[6]将小鼠暴露于835 MHz,比吸收率(SAR)为4.0 W/kg的电磁场,暴露时间为5 h/d,连续暴露4或12周,采用透射电镜观察到纹状体脑区出现自噬体,突触小泡数量显著减少等。qRT-PCR结果显示,自噬基因Atg5、LC3A和LC3B显著上调,LC3B-Ⅱ蛋白表达增加。本研究发现,微波辐射可导致纹状体神经元、胶质细胞、神经突触及血管超微结构病变,且以GP区较为敏感,TET给药可明显改善微波辐射所致纹状体组织病理学改变。
研究表明,微波辐射可引起神经元胞内钙超载以及钙信号相关通路活性异常[7, 22-24]。杨瑞等[25]采用10 mW/cm2辐射海马神经元5 min,发现辐射后即刻,海马神经元内Ca2+显著升高。Wood和Karipidis[24]以2.856 GHz频率、30 mW/cm2,9.4 W/kg SAR值微波辐射大鼠15 min,结果显示,TET可改善微波辐射致海马Cav1.2、Cav1.3、Cav2.2、Cav2.3表达升高。关于微波辐射对纹状体VGCC基因表达的影响尚未见报道。本研究揭示了微波辐射对纹状体VGCC基因表达影响不明显。对于微波辐射致纹状体损伤的钙信号相关机制尚未阐明。
由于微波辐射生物学效应存在一定的量效关系和时效关系,本研究在前期已成功建立的微波辐射脑损伤动物模型基础上[13, 26],继续深入探讨TET对微波辐射脑损伤的治疗作用及其作用机制。作为新型钙通道拮抗剂,TET具有抗炎、抗氧化、抗病毒、抗肿瘤、抗高血压等多种药理作用。近年来多项研究表明,TET对于血管性痴呆、认知障碍、癫痫、帕金森等神经系统疾病具有一定的防治作用,其中60 mg/kg为TET在小鼠模型中发挥神经保护作用的常用安全有效剂量。前期研究发现,TET温敏凝胶鼻腔给药可显著改善微波辐射致大鼠认知焦虑情绪改变、认知功能障碍以及海马组织结构损伤,且TET可影响海马VGCC亚型基因表达。本研究在前期研究基础上,进一步明确了TET对微波辐射致纹状体结构和功能损伤的治疗作用,同时发现,TET对微波辐射后纹状体VGCC亚型基因表达无显著影响,提示TET可能通过调控纹状体VGCC的活性及其介导的信号通路而发挥其对微波辐射脑损伤治疗作用。关于TET治疗微波辐射纹状体损伤的详细机制仍需进一步深入研究。
由于微波辐射脑损伤的分子机制未明,目前关于微波辐射脑损伤的治疗药物多以中药复方为主[21-22],尚缺乏单一靶点的治疗药物。本研究发现,钙通道拮抗剂TET对于微波辐射所致纹状体结构和功能损伤具有一定治疗作用,提示TET对于微波辐射脑损伤可能具有潜在的治疗价值。这对于微波辐射脑损伤防治药物的研发具有参考意义。
利益冲突 无
作者贡献声明 孔晓旭负责实验操作、数据分析和论文撰写;冯志华、王雪佳、何钢华、潘婷负责实验操作;许正涛负责采集数据;叶雨萌、郝延辉指导实验设计和论文修改;左红艳、李杨负责指导论文撰写
| [1] |
Magiera A, Solecka J. Radiofrequency electromagnetic radiation from Wifi and its effects on human health, in particular children and adolescents. Review[J]. Rocz Panstw Zakl Hig, 2020, 71(3): 251-259. DOI:10.32394/rpzh.2020.0125 |
| [2] |
Altpeter ES, Röösli M, Battaglia M, et al. Effect of short-wave (6-22 MHz) magnetic fields on sleep quality and melatonin cycle in humans: the Schwarzenburg shut-down study[J]. Bioelectromagnetics, 2006, 27(2): 142-150. DOI:10.1002/bem.20183 |
| [3] |
Parmar K, Tandon R, Kumar N, et al. Variations in electroencephalography with mobile phone usage in medical students[J]. Neurol India, 2019, 67(1): 235-241. DOI:10.4103/0028-3886.253610 |
| [4] |
Broom KA, Findlay R, Addison DS, et al. Early-life exposure to pulsed LTE radiofrequency fields causes persistent changes in activity and behavior in C57BL/6J mice[J]. Bioelectromagnetics, 2019, 40(7): 498-511. DOI:10.1002/bem.22217 |
| [5] |
Kim JH, Lee CH, Kim HG, et al. Decreased dopamine in striatum and difficult locomotor recovery from MPTP insult after exposure to radiofrequency electromagnetic fields[J]. Sci Rep, 2019, 9(1): 1201. |
| [6] |
Kim JH, Huh YH, Kim HR. Induction of autophagy in the striatum and hypothalamus of mice after 835 MHz radiofrequency exposure[J]. PLoS One, 2016, 11(4): e0153308. DOI:10.1371/journal.pone.0153308 |
| [7] |
Pall ML. Microwave frequency electromagnetic fields (EMFs) produce widespread neuropsychiatric effects including depression[J]. J Chem Neuroanat, 2016, 75(Pt B): 43-51. DOI:10.1016/j.jchemneu.2015.08.001 |
| [8] |
Pilla A, Fitzsimmons R, Muehsam D, et al. Electromagnetic fields as first messenger in biological signaling: application to calmodulin-dependent signaling in tissue repair[J]. Biochim Biophys Acta, 2011, 1810(12): 1236-1245. DOI:10.1016/j.bbagen.2011.10.001 |
| [9] |
张雄, 黄怀钧, 刘煜敏, 等. 粉防己碱对鼠脑缺血海马神经细胞的保护作用[J]. 同济医科大学学报, 2001, 22(1): 53-55. Zhang X, Huang HJ, Liu YM, et al. Effects of tetrandrine on intracelluar free Ca2+ and lipid peroxidation of hippocampus in rat cerebral ischemic damage[J]. Acta Univ Med Tongji, 2001, 22(1): 53-55. DOI:10.3870/j.issn.1672-0741.2001.01.017 |
| [10] |
Yu Y, Hu B, Bao J, et al. Otoprotective effects of stephania Tetrandra S. Moore herb isolate against acoustic trauma[J]. J Assoc Res Otolaryngol, 2018, 19(6): 653-668. DOI:10.1007/s10162-018-00690-3 |
| [11] |
Chang KH, Chen ML, Chen HC, et al. Enhancement of radiosensitivity in human glioblastoma U138MG cells by tetrandrine[J]. Neoplasma, 1999, 46(3): 196-200. |
| [12] |
Liu KC, Lin YJ, Hsiao YT, et al. Tetrandrine induces apoptosis in human nasopharyngeal carcinoma NPC-TW 039 cells by endoplasmic reticulum stress and Ca2+/calpain pathways[J]. Anticancer Res, 2017, 37(11): 6107-6118. DOI:10.21873/anticanres.12059 |
| [13] |
Zhang L, Pang L, Zhu S, et al. Intranasal tetrandrine temperature-sensitive in situ hydrogels for the treatment of microwave-induced brain injury[J]. Int J Pharm, 2020, 583: 119384. DOI:10.1016/j.ijpharm.2020.119384 |
| [14] |
孔晓旭, 左红艳, 李杨. 粉防己碱的药理作用及临床应用研究进展[J]. 国际药学研究杂志, 2020, 47(7): 496-501. Kong XX, Zuo HY, Li Y. Pharmacological effects and clinical application of tetrandrine: research advances[J]. J Int Pharm Res, 2020, 47(7): 496-501. DOI:10.13220/j.cnki.jipr.2020.07.002 |
| [15] |
Varghese R, Majumdar A, Kumar G, et al. Rats exposed to 2.45 GHz of non-ionizing radiation exhibit behavioral changes with increased brain expression of apoptotic caspase 3[J]. Pathophysiology, 2018, 25(1): 19-30. DOI:10.1016/j.pathophys.2017.11.001 |
| [16] |
Niu X, Zhao Y, Yang N, et al. Proteasome activation by insulin-like growth factor-1/nuclear factor erythroid 2-related factor 2 signaling promotes exercise-induced neurogenesis[J]. Stem Cells, 2020, 38(2): 246-260. DOI:10.1002/stem.3102 |
| [17] |
杨瑞, 彭瑞云, 高亚兵, 等. 高功率微波辐射对大鼠海马的损伤效应[J]. 中华劳动卫生职业病杂志, 2004, 22(3): 211-214. Yang R, Peng RY, Gao YB, et al. Studies on the injury effects of hippocampus induced by high power microwave radiation in rat[J]. Chin J Ind Hyg Occup Dis, 2004, 22(3): 211-214. DOI:10.3760/cma.j.issn.1001-9391.2004.03.015 |
| [18] |
王丽峰, 彭瑞云, 胡向军, 等. 微波辐射对大鼠大脑皮质突触结构和神经递质含量的影响[J]. 解放军医学杂志, 2009, 34(10): 1188-1190. Wang LF, Peng RY, Hu XJ, et al. Effect of microwave radiation on synapsis structure and the contents of neurotransmitters in cerebral cortex of Wistar rats[J]. Med J Chin PLA, 2009, 34(10): 1188-1190. DOI:10.3321/j.issn:0577-7402.2009.10.009 |
| [19] |
Ahmed NA, Radwan NM, Aboul Ezz HS, et al. The chronic effect of pulsed 1800 MHz electromagnetic radiation on amino acid neurotransmitters in three different areas of juvenile and young adult rat brain[J]. Toxicol Ind Health, 2018, 34(12): 860-872. DOI:10.1177/0748233718798975 |
| [20] |
卢永辉, 何旻蒂, 刘川, 等. 电磁辐射暴露后不同脑区的氧化应激反应[J]. 局解手术学杂志, 2013, 22(5): 482-484. Lu YH, He MD, Liu C, et al. Oxidative stress responses of different encephalic regions after electromagnetic fields exposure[J]. J Reg Anat Oper Surg, 2013, 22(5): 482-484. DOI:10.11659/jjssx.1672-5042.201305010 |
| [21] |
Ahmed NA, Radwan NM, Aboul Ezz HS, et al. The antioxidant effect of green tea mega EGCG against electromagnetic radiation-induced oxidative stress in the hippocampus and striatum of rats[J]. Electromagn Biol Med, 2017, 36(1): 63-73. DOI:10.1080/15368378.2016.1194292 |
| [22] |
Tekieh T, Sasanpour P, Rafii-Tabar H. Effects of electromagnetic field exposure on conduction and concentration of voltage gated calcium channels: a brownian dynamics study[J]. Brain Res, 2016, 1646: 560-569. DOI:10.1016/j.brainres.2016.06.034 |
| [23] |
Pall ML. Scientific evidence contradicts findings and assumptions of Canadian Safety Panel 6:microwaves act through voltage-gated calcium channel activation to induce biological impacts at non-thermal levels, supporting a paradigm shift for microwave/lower frequency electromagnetic field action[J]. Rev Environ Health, 2015, 30(2): 99-116. DOI:10.1515/reveh-2015-0001 |
| [24] |
Wood A, Karipidis K. Radiofrequency fields and calcium movements into and out of cells[J]. Radiat Res, 2021, 195(1): 101-113. DOI:10.1667/RADE-20-00101.1 |
| [25] |
杨瑞, 彭瑞云, 高亚兵, 等. 微波辐射对大鼠海马神经元的损伤效应及其机制研究[J]. 中华物理医学与康复杂志, 2006, 28(10): 670-673. Yang R, Peng RY, Gao YB, et al. The effect of microwaves on hippocampal neurons in vitro and its mechanism[J]. Chin J Phys Med Rehabil, 2006, 28(10): 670-673. DOI:10.3760/j:issn:0254-1424.2006.10.0006 |
| [26] |
胡翠翠, 常晨旭, 孔晓旭, 等. 微波辐射对小鼠联合型学习记忆功能及海马组织结构的影响[J]. 中华放射医学与防护杂志, 2022, 42(7): 481-486. Hu CC, Chang CX, Kong XX, et al. Influence of microwave radiation on associative learning and memory function and hippocampal structure in mice[J]. Chin J Radiol Med Prot, 2022, 42(7): 481-486. DOI:10.3760/cam.j.cn112271-20220324-00120 |
 2023, Vol. 43
2023, Vol. 43


