2. 北京核工业医院体检中心, 北京 100045
2. Medical examination center, Beijing Nuclear Industry Hospital, Beijing 100045, China
放射性肠损伤威胁事故受照人员的生命[1],影响腹部或盆腔放疗效果及患者预后。因此,阐明电离辐射造成肠损伤的作用机制十分重要。环状RNA(circular RNA,circRNAs)是一类具有调控功能的新型内源性非编码RNA,通过结构基因的前体mRNA反向剪切而形成[2]。已知电离辐射可以改变circRNAs表达谱[3-5]。研究人员利用全转录组测序检测14 Gy 137Cs γ射线照射后3.5 d小鼠空肠组织circRNAs表达水平变化,发现42个circRNAs表达水平上调,48个circRNAs表达水平下调[6]。然而,电离辐射是否通过circRNAs调控小肠上皮细胞增殖,目前还不清楚。本研究前期通过全转录组测序技术在人淋巴细胞株AHH-1中筛选出辐射差异表达circRNAs hsa_circZDHHC21_004,电离辐射可上调该circRNAs的表达水平。Hsa_circZDHHC21_004在基因组中的位置为chr9∶14639893-14680160,由其来源基因ZDHHC21的3~8号外显子通过反向剪切而形成,成熟的hsa_circZDHHC21_004全长为796 nt。本研究选择人小肠上皮细胞HIEC-6,检测电离辐射是否影响hsa_circZDHHC21_004表达水平,并初步探讨了hsa_circZDHHC21_004表达水平变化对电离辐射作用后HIEC-6细胞增殖能力的影响。
材料与方法1. 细胞培养:将正常人小肠上皮细胞HIEC-6(美国模式培养物集存库ATCC)接种在OPTI-MEM培养基中(美国GIBCO公司),其中添加4%胎牛血清(美国GIBCO公司)。将sh-circZDHHC21稳定细胞系(以HIEC-6为基础,本研究自行构建)培养在OPTI-MEM培养基中,其中添加4%胎牛血清、1%青霉素和链霉素(美国GIBCO公司)和终浓度为0.67 μg/ml的嘌呤霉素(北京碧云天公司)。所有细胞均置于含5% CO2、饱和湿度、37℃恒温培养箱中培养。
2. 细胞照射:将处于对数生长期细胞分别照射0、5、10和15 Gy,检测60Co γ射线对hsa_circZDHHC21_004表达水平的影响。将细胞分别照射0和10 Gy,检测电离辐射对hsa_circZDHHC21_004稳定敲低细胞系增殖的影响。将细胞分别照射0、2和5 Gy,进行克隆形成实验。本研究中,所有照射剂量率均为1 Gy/min,60Co源由北京师范大学钴源室提供,样品到源的距离为68 cm,均匀辐照面积为30 cm × 30 cm。
3. 总RNA提取:采用RNAprep总细胞/细菌试剂盒(北京天根公司)提取细胞总RNA,具体方法参考试剂盒说明书。所有RNA样品浓度均通过SMA4000紫外-可见光分光光度计(美国Merinton公司)进行定量。
4. 特异性扩增引物设计:根据circRNAs分子结构特点,设计跨反向剪切位点的扩增引物。所用软件为circPrimer2.0[7]。利用Primer-Blast(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?LINK_LOC=BlastHome)设计hsa_circZDHHC21_004来源基因ZDHHC21及内参基因特异性扩增引物。本研究中所用引物如表 1所示。
|
|
表 1 本研究中所用引物 Table 1 The primers used in this study |
5. RNase R消化:在确定circRNAs扩增引物的特异性时,将2 μg总RNA平均分为两份,每份各1 μg,其中一份加入1U RNase R(广州吉赛生物公司),另一份不加。将这两组RNA在37℃水浴中孵育30 min。消化产物用苯酚-氯仿试剂提取回收RNA。
6. CircRNAs扩增引物产物测序:为最终确定circRNAs扩增引物的特异性,需将hsa_circZDHHC21_004引物所扩增出的产物进行测序,以确定其是否为目的产物。以细胞总cDNA为模板进行普通聚合酶链式反应(polymerase chain reaction, PCR)。通过普通DNA凝胶电泳和琼脂糖凝胶DNA回收试剂盒(增强型,北京天根公司)回收纯化PCR产物,送测序公司进行测序。
7. 实时荧光定量PCR(real-time PCR):使用circRNAs反转录试剂盒(广州吉赛生物公司)将所有样品的总RNA反转录为cDNA。利用circRNAs荧光定量检测试剂盒(广州吉赛生物公司)和Applied biosystem 7500快速实时PCR系统检测hsa_circZDHHC21_004或ZDHHC21表达量。选择U6和GAPDH作为内参基因进行归一化处理。采用2-ΔΔCT法计算实验组与对照组间各基因表达水平的变化倍数。所有样品检测均设置3个平行样,实验至少重复3次。
8. sh-circZDHHC21稳定细胞系构建:为分析hsa_circZDHHC21_004表达量变化是否影响细胞增殖,利用shRNA技术,通过慢病毒载体构建hsa_circZDHHC21_004稳定敲低细胞系(sh-circZDHHC21)。慢病毒载体骨架为GV493(hU6-MCS-CBh-gcGFP-IRES-puromycin)。为防止干扰序列非特异性结合到circRNAs的来源基因上,所设计的候选干扰序列均跨hsa_circZDHHC21_004反向剪切位点。对照细胞系为不含干扰序列的慢病毒载体所构建。本研究中所设计的3个候选干扰序列如表 2中所示。
|
|
表 2 构建hsa_circZDHHC21_004稳定敲低细胞系所用候选干扰序列 Table 2 The siRNAs used for constructing the hsa_circZDHHC21_004 knockdown cells |
9. CCK-8实验:利用CCK-8实验检测电离辐射对hsa_circZDHHC21_004敲低前后细胞增殖的影响。照射前将细胞接种于96孔板,每孔接种3 000个细胞,接种体积为100 μl。每剂量点每时间点设置5个平行孔。分别在照射后0、24、48和72 h检测各孔细胞存活情况。检测时每孔加入10 μl CCK-8试剂(日本DOJINDO公司),轻轻混匀。置于37℃培养箱中孵育2 h,于450 nm下检测各孔吸光度(A)值。
10. 克隆形成实验:利用克隆形成实验检测电离辐射对hsa_circZDHHC21_004敲低前后细胞增殖的影响。照射前将细胞接种于6孔板,每孔接种500个细胞,接种体积为2 ml。每剂量点设置3个平行孔。接种24 h后进行细胞照射,照射后将细胞置于37℃培养箱中培养9 d,每孔加1 ml无水甲醇于室温下固定细胞1 h,然后去掉无水甲醇,晾干,姬姆萨染色30 min,计数每孔细胞克隆数。
11. 统计学处理:本研究采用SPSS 22.0软件进行统计学分析。计量资料符合正态分布,以x±s表示。组间均数比较符合方差齐性,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
结果1. Hsa_circZDHHC21_004扩增引物特异性验证:根据circRNAs分子自身结构特点,所设计的扩增引物需跨其反向剪切位点(图 1)。为确保PCR过程中产生的产物均以circRNAs为模板,需验证所设计的circRNAs扩增引物的特异性。利用RNase R验证了引物所扩增出的产物是否来自于circRNAs。结果如图 1所示,hsa_circZDHHC21_004的表达水平及其来源基因表达水平均在RNase R处理后下降,且差异具有统计学意义(t = 7.74、7.28,P < 0.01),但hsa_circZDHHC21_004下降倍数明显小于其来源基因。通过对产物进行测序,证明产物序列中包含hsa_circZDHHC21_004反向剪切位点序列,表明所设计的引物特异地以hsa_circZDHHC21_004为模板进行扩增。
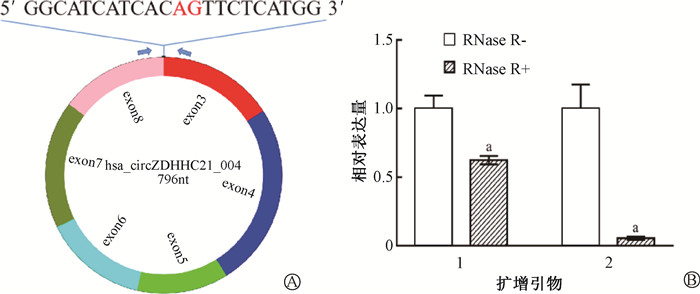
|
注:1. Hsa_circZDHHC21_004;2. ZDHHC21;a与RNase R-比较,t=7.74、7.28,P < 0.01 图 1 Hsa_circZDHHC21_004扩增引物特异性验证 A. Hsa_circZDHHC21_004结构及反向剪切位点序列示意图;B. RNase R处理前后hsa_circZDHHC21_004及ZDHHC21表达量变化 Figure 1 Validation of the specificity of hsa_circZDHHC21_004 amplification primers A. The schematic diagram of hsa_circZDHHC21_004 molecular structure and the reverse-splicing site; B. The expression levels of hsa_circZDHHC21_004 and ZDHHC21 with and without RNase R treatment |
2. 电离辐射上调HIEC-6细胞中hsa_circZDHHC21_004表达水平:将HIEC-6细胞照射0、5、10、15 Gy后,hsa_circZDHHC21_004的相对表达水平随辐射剂量的增加而升高,分别为1.00±0.24、1.34±0.28、1.85±0.31、2.80±0.64(F=10.86,P=0.008)。其中,10和15 Gy组与0 Gy组比较,差异具有统计学意义(P < 0.05)。说明电离辐射可上调HIEC-6中hsa_circZDHHC21_004表达水平。
3. 构建hsa_circZDHHC21_004稳定敲低细胞系:首先利用shRNA技术,通过慢病毒载体及嘌呤霉素构建筛选了hsa_circZDHHC21_004稳定敲低细胞系。利用real-time PCR技术验证候选干扰序列干扰效果。结果如图 2所示,与未转染任何慢病毒载体细胞株相比(即WT),仅转染空载体(即sh-Ctrl)对hsa_circZDHHC21_004表达水平的降低差异无统计学意义(P>0.05)。3个候选干扰序列中,与WT相比,sh1-circZDHHC21及sh2-circZDHHC21均降低hsa_circZDHHC21_004表达水平,且差异具有统计学意义(t=6.08、3.30,P < 0.05)。其中sh1-circZDHHC21干扰效果最佳,使hsa_circZDHHC21_004表达水平降低为WT的(38±0.5)%。同时与WT组及sh-Ctrl组相比,sh1-circZDHHC21干扰序列对hsa_circZDHHC21_004来源基因ZDHHC21表达水平的改变差异无统计学意义(P>0.05,图 2)。因此选择含sh1-circZDHHC21干扰序列的hsa_circZDHHC21_004稳定敲低细胞系进行后续实验。
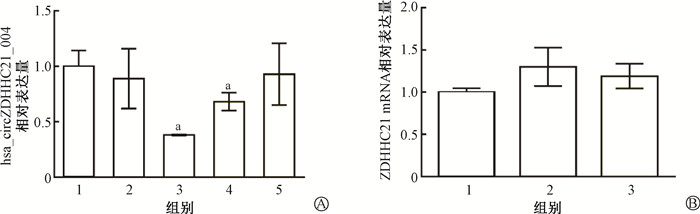
|
注:1. WT;2. sh-Ctrl;3. sh1-circZDHHC21;4. sh2-circZDHHC21;5. sh3-circZDHHC21。a与WT比较,t= 6.08、3.30,P < 0.05 图 2 Hsa_circZDHHC21_004稳定敲低细胞系构建 A. 候选干扰序列对HIEC-6中hsa_circZDHHC21_004表达水平干扰效果验证;B. 干扰序列sh1-circZDHHC21对HIEC-6中ZDHHC21表达水平干扰效果验证 Figure 2 Construction of hsa_circZDHHC21_004 knockdown cells A. The interfering efficiency of candidate interference sequences of hsa_circZDHHC21_004; B. The interfering efficiency of sh1-circZDHHC21 on the expression of ZDHHC21 in HIEC-6 cells |
4. 下调hsa_circZDHHC21_004表达水平提高电离辐射后HIEC-6细胞的增殖:获得稳定敲低细胞系后,通过CCK-8实验检测两种细胞系在照射前后,培养0、24、48和72 h后细胞的增殖情况,照射剂量为0和10 Gy。结果如图 3所示,未照射时,sh-circZDHHC21的增殖在培养24及48 h时大于sh-Ctrl的增殖,48 h时两者间差异有统计学意义(t=6.80,P < 0.001)。但在培养72 h时sh-circZDHHC21的增殖小于sh-Ctrl的增殖,且差异有统计学意义(t=8.28,P < 0.001)。照射10 Gy时,除0 h外,sh-circZDHHC21细胞的增殖在照后24、48、72 h均高于sh-Ctrl细胞的增殖,且差异具有统计学意义(t=-6.25、-5.83、-7.75,P < 0.001)。随后通过克隆形成实验对hsa_circZDHHC21_004影响电离辐射后HIEC-6细胞增殖情况做了进一步验证。结果如图 4所示,sh-circZDHHC21与sh-Ctrl的细胞克隆数均随照射剂量的增加而减少。以各自细胞系的0 Gy为对照,2和5 Gy照射后的sh-circZDHHC21细胞克隆形成率均高于sh-Ctrl细胞,且差异均有统计学意义(t=-7.45、-8.83,P < 0.01)。CCK-8实验和克隆形成实验的结果均说明hsa_circZDHHC21_004表达水平的改变对电离辐射后HIEC-6细胞增殖能力有影响,下调hsa_circZDHHC21_004表达水平能够提高电离辐射后HIEC-6细胞的增殖能力。
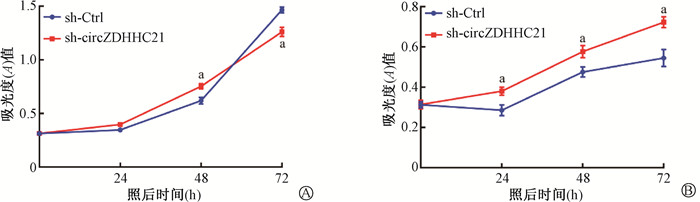
|
注:a与sh-Ctrl比较,t = 6.80、8.28、-6.25、-5.83、-7.75,P < 0.001 图 3 0 Gy(A)及10 Gy(B)照射后72 h内sh-Ctrl细胞和sh-circZDHHC21细胞的增殖变化 Figure 3 The proliferations of HIEC-6 transfected with sh-circZDHHC21 or its control at 72 h after irradiation with 0 Gy (A) and 10 Gy (B) |
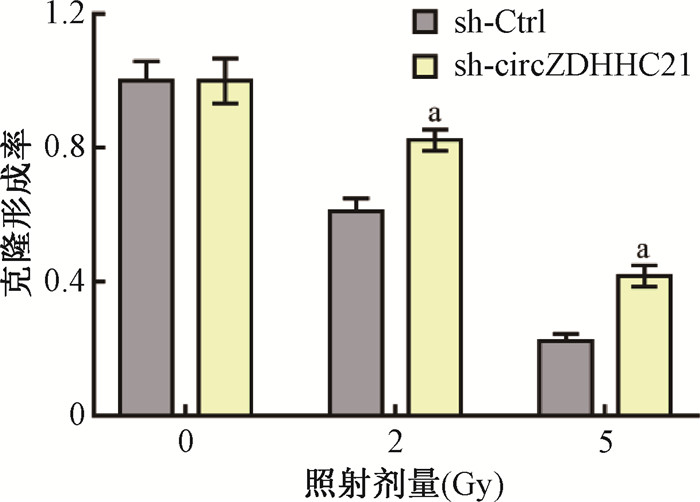
|
注:a与sh-Ctrl比较,t =-7.45、-8.83,P < 0.01 图 4 下调hsa_circZDHHC21_004表达水平对电离辐射照射后HIEC-6细胞克隆形成率的影响 Figure 4 The influence of hsa_circZDHHC21_004 knockdown on the colony formation of HIEC-6 cells after irradiation |
讨论
本研究分析了环状RNA hsa_circZDHHC21_004对电离辐射后人小肠上皮细胞HIEC-6细胞增殖的影响。发现电离辐射可上调HIEC-6中hsa_circZDHHC21_004表达水平,如下调hsa_circZDHHC21_004表达水平可提高电离辐射后HIEC-6细胞的增殖。
放射性肠损伤是腹部放疗或盆腔放疗的主要不良反应。尽管精准放疗技术可以帮助减轻不良反应,但多数患者的肠组织会在放疗后数周内出现不同程度的急性损伤症状,5%~55%的患者会出现慢性放射性肠炎[8-9],90%的患者排便习惯发生永久性改变[10]。小肠相比于结肠及直肠,对电离辐射更加敏感。辐射可损伤小肠黏膜导致上皮细胞萎缩和黏膜血流减少[11],这可能导致腹痛或腹泻。因此,小肠上皮细胞的增殖能力对缓解放射性肠损伤,恢复小肠组织健康极为重要。有研究人员发现,N-氧基-D-苯丙氨酸(N-oxalyl-D-phenylalanine,NOFD)通过促进缺氧诱导因子的表达,进而促进辐射诱导肠损伤的恢复。该研究团队利用RNA深度测序和生物信息学分析筛选了小鼠腹部经13 Gy照射后3.5 d,NOFD预处理组与未处理组间小肠隐窝的差异表达RNA,预测出2个新circRNAs(circRNA2909和circRNA0323)可能通过靶向mmu-miR-148a-3p和mmu-miR-92a-1-5p调控缺氧诱导因子相关通路基因HIF1A和NOS2的表达[12]。该研究在生物信息学水平提示,circRNAs可能在NOFD改善辐射诱导肠损伤中发挥调控作用。本研究观察了照射后早期hsa_circZDHHC21_004表达水平随照射剂量的变化,发现照后4 h其表达水平随着照射剂量而升高,且照射剂量>10 Gy时,该circRNAs较未照射时的变化差异具有统计学意义,说明hsa_circZDHHC21_004对电离辐射的响应较为迅速,具有调控后续由辐射引起的生物学效应的可能性。对于细胞增殖,本研究选择观察至少3个细胞周期内(即72 h) 细胞增殖的变化情况,CCK-8实验和克隆形成实验均显示,hsa_circZDHHC21_004的下调可提高辐射后人小肠上皮细胞的增殖能力。但未照射时,sh-Ctrl细胞的存活率较sh-circZDHHC21细胞在培养48和72 h时呈相反的结果,这可能与两种细胞生长速率间依然存在差异有关,但这样的差异未使得其中一种细胞的生长在未照射时稳定地快于另一种细胞。而照射后,在培养的各个时间点,sh-circZDHHC21细胞的生长均稳定地高于sh-Ctrl细胞,这提示hsa_circZDHHC21_004可能参与电离辐射后小肠上皮细胞增殖的调控。
circRNAs作为具有调控功能的非编码RNA,主要通过3种功能在多种生物学途径中发挥重要作用。circRNAs可通过与miRNA相互作用调控基因表达。circRNAs包含不同的miRNA反应元件,可与多个不同的靶miRNA相互作用来作为靶miRNA的特异性抑制剂。当circRNAs与靶miRNA相互作用时,miRNA与其靶基因的结合将被中断。消除了miRNA对基因表达的沉默效应。最后,下游靶基因表达上调[13]。通过miRanda软件预测可能与hsa_circZDHHC21_004存在相互作用的靶miRNA,经过过滤保留了144个miRNA,得分最高的为hsa-miR-299-3p。hsa_circZDHHC21_004是否通过与hsa-miR-299-3p相互作用调控细胞的增殖还需进一步研究。
circRNAs的第二大功能是与蛋白质相互作用。主要体现在以下几方面:①circRNAs可通过特异性结合位点与RNA结合蛋白相互作用,充当蛋白质“海绵”,如circRNAs与翻译调控因子结合使其不能与靶mRNA结合,部分或完全抑制靶mRNA的翻译[14]。②作为蛋白质“诱饵”去决定某些RNA结合蛋白的亚细胞定位[15]。③作为蛋白质“支架”去组装功能蛋白形成大的复合体来调控翻译[16]。④募集转录因子到基因的启动子区,影响转录[17]。通过数据库查询,可能与hsa_circZDHHC21_004有相互作用的蛋白有EIF4A3、PTB和IGF2BP1。IGF2BP1为胰岛素样生长因子2 mRNA结合蛋白1,其主要功能是可结合到IGF2的mRNA上调控翻译。IGF2的编码产物是调控增殖与发育的重要蛋白[18]。hsa_circZDHHC21_004是否通过与IGF2BP1相互作用调节IGF2的翻译进而影响HIEC-6的增殖还需后续研究。
circRNAs第三类功能是具有蛋白质编码功能,一些circRNAs不是通过自身参与调控,而是通过其编码的多肽来发挥作用[19]。hsa_circZDHHC21_004序列来自ZDHHC21的3号至8号外显子,其中包含CDS序列及起始密码子,这使hsa_circZDHHC21_004具有编码多肽的可能。但仍需后续研究予以证明。
综上所述,hsa_circZDHHC21_004的下调可提高电离辐射诱导后人小肠上皮细胞HIEC-6的增殖,这为探索circRNAs在放射性肠损伤中的作用奠定了初步基础。但hsa_circZDHHC21_004调控辐射诱导HIEC-6细胞增殖的机制还需进一步系统性的研究。
利益冲突 无
作者贡献声明 田雪蕾负责实验操作、数据分析和论文撰写;刘海翔、陆雪负责circRNAs稳定敲低细胞系构建;田梅、刘青杰负责课题设计和论文修改
| [1] |
Donnelly EH, Nemhauser JB, Smith JM, et al. Acute radiation syndrome: assessment and management[J]. South Med J, 2010, 103(6): 541-546. DOI:10.1097/SMJ.0b013e3181ddd571 |
| [2] |
Vicens Q, Westhof E. Biogenesis of circular RNAs[J]. Cell, 2014, 159(1): 13-14. DOI:10.1016/j.cell.2014.09.005 |
| [3] |
He N, Sun Y, Yang M, et al. Analysis of circular RNA expression profile in HEK 293T cells exposed to ionizing radiation[J]. Dose Response, 2019, 17(2): 1559325819837795. DOI:10.1177/1559325819837795 |
| [4] |
Chen YY, Jiang MJ, Tian L. Analysis of exosomal circRNAs upon irradiation in pancreatic cancer cell repopulation[J]. BMC Med Genomics, 2020, 13(1): 107. DOI:10.1186/s12920-020-00756-3 |
| [5] |
Pei W, Tao L, Zhang LW, et al. Circular RNA profiles in mouse lung tissue induced by radon[J]. Environ Health Prev Med, 2017, 22(1): 36. DOI:10.1186/s12199-017-0627-6 |
| [6] |
Lu Q, Gong W, Wang J, et al. Identification of circular RNAs altered in mouse Jejuna after radiation[J]. Cell Physiol Biochem, 2018, 47(6): 2558-2568. DOI:10.1159/000491652 |
| [7] |
Zhong S, Feng J. CircPrimer 2.0:a software for annotating circRNAs and predicting translation potential of circRNAs[J]. BMC Bioinformatics, 2022, 23(1): 215. DOI:10.1186/s12859-022-04705-y |
| [8] |
Khalid U, McGough C, Hackett C, et al. A modified inflammatory bowel disease questionnaire and the Vaizey Incontinence questionnaire are more sensitive measures of acute gastrointestinal toxicity during pelvic radiotherapy than RTOG grading[J]. Int J Radiat Oncol Biol Phys, 2006, 64(5): 1432-1441. DOI:10.1016/j.ijrobp.2005.10.007 |
| [9] |
Lefevre JH, Amiot A, Joly F, et al. Risk of recurrence after surgery for chronic radiation enteritis[J]. Br J Surg, 2011, 98(12): 1792-1797. DOI:10.1002/bjs.7655 |
| [10] |
Stacey R, Green JT. Radiation-induced small bowel disease: latest developments and clinical guidance[J]. Ther Adv Chronic Dis, 2014, 5(1): 15-29. DOI:10.1177/2040622313510730 |
| [11] |
Hauer-Jensen M, Wang J, Boerma M, et al. Radiation damage to the gastrointestinal tract: mechanisms, diagnosis, and management[J]. Curr Opin Support Palliat Care, 2007, 1(1): 23-29. DOI:10.1097/SPC.0b013e3281108014 |
| [12] |
Yang YW, Meng X, Meng YY, et al. ceRNA regulatory network of FIH inhibitor as a radioprotector for gastrointestinal toxicity by activating the HIF-1 pathway[J]. Mol Ther Nucleic Acids, 2021, 25: 173-185. DOI:10.1016/j.omtn.2021.05.008 |
| [13] |
Hansen TB, Jensen TI, Clausen BH, et al. Natural RNA circles function as efficient microRNA sponges[J]. Nature, 2013, 495(7441): 384-388. DOI:10.1038/nature11993 |
| [14] |
Abdelmohsen K, Panda AC, Munk R, et al. Identification of HuR target circular RNAs uncovers suppression of PABPN1 translation by CircPABPN1[J]. RNA Biol, 2017, 14(3): 361-369. DOI:10.1080/15476286.2017.1279788 |
| [15] |
Zeng Y, Du WW, Wu Y, et al. A circular RNA binds to and activates AKT phosphorylation and nuclear localization reducing apoptosis and enhancing cardiac repair[J]. Theranostics, 2017, 7(16): 3842-3855. DOI:10.7150/thno.19764 |
| [16] |
Du WW, Yang W, Liu E, et al. Foxo3 circular RNA retards cell cycle progression via forming ternary complexes with p21 and CDK2[J]. Nucleic Acids Res, 2016, 44(6): 2846-2858. DOI:10.1093/nar/gkw027 |
| [17] |
Chen N, Zhao G, Yan X, et al. A novel FLI1 exonic circular RNA promotes metastasis in breast cancer by coordinately regulating TET1 and DNMT1[J]. Genome Biol, 2018, 19(1): 218. DOI:10.1186/s13059-018-1594-y |
| [18] |
Sélénou C, Brioude F, Giabicani E, et al. IGF2:development, genetic and epigenetic abnormalities[J]. Cells, 2022, 11(12): 1886. DOI:10.3390/cells11121886 |
| [19] |
Ye F, Gao G, Zou Y, et al. circFBXW7 inhibits malignant progression by sponging miR-197-3p and encoding a 185-aa protein in triple-negative breast cancer[J]. Mol Ther Nucleic Acids, 2019, 18: 88-98. DOI:10.1016/j.omtn.2019.07.023 |
 2023, Vol. 43
2023, Vol. 43


