2. 中国人民解放军西部战区总医院体检中心,成都 610083
2. Medical Examination Center, PLA Western Theater General Hospital, Chengdu 610083, China
放疗在肿瘤治疗中的地位日益突出,约70%的恶性肿瘤患者在治疗过程中需要用到放疗,约40%可以用放疗根治, 治愈率仅次于手术治疗[1]。放疗的飞速发展给无数肿瘤患者带来福音,延长了患者的生存期,但同时也造成了周围组织器官的损伤。放射诱导的损伤分为早期效应和晚期效应,早期效应通常在放射治疗期间或治疗后1~2周出现,包括皮肤黏膜病变、胃肠道综合征等;晚期效应可能在治疗后数月或数年出现,包括放射引起的纤维化、萎缩、血管损伤、神经损伤等[2]。早期效应一般是短暂的,通常在数周后稳定下来或消失,而晚期效应不可逆,甚至会渐进性加重。肾脏是放射迟发型敏感器官,放射性肾病是指在放疗过程中引起的包括血管、肾小球和肾小管间质等的损伤[3]。放射性肾病不仅增加患者经济负担、降低患者的生活质量,还影响肿瘤最佳放疗剂量的选择。随着肿瘤幸存者的增多和生存期的延长,预防和减少放射治疗的晚期不良反应越发重要。然而,目前放射性肾病的发病机制尚不清楚,也缺乏诊断金标准和行之有效的治疗手段。本文重点从发病机制、诊断和治疗等方面综述放射性肾病的研究进展,旨在为放射性肾病的研究和临床诊疗提供参考。
一、放射性肾病的表现1. 临床表现:放射性肾病的病因包括放射治疗、放射性核素治疗、骨髓移植前全身照射(total body irrdiation,TBI)等[3],其中以放射治疗为主。肾脏是放射迟发型敏感器官,放射剂量(单次剂量2 Gy)累积>20 Gy就会引起肾脏损伤,表现为水肿、高血压、肾功能减退以及不同程度的贫血。在接触放射线后的3~4个月内一般没有任何症状或临床体征,这就是放射性肾病的临床前阶段,即潜伏期。此时肾脏体积正常或轻微增大,肾小球滤过率(glomerular filtration rate, GFR)正常或轻度升高。放射性肾病的临床阶段包括急性放射性肾病、慢性放射性肾病、溶血性尿毒综合征(hemolytic uemic syndrome, HUS)/血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura, TTP)几种类型[4-6]。
急性放射性肾病通常发生在放射治疗后4~12个月[7],以肾小球损伤为主,表现为蛋白尿、进行性贫血,此时肾脏体积一般正常,生化结果提示肌酐、尿素氮迅速升高,GFR下降,尿液检查提示蛋白尿、镜下血尿、管型尿等,部分患者伴有高血压、高钾血症和酸中毒。
慢性放射性肾病多由急性放射性肾病迁延不愈所致,出现在放射治疗一至数年后,包括肾小球、肾小管及间质的损伤,肾脏体积逐渐缩小,伴随蛋白尿、肾功能逐渐减退、尿浓缩功能减退、轻度高血压等表现。
溶血性尿毒综合征以微血管病性溶血性贫血、血小板减少和急性肾功能衰竭为表现[8-9],出现高血压、水肿、溶血性贫血、血栓性血小板减少、外周血红细胞碎片阳性等,多发生于放射治疗联合化疗过程中,还可合并消化系统或心血管系统并发症[10]。目前认为与补体相关基因突变或抗体存在介导的补体替代途径过度激活有关[11]。
2. 病理表现:大剂量放射线会损伤肾脏大部分或所有成分,首先出现肾小球损伤,包括内皮细胞、系膜细胞等,出现系膜细胞溶解、纤维蛋白样变性等特征性表现,甚至发展为肾小球纤维化[12-13];随后出现肾小管及间质损伤,包括小管溶解,肾小管间质瘢痕形成、管腔扩大,炎症介质游出;肾间质小动脉内膜增厚,管腔狭窄等[7]。周琰[14]使用直线加速器对大鼠进行照射以研究放射所致肾脏损伤,结果发现,不同剂量的放射后肾小球病变出现先于肾小管和肾间质病变,且随时间延长,病变逐渐加重。另一项研究表明,8 Gy的γ射线照射肾脏可出现肾小球萎缩、肾小管管腔扩张、核固缩等表现[15]。
二、肾脏放射毒性的剂量阈值放射性肾病临床特征的严重程度取决于受照射的类型,如局部照射或全身照射,内照射或外照射等。而肾脏的剂量阈值还受到受照射肾脏体积的影响,只有受到大于肾脏放射毒性的剂量阈值照射,临床上才会观察到明显的肾脏损伤。另外,受照射个体是否存在慢性肾脏病(chronic kidney disease, CKD)高危因素(如高血压、糖尿病等)也会影响肾脏剂量阈值。为了限制放射对肾脏的毒性,临床研究建议在局部照射中限制双肾的平均剂量在18 Gy以下[16]。在盆腔腹肿瘤中,双肾平均剂量为18 Gy的患者在12~24个月的观察时间内没有临床症状[17]。临床正常组织效应的定量分析(quantitative analyses of normal tissue effects in the clinic, QUANTEC)的数据显示,如果双肾受到平均剂量>18 Gy的照射,高达50%的患者会出现临床相关的肾功能障碍。如果 < 20%的肾脏体积暴露于28 Gy(V28<20%),只有<5%的患者会出现临床相关的肾功能障碍。美国医学物理学家学会(American Association of Physicists in Medicine,AAPM)建议,胸部肿瘤中,如果受照射的肾脏体积在40%以上,肾脏暴露剂量应 < 20 Gy(V20<40%)。腹腔肿瘤中,肝癌放疗双肾照射剂量应<18 Gy,胃癌、胰腺癌放疗双肾剂量应<15 Gy,30%肾脏体积受照射,则暴露剂量不宜超过20 Gy(V18-20<30%)[18]。
三、放射性肾病可能的发病机制虽然肾脏的剂量阈值在不同的放射治疗模式中可能有所不同,但其内在分子机制并不存在差异。因此,无论应用形式如何,放射性肾病可能的分子机制都将被讨论。放射性肾病可能涉及的机制包括DNA损伤与修复、炎症、氧化应激、肾素-血管紧张素-醛固酮(RASS)系统激活、细胞衰老、纤维化等[10]。
1.DNA损伤与修复:DNA不是惰性的,而是对自然和环境中普遍存在的元素如氧自由基、紫外光线、放射线等具有高度的反应性。为此,人体被赋予了一个复杂的工具箱来监测和修复DNA的损伤,被称为DNA损伤反应(DNA damage response, DDR)[19]。自然和环境损伤导致DNA双链断裂(DNA double-strand breaks, DSB),需要修复以限制正常细胞功能损失。在放射性肾病中,电离辐射可以直接引起DNA损伤,引起DSB,研究发现在哺乳动物细胞中电离辐射可诱导约850个嘧啶改变、450个嘌呤改变、1 000个单链断裂及20~40个双链断裂,这种急性的DNA损伤可以导致肾脏细胞立即死亡[20-21]。而在急性期存活的细胞中,DDR被高度激活[22]。DDR检测DNA损伤,并组装和修复损伤的DNA。由于DNA不断被破坏,DDR也被不断重组和部署,这部分存活的细胞也可能因为错误的修复机制长期诱导细胞死亡或衰老。细胞死亡、细胞衰老和放射本身释放的细胞因子会引发慢性炎症,细胞衰老和慢性炎症最终导致肾脏纤维化[23](图 1)。
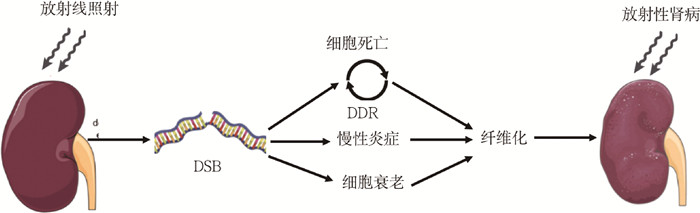
|
图 1 DNA损伤与修复在放射性肾病发病中的作用 Figure 1 The role of DNA damage and repair in the pathogenesis of radiation nephropathy |
2.氧化应激:大剂量放射线损伤肾脏肾小球、肾小管上皮细胞,导致氧化还原系统功能障碍,活性氧(ROS)和丙二醛(MDA)等氧化产物生成增多,还原型谷胱甘肽(GSH)等还原产物生成减少。氧化还原系统在放射诱导组织损伤的早期和晚期效应中起着重要作用[11],当细胞受到放射的数纳秒内会立即产生自由基[24],有可能持续数年。为了研究氧化还原系统在放射性肾病中的作用,Mehrvar等[25]使用三维光学冷冻成像技术量化13 Gy外照射(PBI)后肾脏线粒体生物能量学功能,结果表明,通过减弱线粒体的氧化,增加氧化还原比,可减轻放射性肾病。Soliman等[26]使用8 Gy γ射线全身照射研究放射性肾病的致病机制,发现γ射线照射后MDA、ROS、超氧化物歧化酶(SOD)水平升高,GSH水平下降。Mercantepe等[27]的实验表明清除ROS的抗氧化剂N-乙酰半胱氨酸增加了6 Gy全身照射大鼠的GSH水平,减轻大鼠肾脏病理损伤,并降低了Caspase-3、MDA的表达,以上均表明降低ROS水平可减轻放射性肾病。他汀类降脂药治疗放射性肾病的机制也主要是减轻脂质过氧化[28],此外,他汀类药物还有抗炎、抗凋亡作用[29]。总之,氧化应激反应在放射性肾病发病机制中的证据明确,在进一步导致DNA损伤、细胞凋亡中至关重要。
3.炎症:炎症是胃肠道放射损伤[30]和放射性肺炎[31-32]等的重要机制。随着电离辐射损伤细胞,触发促炎症细胞因子和趋化因子的分泌,巨噬细胞会分泌TNF-α、IL-6、γ-IFN等炎症因子[33]。细胞因子和趋化因子引起细胞迁移和凋亡,进一步触发细胞因子级联反应,导致更多的细胞死亡,从而引起器官功能下降。然而,在灵长类动物身上进行的研究表明,炎症在放射性肾病的发生中作用轻微。van Kleef等[34]在猕猴慢性放射性肾病模型的肾脏组织病理中发现,肾脏中的白细胞并未明显增加,仅巨噬细胞轻微增加,可见炎症在猕猴放射性肾病中作用并不明确。同样,Parker等[35]在11或12 Gy全身照射后100 d对恒河猴的肾脏进行分析,发现肾脏中炎性细胞的增加与非照射组比较差异无统计学意义。抗炎治疗如糖皮质激素等在放射性肾病中的治疗作用也缺乏明确证据。目前的数据表明,炎症在放射性肾病的致病过程中并没有发挥重要作用,而肾脏为何区别于其他器官的原因尚未可知。
4.RASS系统激活:RASS系统是由一系列肽类激素及相应酶组成的体液调节系统,主要存在于心脏、血管、肾脏等组织中,调节和维持人体血压、水、电解质的平衡。一项临床随机对照实验发现,RASS系统抑制剂卡托普利减轻了患者由14 Gy全身照射引起的放射性肾病,改善了患者生存期[36]。为此,RASS系统抑制剂在放射性肾病中的作用机制及效果引起广大学者的关注。Mehrvar等[25]评估了在13 Gy照射后的动物模型中赖诺普利的作用,结果表明,赖诺普利可通过减弱线粒体的氧化,增加氧化还原比,减轻放射诱导的肾脏损伤。RASS系统抑制剂对放射性肾病的缓解作用明确,但其发挥作用的内在机制值得深究。到目前为止,尚无确凿证据表明放射性肾病中存在RASS系统激活。在一项动物实验中,17 Gy全身照射后3~10周,大鼠血清和肾脏中的肾素和血管紧张素Ⅱ(AT Ⅱ)水平没有增加,没有发现任何证据表明RASS系统在肾脏照射后的前10周内被激活[37]。另一项研究中,10 Gy单剂量照射创伤性脑损伤后大鼠的醛固酮表达并没有升高,而使用醛固酮抑制剂螺内酯治疗也不能减轻放射性肾病[38]。因此,RASS系统减轻放射所致肾损伤的内在机制尚需进一步研究,可能与降低肾小球内压力、减少蛋白尿、调节管球平衡等有关。
5.细胞衰老:细胞衰老是细胞周期阻滞、凋亡途径抑制、高代谢活性和衰老相关分泌表型(SASP)的结合。SASP包括IL-1、IL-6、IL-8、转化生长因子、血管内皮生长因子和TNF-α等[39]。细胞衰老是正常老化过程的一部分,但电离辐射会诱导细胞过早衰老。在脑[40]、心脏[41]、肺[42]等器官中,细胞过早衰老会进一步加重电离辐射诱导的器官损伤。在一项动物实验中,对7~8周龄雄性大鼠的单侧肾脏进行18 Gy单次照射,受照射侧的肾脏出现细胞衰老的特征,主要出现在肾小球内皮细胞和足细胞中,表现为细胞周期素依赖性激酶抑制剂(p53、p21和p16)上调以及DNA增殖标记物(Ki-67)缺失,这表明在电离辐射过程中细胞衰老被激活。
6.血管内皮功能障碍:内皮功能障碍和血流动力学改变是放射性肾病已被证实的特征[43]。内皮细胞参与调节肾小球滤过、修复肾小球基底膜相关成分并释放多种凝血因子、趋化因子。花生四烯酸代谢产物环氧二十碳三烯酸是环氧合酶在内皮细胞产生的。Hye Khan等[44]的实验发现,接受全身照射的大鼠肾脏内皮和血管功能受损,环氧合酶表达下调,导致小动脉功能障碍和肾脏自我调节功能下降,补充环氧二十碳三烯酸能减轻肾入球小动脉压力,改善肾功能和肾小球滤过率。在顺铂诱导的肾损伤中,环氧二十碳三烯酸也表现出相似作用[45],提示环氧二十碳三烯酸可能是未来放射性肾病的治疗靶点。
7.线粒体功能障碍:作为真核生物主要的能量代谢中心,线粒体内膜有复合酶Ⅰ-Ⅳ, 参与能量代谢,产生大量ATP。电离辐射刺激时,呼吸链酶复合物出现功能障碍,其电子外泄至胞浆中,引起大量ROS生成,不仅会引起氧化应激反应,而且使得线粒体内外膜通透性转换孔(mitochondrial inner and outer membrane permeability transition pore,mPTP)开放,线粒体内染色质损伤、线粒体膜电位(mitochondrial membrane potential,MMP)降低,最终出现线粒体功能障碍。上述过程中产生的ROS会进一步加重线粒体损伤,而线粒体损伤又进一步引起ROS瀑布式增长,形成恶性循环,最终导致细胞坏死。Gong等[46]发现,川芎嗪可通过调节管状细胞吞噬和抑制线粒体碎片从而减轻辐射诱导的肾脏损伤,同时改善了肾氧化应激反应和异常线粒体动力学。因此,调节线粒体功能可能是放射性肾病的防治手段。
8.纤维化:纤维化是几乎所有CKD共同的发病机制,包含了肌成纤维细胞的激活和迁移、细胞外基质/胶原蛋白的沉积等途径。在放射性肾病的纤维化过程中,TGF-β发挥了重要作用。TGF-β是一种多功能细胞因子,具有强促纤维化作用。低至0.1 Gy的电离辐射照射后1 h甚至更短时间内即可诱导TGF-β的活化[47-48];此外,辐射损伤内皮细胞,启动细胞反应,也会引起TGF-β活化和释放;电离辐射还会引起缺氧、干扰ROS/RNS的平衡,这些细胞外事件激活细胞膜上的TGF-β信号通路,通过TGF-β/Smad信号通路进一步引起上皮-间质转化、成纤维细胞激增、细胞外基质/胶原蛋白沉积,进而发展为纤维化(图 2)。
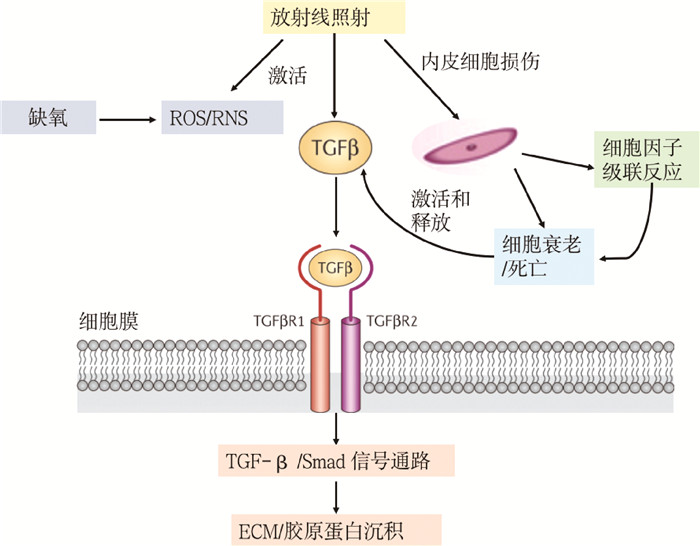
|
图 2 放射性肾病纤维化机制 Figure 2 Fibrosis mechanism of radiation nephropathy |
四、放射性肾病诊断
目前,放射性肾病的诊断缺乏统一标准,主要依据放射线接触史、实验室检查、影像学评价、肾活检等进行诊断。放疗前血清肌酐水平正常, 而在放疗后1~2周血肌酐上升幅度≥132.6 mol/L (1.5 mg/dl)者需考虑急性放射性肾病。再者,部分急性放射性肾病可表现为血尿、蛋白尿,尿指标可能为急性放射性肾病的潜在诊断指标。辐射剂量单次>10 Gy, 或3 d以上累积≥14 Gy, 或4周以上累积剂量≥20 Gy者需警惕慢性放射性肾病的发生。肾活检可见肾小球萎缩、囊腔扩大,肾小管间质瘢痕形成、肾间质小动脉内膜增厚,管腔狭窄等改变[7, 49]。CT/MR提示肾实质厚度减少,皮髓质分界不清[50]。Lubas等[51]研究发现,在高血压性肾病患者中,近端肾皮质灌注减少,近端肾皮质肾动脉面积减少,可用于鉴别诊断高血压性与肾小球肾炎所致的肾脏改变。放射性肾病肾脏损伤程度与受照体积、分割剂量、分割次数、照射时间等多种因素相关,在实际临床工作中需综合考虑。另外,需与药物性肾损害、高血压肾病、糖尿病肾病等疾病进行鉴别,鉴别要点为放射线接触史(表 1)。
|
|
表 1 放射性肾病的鉴别诊断 Table 1 Differential diagnosis of radiation nephropathy |
五、放射性肾病治疗
目前针对放射性肾病的治疗研究数据以动物实验数据为主,且其以对症治疗为主,如减轻蛋白尿、控制高血压、改善贫血等。抗氧化剂、自由基清除剂等在放射性肾病中的应用尚在实验阶段。表 2列举了可能有放射性肾病保护作用的药物。
|
|
表 2 潜在的放射性肾病保护剂 Table 2 Potential radioprotective agents for radiation nephropathy |
六、小结
放射性肾病潜伏期长,且肾脏损伤常被归因于其他更常见的原因,因此,在临床上放射性肾病的发病率常被低估。随着肿瘤患者生存期的延长,放射性肾病逐渐受到重视,但放射性肾病的发病机制尚不清楚,并缺乏诊断金标准和有效的治疗手段,这为需行放射治疗的肿瘤患者尤其是需长期行放疗的患者带来巨大挑战。RASS系统抑制剂可能是一个很有前途的候选药物,但其内在机制尚需进一步研究。在未来,通过纳米粒包裹药物或材料清除ROS、血液净化吸附放射性核素等方法可能是放射性肾病治疗的重点。此外,随着网络药理学和现代中医药的发展,中医药也为放射性肾病的防治提供了更多可能性。
利益冲突 无
作者贡献声明 邓林负责论文起草与修订;王少清负责指导论文修改;冷兴丽、尧鹏负责论文调研和整理;李萃萃负责设计论文框架
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
任红旗, 唐政. 放射性肾病[J]. 医学研究生学报, 2007, 20(8): 873-877. Ren HQ, Tang Z. Radiation nephropathy[J]. J Med Postgra, 2007, 20(8): 873-877. DOI:10.3969/j.issn.1008-8199.2007.08.027 |
| [3] |
Bentzen SM. Preventing or reducing late side effects of radiation therapy: radiobiology meets molecular pathology[J]. Nat Rev Cancer, 2006, 6(9): 702-713. DOI:10.1038/nrc1950 |
| [4] |
Breitz H. Clinical aspects of radiation nephropathy[J]. Cancer Biother Radiopharm, 2004, 19(3): 359-362. DOI:10.1089/1084978041425106 |
| [5] |
朱飞鹏. 肾辐射损伤的骨代谢效应与补肾中药的防治作用及机制研究[D]. 上海: 复旦大学, 2003. Zhu FP. Research on bone metabolism responded to renal radiation injury and effects and mechanism of prevention and treatment of kidney-nourishing herbs[D]. Shanghai: Fudan University, 2003. |
| [6] |
Cohen EP, Robbins ME. Radiation nephropathy[J]. Semin Nephrol, 2003, 23(5): 486-499. DOI:10.1016/s0270-9295(03)00093-7 |
| [7] |
Dawson LA, Kavanagh BD, Paulino AC, et al. Radiation-associated kidney injury[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3 Suppl): S108-115. DOI:10.1016/j.ijrobp.2009.02.089 |
| [8] |
刘婉莹, 肖毅. 溶血性尿毒综合征发病机制和治疗研究进展[J]. 中国实验血液学杂志, 2022, 30(2): 636-640. Liu WY, Xiao Y. Research advances on the pathogenesis and treatment of hemolytic uremic syndrome[J]. J Exp Hematol, 2022, 30(2): 636-640. DOI:10.19746/j.cnki.issn1009-2137.2022.02.053 |
| [9] |
关贵平, 李亚峰, 李荣山. 非典型溶血性尿毒综合征发病机制及治疗研究进展[J]. 中国医药, 2020, 15(5): 792-795. Guan GP, Li YF, Li RS. Advances in pathogenesis and treatment of atypical hemolytic uremic syndrome[J]. China Med, 2020, 15(5): 792-795. |
| [10] |
Klaus R, Niyazi M, Lange-Sperandio B. Radiation-induced kidney toxicity: molecular and cellular pathogenesis[J]. Radiat Oncol, 2021, 16(1): 43. DOI:10.1186/s13014-021-01764-y |
| [11] |
Yahyapour R, Motevaseli E, Rezaeyan A, et al. Reduction-oxidation (redox) system in radiation-induced normal tissue injury: molecular mechanisms and implications in radiation therapeutics[J]. Clin Transl Oncol, 2018, 20(8): 975-988. DOI:10.1007/s12094-017-1828-6 |
| [12] |
Cohen EP, Pais P, Moulder JE. Chronic kidney disease after hematopoietic stem cell transplantation[J]. Semin Nephrol, 2010, 30(6): 627-634. DOI:10.1016/j.semnephrol.2010.09.010 |
| [13] |
Robbins ME, Bonsib SM. Radiation nephropathy: a review[J]. Scanning Microsc, 1995, 9(2): 535-560. |
| [14] |
周琰. 射线照射大鼠肾放射损伤的实验研究[D]. 天津: 天津医科大学, 2013. Zhou Y. Experimental study of radioactive kidney injury in rat kidney after X-ray irradiation[D]. Tianjin : Tianjin Medical University, 2013. |
| [15] |
Klar AS, Zimoch J, Biedermann T. Skin tissue engineering: application of adipose-derived stem cells[J]. Biomed Res Int, 2017, 2017: 9747010. DOI:10.1155/2017/9747010 |
| [16] |
Emami B, Lyman J, Brown A, et al. Tolerance of normal tissue to therapeutic irradiation[J]. Int J Radiat Oncol Biol Phys, 1991, 21(1): 109-122. DOI:10.1016/0360-3016(91)90171-y |
| [17] |
Nevinny-Stickel M, Poljanc K, Forthuber BC, et al. Optimized conformal paraaortic lymph node irradiation is not associated with enhanced renal toxicity[J]. Strahlenther Onkol, 2007, 183(7): 385-391. DOI:10.1007/s00066-007-1657-6 |
| [18] |
Marks LB, Yorke ED, Jackson A, et al. Use of normal tissue complication probability models in the clinic[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3 Suppl): S10-S19. DOI:10.1016/j.ijrobp.2009.07.1754 |
| [19] |
Wang JYJ. Cell death response to DNA damage[J]. Yale J Biol Med, 2019, 92(4): 771-779. |
| [20] |
Cadet J, Douki T, Ravanat JL. Oxidatively generated damage to the guanine moiety of DNA: mechanistic aspects and formation in cells[J]. Acc Chem Res, 2008, 41(8): 1075-1083. DOI:10.1021/ar700245e |
| [21] |
Roos WP, Kaina B. DNA damage-induced cell death by apoptosis[J]. Trends Mol Med, 2006, 12(9): 440-450. DOI:10.1016/j.molmed.2006.07.007 |
| [22] |
Borgmann K, Köcher S, Kriegs M, et al. DNA repair[J]. Recent Results Cancer Res, 2016, 198: 1-24. DOI:10.1007/978-3-662-49651-0_1 |
| [23] |
Humphreys BD. Mechanisms of renal fibrosis[J]. Annu Rev Physiol, 2018, 80: 309-326. DOI:10.1146/annurev-physiol-022516-034227 |
| [24] |
Sieber F, Muir SA, Cohen EP, et al. High-dose selenium for the mitigation of radiation injury: a pilot study in a rat model[J]. Radiat Res, 2009, 171(3): 368-373. DOI:10.1667/0033-7587-171.3.368 |
| [25] |
Mehrvar S, la Cour MF, Medhora M, et al. Optical metabolic imaging for assessment of radiation-induced injury to rat kidney and mitigation by lisinopril[J]. Ann Biomed Eng, 2019, 47(7): 1564-1574. DOI:10.1007/s10439-019-02255-8 |
| [26] |
Soliman AF, Saif-Elnasr M, Abdel Fattah SM. Platelet-rich plasma ameliorates gamma radiation-induced nephrotoxicity via modulating oxidative stress and apoptosis[J]. Life Sci, 2019, 219: 238-247. DOI:10.1016/j.lfs.2019.01.024 |
| [27] |
Mercantepe T, Topcu A, Rakici S, et al. The radioprotective effect of N-acetylcysteine against X-radiation-induced renal injury in rats[J]. Environ Sci Pollut Res Int, 2019, 26(28): 29085-29094. DOI:10.1007/s11356-019-06110-0 |
| [28] |
Talebpour Amiri F, Hamzeh M, Naeimi RA, et al. Radioprotective effect of atorvastatin against ionizing radiation-induced nephrotoxicity in mice[J]. Int J Radiat Biol, 2018, 94(2): 106-113. DOI:10.1080/09553002.2018.1420926 |
| [29] |
Zhou Q, Liao JK. Pleiotropic effects of statins.-Basic research and clinical perspectives-[J]. Circ J, 2010, 74(5): 818-826. DOI:10.1253/circj.cj-10-0110 |
| [30] |
MacVittie TJ, Bennett A, Booth C, et al. The prolonged gastrointestinal syndrome in rhesus macaques: the relationship between gastrointestinal, hematopoietic, and delayed multi-organ sequelae following acute, potentially lethal, partial-body irradiation[J]. Health Phys, 2012, 103(4): 427-453. DOI:10.1097/HP.0b013e318266eb4c |
| [31] |
Groves AM, Johnston CJ, Misra RS, et al. Effects of IL-4 on pulmonary fibrosis and the accumulation and phenotype of macrophage subpopulations following thoracic irradiation[J]. Int J Radiat Biol, 2016, 92(12): 754-765. DOI:10.1080/09553002.2016.1222094 |
| [32] |
Groves AM, Johnston CJ, Williams JP, et al. Role of infiltrating monocytes in the development of radiation-induced pulmonary fibrosis[J]. Radiat Res, 2018, 189(3): 300-311. DOI:10.1667/RR14874.1 |
| [33] |
Wyczanska M, Lange-Sperandio B. DAMPs in unilateral ureteral obstruction[J]. Front Immunol, 2020, 11: 581300. DOI:10.3389/fimmu.2020.581300 |
| [34] |
van Kleef EM, Zurcher C, Oussoren YG, et al. Long-term effects of total-body irradiation on the kidney of Rhesus monkeys[J]. Int J Radiat Biol, 2000, 76(5): 641-648. DOI:10.1080/095530000138303 |
| [35] |
Parker GA, Cohen EP, Li N, et al. Radiation nephropathy in a nonhuman primate model of partial-body irradiation with minimal bone marrow sparing-part 2: histopathology, mediators, and mechanisms[J]. Health Phys, 2019, 116(3): 409-425. DOI:10.1097/HP.0000000000000935 |
| [36] |
Cohen EP, Irving AA, Drobyski WR, et al. Captopril to mitigate chronic renal failure after hematopoietic stem cell transplantation: a randomized controlled trial[J]. Int J Radiat Oncol Biol Phys, 2008, 70(5): 1546-1551. DOI:10.1016/j.ijrobp.2007.08.041 |
| [37] |
Cohen EP, Fish BL, Moulder JE. The renin-angiotensin system in experimental radiation nephropathy[J]. J Lab Clin Med, 2002, 139(4): 251-257. DOI:10.1067/mlc.2002.122279 |
| [38] |
Cohen EP, Fish BL, Moulder JE. Mitigation of radiation injuries via suppression of the renin-angiotensin system: emphasis on radiation nephropathy[J]. Curr Drug Targets, 2010, 11(11): 1423-1429. DOI:10.2174/1389450111009011423 |
| [39] |
Bernardes de Jesus B, Blasco MA. Assessing cell and organ senescence biomarkers[J]. Circ Res, 2012, 111(1): 97-109. DOI:10.1161/CIRCRESAHA.111.247866 |
| [40] |
McRobb LS, McKay MJ, Gamble JR, et al. Ionizing radiation reduces ADAM10 expression in brain microvascular endothelial cells undergoing stress-induced senescence[J]. Aging (Albany NY), 2017, 9(4): 1248-1268. DOI:10.18632/aging.101225 |
| [41] |
Schultz-Hector S, Balz K. Radiation-induced loss of endothelial alkaline phosphatase activity and development of myocardial degeneration. An ultrastructural study[J]. Lab Invest, 1994, 71(2): 252-260. |
| [42] |
Käsmann L, Dietrich A, Staab-Weijnitz CA, et al. Radiation-induced lung toxicity-cellular and molecular mechanisms of pathogenesis, management, and literature review[J]. Radiat Oncol, 2020, 15(1): 214. DOI:10.1186/s13014-020-01654-9 |
| [43] |
Verheij M, Dewit LG, Valdés Olmos RA, et al. Evidence for a renovascular component in hypertensive patients with late radiation nephropathy[J]. Int J Radiat Oncol Biol Phys, 1994, 30(3): 677-683. DOI:10.1016/0360-3016(92)90955-h |
| [44] |
Hye Khan MA, Fish B, Wahl G, et al. Epoxyeicosatrienoic acid analogue mitigates kidney injury in a rat model of radiation nephropathy[J]. Clin Sci (Lond), 2016, 130(8): 587-599. DOI:10.1042/CS20150778 |
| [45] |
Liu Y, Lu X, Nguyen S, et al. Epoxyeicosatrienoic acids prevent cisplatin-induced renal apoptosis through a p38 mitogen-activated protein kinase-regulated mitochondrial pathway[J]. Mol Pharmacol, 2013, 84(6): 925-934. DOI:10.1124/mol.113.088302 |
| [46] |
Gong G, Guan YY, Zhang ZL, et al. Isorhamnetin: A review of pharmacological effects[J]. Biomed Pharmacother, 2020, 128: 110301. DOI:10.1016/j.biopha.2020.110301 |
| [47] |
Ewan KB, Henshall-Powell RL, Ravani SA, et al. Transforming growth factor-beta1 mediates cellular response to DNA damage in situ[J]. Cancer Res, 2002, 62(20): 5627-5631. |
| [48] |
Ehrhart EJ, Segarini P, Tsang ML, et al. Latent transforming growth factor beta1 activation in situ: Quantitative and functional evidence after low-dose gamma-irradiation[J]. FASEB J, 1997, 11(12): 991-1002. DOI:10.1096/fasebj.11.12.9337152 |
| [49] |
Ma N, Kato T, Isogai T, et al. The Potential Effects of Taurine in Mitigation of Radiation Nephropathy[J]. Adv Exp Med Biol, 2019, 1155: 497-505. DOI:10.1007/978-981-13-8023-5_46 |
| [50] |
毛羽. 大鼠放射性肾损伤模型制作及影像学评价[D]. 天津: 天津医科大学, 2013. Mao Y. Setting-up of radiation-induced kidney injury in rat model and evaluation of image manifestations[D]. Tianjin : Tianjin Medical University, 2013. |
| [51] |
Lubas A, Kade G, Ryczek R, et al. Ultrasonic evaluation of renal cortex arterial area enables differentiation between hypertensive and glomerulonephritis-related chronic kidney disease[J]. Int Urol Nephrol, 2017, 49(9): 1627-1635. DOI:10.1007/s11255-017-1634-7 |
| [52] |
Asker ME, Ali SI, Mohamed SH, et al. The efficacy of bone marrow-derived mesenchymal stem cells and/or erythropoietin in ameliorating kidney damage in gamma irradiated rats: Role of non-hematopoietic erythropoietin anti-apoptotic signaling[J]. Life Sci, 2021, 275: 119388. DOI:10.1016/j.lfs.2021.119388 |
| [53] |
Citrin D, Cotrim AP, Hyodo F, et al. Radioprotectors and mitigators of radiation-induced normal tissue injury[J]. Oncologist, 2010, 15(4): 360-371. DOI:10.1634/theoncologist.2009-S104 |
 2023, Vol. 43
2023, Vol. 43


