2. 安徽理工大学机械工程学院,淮南 232001
2. College of Mechanical Engineering, Anhui University of Science and Technology, Huainan 232001, China
磁共振引导放疗(MR image-guided radiotherapy,MRIgRT)是集成了核磁扫描仪和传统电子加速器的新型混合放射治疗系统,具有软组织分辨率高、无辐射和可实时成像等优点[1],其作为一种新型精准治疗手段,已在国内外医院实现了广泛的临床应用[2-5]。目前,临床获批的MRIgRT设备的主磁场强度包括0.35和1.5 T,光子与物质相互作用所致次级带电粒子的运动轨迹在强磁场中因洛伦兹力而发生改变,会增加加速器束流的剂量分布偏差[3],极易造成放疗事故。放疗参考剂量是精准表征加速器束流输出剂量并保证治疗计划有效实施的关键物理量[6]。与常规放疗加速器不同,投入临床的MRIgRT设备的强磁场不能轻易关闭,无法在无磁场条件下进行剂量测量[7]。MRIgRT参考剂量的评估需要考虑测量过程中因磁场导致电离室响应的变化(用kB, M-1表示)以及参考点处的水吸收剂量差异,后者与探测器无关,为了排除探测器本身受磁场影响,可采用蒙特卡罗计算该值。本研究关注前者kB, M-1,利用医用电子直线加速器辐射场中搭建磁场强度可调的一对电磁铁,开展不同磁场强度下6 MV光子束的电离室测量实验,研究电离室读数响应与磁场强度之间的变化规律,为MRIgRT参考剂量的准确测量奠定实验基础。
材料与方法1. 加速器及辐射条件:利用瑞典医科达公司Syngery医用电子直线加速器,机架角度为90°,产生标称高压6 MV的光子辐射场。
2. 磁场装置:实验室定制的一对电磁铁装置,重量1 200 kg,外形尺寸1 000 mm×564 mm×750 mm,磁铁极柱直径200 mm,两个极柱之间最大间隙170 mm,配套恒流电源最大电流120 A,最大功率10.8 kW,最大磁感应强度达2.3 T,50 mm直径球内磁场均匀度为0.25%。磁场性能测试参数:极柱间隙50 mm条件下最大磁场为1.525 T,中心周围4 cm2区域内(沿y和z轴方向)磁场均匀度约为0.07%,加速器机头100 cm处的边缘磁场约为1 mT,7 h内磁场强度变化在0.004%以内。该装置主磁场强度满足临床MRIgRT设备的磁场强度,且局部静态磁场符合剂量测量条件[8]。因加速器治疗床的空间限制,定制承重支架,将电磁铁产生的磁场中心与加速器束流等中心点重合,磁场方向与束流方向垂直,通过远程软件控制磁场大小和方向,高斯计一直置于磁场中心范围内。
3. 模体设计:因强磁场的存在以及磁场内可实验操作空间有限,常规的水箱不适用于本研究,因此,自制符合实验需求的三维水模体,采用5 mm厚的有机玻璃板制作模体,外尺寸为50 mm×200 mm × 200 mm和90 mm × 200 mm × 200 mm(图 1)。实际测量时水模体内填充去离子水,双侧外壁与磁铁极柱表面紧紧贴合。极柱厚度约10 cm,材质为DT4纯铁,摆位时使侧向散射对称。同时,沿束流方向的水箱尺寸为20 cm,电离室置于水等效10 cm深度处,能建立足够的正向和背散射条件。水模体定位支架均采用磁场兼容的铝合金和黄铜材料,保证磁场中实验安全性。

|
注:图中x轴为磁场方向,z轴为加速器束流照射方向,电离室轴向分别为y轴(垂直磁场,图B)或x轴(平行磁场,图C) 图 1 装置和模体 A.医用加速器配置电磁铁; B. 测量水模体及垂直磁场摆位; C. 平行磁场摆位 Figure 1 Device and water phantom A. Linac integrated with eletromegnet; B. Water phantom for measurement and setup for perpendicular magnetic field measurement; C. Setup for parallel magnetic field measurement |
4. 正交磁场剂量响应实验:首先测量方向与磁场方向垂直情况下电离室响应。加速器能量选定6 MV,射野大小为5 cm × 10 cm,出束100 MU。因边缘磁场的存在,加速器出束模式选择连锁Interlock7模式,确保超出加速器常规设定限制时仍能按照用户设定剂量出束。如表 1所示,探测器选取临床常用的敏感体积为0.6 cm3的PTW30013 Farmer型和0.125 cm3的PTW31010 Semiflex型防水电离室,将其置于填充去离子水的自制水箱内。水箱前壁厚5 mm,其表面与辐射源等中心的距离(SSD)为100 cm,电离室敏感体积等中心位于水等效10 cm深度处。磁铁间隙为5 cm,分别在磁场强度为0、±0.2、±0.35,±0.4、±0.6、±0.8、±1.0、±1.1、±1.2、±1.4和±1.5 T,通过远程软件进行磁场控制,高斯计一直位于磁场中心。
|
|
表 1 实验采用的电离室 Table 1 Iionization chambers used in measurements |
5. 平行磁场剂量响应实验:利用小体积的PTW31010 Semiflex防水型电离室进行电离室轴向与磁场方向平行条件的实验。该电离室敏感体积为0.125 cm3,摆位和照射的方式参考方法4。区别之处是该电离室测量时,电磁铁极柱间距调到9 cm来实现平行设置(如图 1所示),并采用宽为90 mm的水箱进行测量,此极柱间距下可达到的最大磁场强度约为1 T,实验条件采用-0.8 ~ 0.8 T的磁场强度。
6. 数据整理与不确定度分析:利用Keithley公司的6517B高阻静电计收集电离室的微电流信号,高压加-400 V,量程选择20 nC,采集时间为80 s,放电5 s,延迟3 s。在LabVIEW平台实现多仪器的联动控制和信号预处理,因电离室读数会归一化到无磁场下读数,所有实验中暂不考虑温度、气压和湿度对信号的修正。每个磁场强度下测量3次并取均值,在3 d内每天重复3次上述实验,每次实验前对电离室进行重新摆位,并在0 T磁场下预照射1 000 MU。利用WebPlotDigitizer软件提取文献报道数据[9-12],用于比较本研究测量结果。同时,对比文献[9, 12]中0.35和1.5 T磁场强度的电离室响应读数磁场因子kB, M,通过式(1)计算:
| $ k_{\mathrm{B}, \mathrm{M}}=\frac{M_{\mathrm{B}=0}}{M_{\mathrm{B}_{\mathrm{k}}}} $ | (1) |
式中,MB=0和MBk分别为无和有磁场下的电离室读数。根据贝塞尔法计算测量结果的合成标准不确定度,该不确定度为A类不确定度。
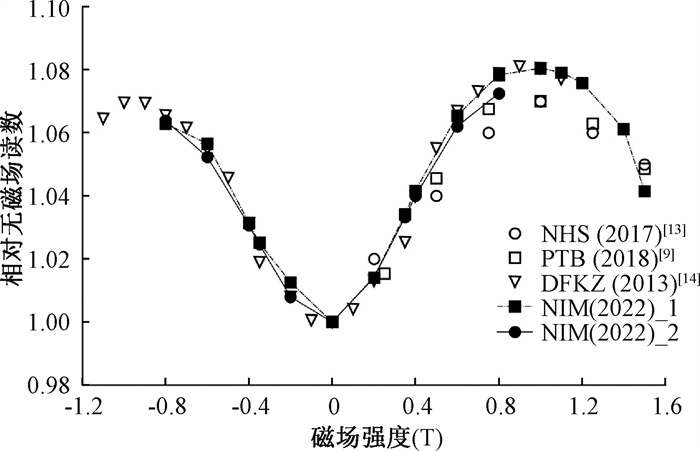
结果1. PTW30013测量结果:利用PTW30013电离室的测量不同磁场强度下读数变化趋势,结果归一化到0 T磁场读数,用kB, M-1表示,结果如图 2所示。磁场方向与电离室轴向垂直分为90°和270°两种情况,分别对应图 2中磁场强度正负值(NIM代表本研究测量值)。当磁场强度在-1.0~1.0 T范围内,电离室响应读数随着磁场强度绝对值的增加而增加到峰值。磁场强度绝对值>1.0 T时,电离室读数随之降低。本研究的测量结果与文献报道结果符合良好,在文献报道值区间内[9, 12-14]。同时可看出,不同序列号PTW30013测量结果一致性较好,仅在磁场强度为0.8 T结果相差0.54%。针对PTW30013电离室,磁场方向为90°的结果略高于270°时的测量值,以SN009165为例,在0.2、0.35、0.4、0.6和0.8 T磁场强度下的差异分别为1.43%、0.83%、0.98%、0.87%和0.15%。
|
注: NHS. 英国国家卫生体系基金会; PTB. 德国联邦物理技术研究院; DFKZ. 德国癌症研究中心; NIM.本研究结果 图 2 垂直磁场方向下不同磁场强度的PTW30013测量kB, M-1与文献报道值 Figure 2 Measurement results kB, M-1 of PTW30013 compared with literature reported values in different magnetic fields at perpendicular direction |
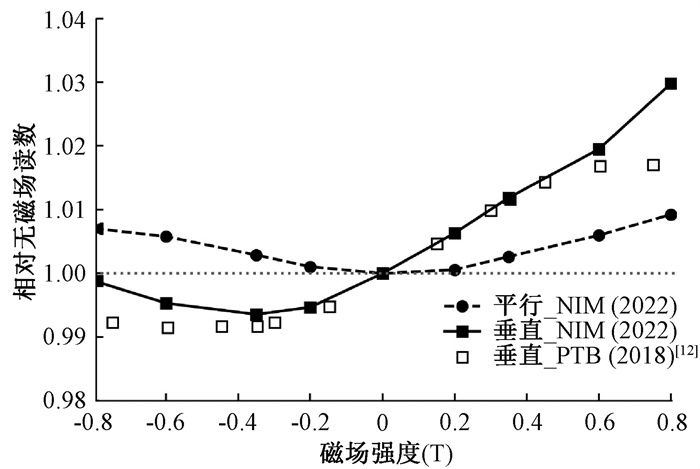
2. PTW31010测量结果:利用小体积电离室PTW31010电离室测量-0.8 T到0.8 T磁场范围内电离室响应,结果归一化到0 T磁场读数,用kB, M-1表示。结果如图 3所示,电离室轴与磁场方向分别为垂直(90°和270°,对应图中磁场强度正负值)和平行(0°和180°,对应图中磁场强度正负值),NIM为本研究测量值。平行方向条件下,电离室响应读数随磁场强度增加而变大,但变化幅度 < 0.01。对于垂直方向,当磁场与电离室轴向夹角为90°时,电离室响应读数与磁场强度仍然呈现正相关趋势,高于无磁场下的读数。但夹角为270°时,电离室响应读数随磁场强度增加先减小后缓慢上升,但一直低于无磁场时的读数。本研究垂直方向所呈现的变化规律与文献[9-11]报道基本一致,但在磁场强度较大时,数据差异较大。
|
注: PTB. 德国联邦物理技术研究院;NIM为本研究结果 图 3 不同磁场强度下PTW31010电离室垂直和平行磁场方向测量的kB, M-1 Figure 3 Measurement results of kB, M-1 at perpendicular and parallel orientations in different magnetic fields of PTW31010 |
3. 磁场因子kB:针对当前主流MRIgRT主磁场强度进行深入分析,表 2总结了本研究所测量结果与文献报告值[9, 12]。除了PTW30013-SN009165之外,所有测量结果与文献值差异在1%以内。对于小体积PTW31010电离室,可以看出磁场与电离室轴平行时的测量结果更接近于1;0.35 T下的测量值与文献值差异仅为0.05%±0.04%。对比两款电离室测量所得的kB, M值,相比于敏感体积更小的PTW31010电离室,PTW30013电离室测得的kB, M值与1之间差异高3~4倍。
|
|
表 2 不同磁场强度下不同磁场方向中磁场测量的电离室响应磁场因子kB, M(k=2) Table 2 Comparison of kB, M(k=2) with literature reported values of different magnetic fields at different directions |
4. 不确定度分析:表 2中测量结果的不确定度为统计学A类标准不确定度(0.02%~0.09%),另外考虑实验测量中非统计学B类不确定度,包括剂量仪稳定性(0.05%)、电离室定位(0.029%)、水箱定位(0.031%)、测量重复性(0.01%)、加速器束流稳定度(0.5%)、磁场稳定度(0.004%)。对于定位误差,由于电磁铁重量过大,评价其定位所致不确定度难度较大,这里仅分析电离室和水箱的定位所致实验不确定度[15]。本实验测量未设置加速器输出剂量监测电离室,因此根据加速器日常运行情况进行了不确定度的估算。综合考虑以上A类和B类不确定度,得出本实验测量结果的扩展不确定度为0.50%~0.51%(k=2)。
讨论本研究在常规医用电子加速器上,利用电磁铁建立了磁共振引导放疗设备的强磁场辐射条件,研究了磁场方向、磁场强度等参量对电离室响应的影响,利用磁场修正因子来量化该强磁场的影响,并系统评估了测量结果的不确定度,初步建立了强磁场下光子束参考剂量的磁场修正测量方法。结果表明,利用目前建立的常规加速器配置电磁铁的强磁场下辐射装置,相比临床MRIgRT设备,该装置的磁场强度和方向灵活可调,覆盖了市场上所有MRIgRT设备的磁场强度,并且具备无磁场的辐射实验条件,可以用来研究无磁场条件的辐射剂量,继而评估强磁场所致的射束参考剂量的磁场修正因子。O′Brien等[16]在TG-51等常规放疗剂量协议基础上,提出对MRIgRT射束参考剂量进行磁场因子的修正。Malkov和Rogers[12]及Pojtinger等[10]利用蒙特卡罗或实验的方式对此进行了研究,美国物理师协会(AAPM)于2022年底发布针对MRIgRT参考剂量协议TG-351报告,目前国内在该方向研究处于空白阶段。本研究所建立的实验装置和测量方法是国内首次对该领域的探索,所获初步结果有助于推进建立MRIgRT射束参考剂量准确测量且规范统一的方法,并与国际研究数据进行比对。
目前针对两款临床放疗质量控制中常用的电离室进行了测量,分析本研究结果可知,测量结果的重复性较好,与文献报道结果符合性较好,所测结果中最大差异约1%。当磁场强度接近1 T时,磁场对电离室响应读数的影响达到峰值,该现象可通过次级电子运动径迹理论来解释[11]。在磁场的作用下,光子束穿过电离室敏感体积所产生的次级电子会因洛伦兹力而偏转运动轨迹,可能形成与圆柱形敏感体积轴向平行的轨迹,使得次级电子有更大概率停留在敏感体积内,而不是穿透敏感体积。电离室敏感体积内能量沉积取决于电子数量和径迹长度,当磁场从0 T增加到1 T时,二者乘积也随之增大,因此所测磁场因子也与磁场呈正比关系。在1 T磁场作用下,电离室敏感体积内沉积剂量最大[17]。当磁场强度更高时,次级电子运动轨迹偏转角度更大,可能会致其再次离开电离室,导致剂量沉积变少。同时可以发现当磁场与电离室轴向平行时,电离室响应受磁场影响更小,这是因为磁场所致电子运动偏转的方向与电离室轴向不平行,不会导致更多的电子在电离室敏感体积内沉积能量。对于垂直方向,测量结果所呈现的不对称曲线趋势与次级电子在外部强磁场作用下的偏转方向有关,次级电子或偏转到电离室杆,或偏转到电离室敏感部尖端。因此,本研究中电离室轴向与磁场夹角90°所测结果大于夹角为270°的结果。另外一个实验现象是敏感体积更小的电离室,其响应受磁场作用的影响更小,亦可通过上述次级电子运动轨迹偏转理论来验证,在此不做赘述。因此,在MRIgRT设备质控过程中,建议尽量使电离室轴向与磁场平行,以降低磁场对电离室响应的影响,同时应当考虑加入磁场因子来修正电离室读数。
电磁铁所产生的主磁场在直径50 mm球内的均匀度以及磁场稳定度能满足实验条件,但在加速器位置处会检测到约1 mT的边缘磁场,导致加速器电子打靶发生一定角度偏转,影响束流的steering数据,因此需要及时调整steering。本研究尚未对电磁铁的边缘磁场进行磁屏蔽,当磁场强度增加到1.5 T时,会影响加速腔真空度,因此大部分实验在-0.8~0.8 T磁场强度区间内进行,以保证加速器正常运行。
本研究只验证了常规医用加速器配置电磁铁来测量MRIgRT参考剂量磁场修正因子的可行性,若要指导MRIgRT临床质量控制工作,仍需要进一步严格辐射场和磁场条件,丰富测量电离室的种类,结合蒙特卡罗建模计算磁场所致加速器束流的剂量分布的改变,系统分析实验测量和蒙特卡罗计算的不确定度,为MRIgRT临床参考剂量质控提供磁场修正因子。
利益冲突 无
作者贡献声明 齐雅平负责方案构思、实验装置搭建与测量、数据分析与论文撰写;王志鹏负责加速器束流实验与数据处理;姚金涛、刘福斌负责实验模体设计与加工;金孙均参与数据处理与不确定度分析;黄骥、杨小元参与数据准备与论文修改;张健、王坤指导研究思路与论文撰写
| [1] |
Lagendijk JJ, Raaymakers BW, Van den Berg CA, et al. MR guidance in radiotherapy[J]. Phys Med Biol, 2014, 59(21): R349-369. DOI:10.1088/0031-9155/59/21/R349 |
| [2] |
刘红冬, 丁寿亮, 阳露, 等. 磁共振引导放疗中射野外电子流效应的初步研究[J]. 中华放射医学与防护杂志, 2021, 41(9): 647-652. Liu HD, Ding SL, Yang L, et al. A premilinary study on the out-of-field in-air electron streaming effect in MRI guided radiotherapy[J]. Chin J Radiol Med Prot, 2021, 41(9): 647-652. DOI:10.3760/cma.j.issn.0254-5098.2021.09.002 |
| [3] |
李明辉, 田源, 张可, 等. 1.5 T磁共振加速器X线束剂量学特性测试[J]. 中华放射肿瘤学杂志, 2020, 29(11): 963-967. Li MH, Tian Y, Zhang K, et al. Dosimetric characteristics test of 1.5 T magnetic resonance accelerator[J]. Chin J Radiat Oncol, 2020, 29(11): 963-967. DOI:10.3760/cma.j.cn113030-20200516-00257 |
| [4] |
Powers M, Baines J, Crane R, et al. Commissioning measurements on an Elekta Unity MR-Linac[J]. Phys Eng Sci Med, 2022, 45(2): 457-473. DOI:10.1007/s13246-022-01113-7 |
| [5] |
Raaymakers BW, Jürgenliemk-Schulz IM, Bol GH, et al. First patients treated with a 1.5 T MRI-Linac: clinical proof of concept of a high-precision, high-field MRI guided radiotherapy treatment[J]. Phys Med Biol, 2017, 62(23): L41-L50. DOI:10.1088/1361-6560/aa9517 |
| [6] |
McEwen M, DeWerd L, Ibbott G, et al. Addendum to the AAPM′s TG-51 protocol for clinical reference dosimetry of high-energy photon beams[J]. Med Phys, 2014, 41(4): 041501. DOI:10.1118/1.4866223 |
| [7] |
Roberts DA, Sandin C, Vesanen PT, et al. Machine QA for the Elekta Unity system: A report from the Elekta MR-linac consortium[J]. Med Phys, 2021, 48(5): e67-e85. DOI:10.1002/mp.14764 |
| [8] |
Billas I, Bouchard H, Oelfke U, et al. Alanine dosimetry in strong magnetic fields: use as a transfer standard in MRI-guided radiotherapy[J]. Phys Med Biol, 2020, 65(11): 115001. DOI:10.1088/1361-6560/ab8148 |
| [9] |
Pojtinger S, Kapsch RP, Dohm OS, et al. A finite element method for the determination of the relative response of ionization chambers in MR-linacs: simulation and experimental validation up to 1.5 T[J]. Phys Med Biol, 2019, 64(13): 135011. DOI:10.1088/1361-6560/ab2837 |
| [10] |
Pojtinger S, Nachbar M, Kapsch RP, et al. Influence of beam quality on reference dosimetry correction factors in magnetic resonance guided radiation therapy[J]. Phys Imaging Radiat Oncol, 2020, 16: 95-98. DOI:10.1016/j.phro.2020.10.005 |
| [11] |
Pojtinger S, Dohm OS, Kapsch RP, et al. Ionization chamber correction factors for MR-linacs[J]. Phys Med Biol, 2018, 63(11): 11NT03. DOI:10.1088/1361-6560/aac4f2 |
| [12] |
Malkov VN, Rogers D. Monte Carlo study of ionization chamber magnetic field correction factors as a function of angle and beam quality[J]. Med Phys, 2018, 45(2): 908-925. DOI:10.1002/mp.12716 |
| [13] |
Agnew J, O′Grady F, Young R, et al. Quantification of static magnetic field effects on radiotherapy ionization chambers[J]. Phys Med Biol, 2017, 62(5): 1731-1743. DOI:10.1088/1361-6560/aa5876 |
| [14] |
Spindeldreier CK, Schrenk O, Bakenecker A, et al. Radiation dosimetry in magnetic fields with Farmer-type ionization chambers: determination of magnetic field correction factors for different magnetic field strengths and field orientations[J]. Phys Med Biol, 2017, 62(16): 6708-6728. DOI:10.1088/1361-6560/aa7ae4 |
| [15] |
金孙均, 王坤, 宋明哲, 等. 医用加速器等中心性能的剂量学实验研究[J]. 核电子学与探测技术, 2015, 35(9): 913-916. Jin SJ, Wang K, Song MZ, et al. Study for the isocenter oroperty of the clinical accelerator via a dosimetric experiment[J]. Nucl Electron Detect Technol, 2015, 35(9): 913-916. DOI:10.3969/j.issn.0258-0934.2015.09.016 |
| [16] |
O′Brien DJ, Roberts DA, Ibbott GS, et al. Reference dosimetry in magnetic fields: formalism and ionization chamber correction factors[J]. Med Phys, 2016, 43(8): 4915-4927. DOI:10.1118/1.4959785 |
| [17] |
Meijsing I, Raaymakers BW, Raaijmakers AJ, et al. Dosimetry for the MRI accelerator: the impact of a magnetic field on the response of a Farmer NE2571 ionization chamber[J]. Phys Med Biol, 2009, 54(10): 2993-3002. DOI:10.1088/0031-9155/54/10/002 |
 2023, Vol. 43
2023, Vol. 43


