2. 中南大学湘雅公共卫生学院社会医学与健康管理系 湖南省临床流行病学重点实验室,长沙 410000
2. Hunan Provincial Key Laboratory of Clinical Epidemiology, Department of Social Medicine and Health Management, Xiangya School of Public Health, Central South University, Changsha 410000, China
随着核能技术的发展,铀矿资源开产力度不断加大,铀暴露人群逐渐扩增,使得铀暴露引起的健康效应受到更多的关注[1]。湖南有着丰富的铀矿资源[2],矿区居民接触铀的风险较高。铀广泛存在于空气、土壤和水等环境介质中[3]。入体2周后,铀主要蓄积在骨骼和肾脏中,肾脏是铀的重要靶器官[4-5]。近年来,普通人群中肾损伤的患病率不断上升,疾病负担逐年加重,已成为一个重要的公共卫生问题[6]。随着肾损伤病情的进展,易诱发终末期肾病和导致过早死亡[7],进一步加重疾病负担。大量实验研究已证实铀是一种重要的肾毒性物质,铀暴露可引起肾功能的改变甚至肾衰竭[8-9],但现有的流行病学研究还未明确二者间的关联。因此在湖南地区开展了此项病例对照研究,旨在探讨血铀浓度与肾损伤之间的关联,为预防肾损伤提供新思路。
资料与方法1. 研究对象:2016年8月至2017年7月,在湖南省4个地区开展了调查研究。其中,北部的两个矿区有铀矿分布,并以雄黄矿及锰矿储量较为丰富[10]; 南部的两个矿区已探明有丰富的铀矿资源[11]。采用连续入组的方式,从4个研究现场中,以社区、村、工厂车间等为基本抽样单位整群随机抽取健康体检居民作为研究对象进行征募。本调查经中南大学湘雅医院伦理审查委员会审批(2018081028),所有的参与者均自愿同意参加该研究。符合纳入条件的参与者为18岁及以上的成人,并且在当地至少有5年的居住史,并排除因高血压、糖尿病等其他原因导致肾损伤的患者。
肾小球滤过率(estimated glomerular filtration rate,eGFR)是估计稳态肾功能最好的指标,来源于血清肌酐(serum creatinine,SCr)的测量[12]。eGFR依据慢性肾脏疾病流行病学合作方程(CKD-EPI公式)计算得出[13]。eGFR的正常范围是80~120 ml · min-1 ·1.73 m-2,当研究对象的eGFR < 60 ml · min-1 ·1.73 m-2时,被判定为肾损伤病例。本研究为病例对照设计研究,以年龄(±2岁)和性别为依据按1 ∶1匹配对照,最终纳入102名肾损伤病例为病例组和102名健康对照为对照组(表 1)。
|
|
表 1 肾损伤病例和对照的基本情况 Table 1 Basic information on kidney injury case group and control group |
2. 金属浓度的测定:采用肝素钠抗凝管采集血样,样品采集完成后,立即上下颠倒8~10次,使抗凝剂与血液充分混合,并在2 h内送达实验室,室温下采用3 000×g离心15 min,离心后置于-80℃冰箱保存。同时,收集每位参与者约30 ml的晨尿样本,分析前冷冻在-20℃冰箱保存。对样品进行预处理后,采用电感耦合等离子质谱仪(Agilent 7700X,美国Agilent科技有限公司)测定生物样品中的金属浓度。在实验室分析过程中,采用重复测定、加标准物质校准和ClinChek®质控品(编号8883和8884)提供的参考范围对血浆样本的检测方法进行质量控制。尿液样本在测量过程中使用内外标法以及加标的混合尿液样本,以评估检测方法的精密度和准确性。
3. 数据的收集:问卷数据由统一培训的调查员,采用在线数据采集平台进行面对面调查获得。内容涉及人口统计学特征、病史和行为生活方式等信息。根据标准方案测量身高、体重和血压,计算体质量指数(BMI,kg/m2)。超重定义为24 kg/m2≤BMI < 28 kg/m2,肥胖定义为BMI≥28 kg/m2。本研究中,高血压定义为血压≥140/90 mmHg,或接受药物治疗; 高血脂定义为总胆固醇浓度>5.72 mmol/L或甘油三酯浓度>1.70 mmol/L,或使用降脂药物; 糖尿病定义为空腹血糖≥7.0 mmol/L或接受药物治疗。SCr、β2微球蛋白(β2-MG)等肾功能指标的结果来自医院健康体检中心。
4. 统计学处理:采用SPSS 26.0软件和R软件(4.2.0版本)进行分析。
(1) 描述统计:依据资料类型,用均数和标准差描述连续型资料(年龄、eGFR、SCr、β2-MG)的分布,以Mann-Whitney U检验进行差异性分析。分类资料(性别、民族、婚姻状况、文化水平、职业类型、吸烟、饮酒、运动状况、BMI、高血压、高血脂和糖尿病)采用百分比进行描述,通过χ2检验进行差异性分析。由于血铀浓度呈偏态分布,故采用百分位数和范围进行描述,以Mann-Whitney U检验进行差异性检验。
(2) 关联性分析:采用条件logistic回归分析血铀浓度与肾损伤间的关联,以比值比(odds ratios,OR)和95%置信区间(confidence interval,CI)表示。根据差异性分析的结果,并参照之前发表的类似研究,对研究对象的文化水平、职业类型、BMI、高血压、高血脂和糖尿病既往病史等潜在的混杂因素进行调整[14-16],并对5种与肾功能关联较为密切的重金属(血Pb、尿Cd、尿Cu、尿Ni和尿Cr)浓度进行校正[17-19]。依据研究对象血铀浓度的第25、50及75百分位的浓度值将其分为4组:Q1 (< 6.01 ng/L)、Q2(6.01~8.94 ng/L)、Q3(8.94~ 14.27 ng/L)和Q4(>14.27 ng/L),构建3个条件logistic回归模型分析血铀与肾损伤之间的关联。分别以4个分组的血铀浓度中位数值替代哑变量进行趋势性检验。
使用限制性立方样条模型,在血铀浓度的第25、50和75百分位设置了3个节点来拟合logistic回归模型,探索血铀与肾损伤间的剂量反应关系。依据eGFR值将肾损伤分为45~59 ml · min-1·1.73 m-2和 < 45 ml·min-1·1.73 m-2两个等级,采用条件logistic回归模型分析血铀与不同肾损伤程度间的关联。并进一步使用线性回归模型和Spearman相关性分析来研究血铀与肾损伤指标(eGFR、SCr及β2-MG)间的相关性。
(3) 其他:依据年龄、性别、吸烟、饮酒状况将研究对象分层,分析不同人群中血铀浓度与肾损伤间的关联。采用MDRD方程计算eGFR值,重新定义肾损伤,进行敏感性分析。所有的统计检验均为双侧,P < 0.05为差异有统计学意义。
结果1. 研究对象基本情况:见表 1,研究对象中病例组的平均年龄为(61.24±14.34)岁,对照组平均年龄为(61.21±14.30)岁。共有134名男性和70名女性纳入此次研究,病例组和对照组在性别上完全匹配。病例组和对照组在文化水平、职业类型、高血压患病史(χ2=6.56、14.53、11.58,P < 0.05)以及肾功能指标eGFR、SCr、β2-MG间(Z= - 12.34、- 11.78、- 6.01,P < 0.05)差异有统计学意义; 在民族、婚姻状况、吸烟、饮酒、运动状况、BMI、高血脂和糖尿病病史间差异无统计学意义(P>0.05)。
2. 血铀浓度分布情况:表 2描述了全体研究对象血铀浓度分布情况,以百分位数和范围来表示。将研究对象按肾损伤情况分组,病例组血铀浓度中位数为10.19 ng/L,明显高于对照组的浓度8.31 ng/L(Z=- 2.54,P < 0.05)。
|
|
表 2 不同组的血铀浓度分布表 Table 2 Distribution of plasma uranium concentration of different groups |
3. 血铀浓度与肾损伤的关联性分析:本研究采用不同血铀浓度、不同肾损伤等级及不同肾损伤指标来评估血铀浓度和肾损伤的关联。条件logistic回归分析(表 3)表明,血铀浓度是肾损伤的危险因素(OR=2.38,95%CI:1.00~5.66)。调整潜在的混杂因素后,Q4组肾损伤的发生风险是Q1组的4.21倍,95%CI:1.23~14.42。趋势性检验表明,所有分层模型中血铀浓度与肾损伤间存在剂量反应关系(P趋势值 < 0.05)。
|
|
表 3 不同血铀浓度与肾损伤的关联性分析 Table 3 Correlation analysis between different plasma uranium concentration and renal injury |
限制性立方样条分析结果(图 1)表明,血铀浓度与肾损伤之间存在剂量反应关系,随着血铀浓度的升高,肾损伤的发生风险也逐渐增大,且二者呈显著的非线性关系(χ2=5.15,P非线性 < 0.05),总效应具有统计学意义(χ2=39.48,P < 0.05)。
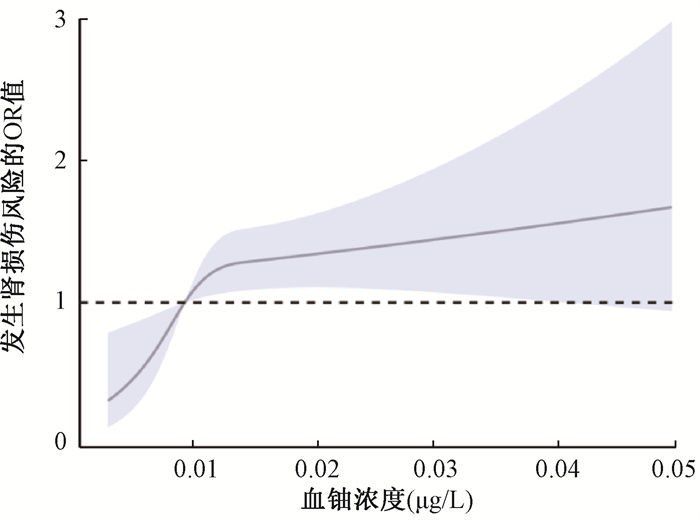
|
注:校正了文化水平、职业类型、吸烟、饮酒、运动状况、BMI指数和高血压、高血脂、糖尿病病史以及血Pb、尿Cd、尿Cu、尿Ni和尿Cr浓度 图 1 血铀浓度与肾损伤关联的限制立方样条图 Figure 1 Restricted cubic spline plot of plasma uranium concentration and renal injury |
调整协变量后,条件logistic回归分析(表 4)表明,对数转换后的血铀可能是肾损伤的独立危险因素(OR =1.98, 95%CI: 1.28~3.09)。依据eGFR值,将肾损伤程度分为两个等级。分析结果显示,血铀浓度与不同程度的肾损伤间存在关联,OR分别为2.08、2.33,当eGFR介于45 ~ 60 ml·min-1 ·1.73 m-2时,关联具有统计学意义(P < 0.05)。
|
|
表 4 血铀浓度与不同肾损伤程度间的关联性分析 Table 4 Correlation analysis between plasma uranium concentration and renal injury level |
表 5分析了血铀浓度与不同肾损伤指标间的关联。线性回归模型中,对数转换后的血铀浓度与SCr、eGFR及β2-MG等肾损伤指标间差异有统计学意义(β=0.17、-0.20、0.15,P < 0.05)。Spearman相关分析表明,SCr、eGFR和β2-MG与血铀浓度关联密切(r=0.21、-0.14、0.20,P′ < 0.05)。
|
|
表 5 血铀浓度与不同肾损伤指标间的关联性分析 Table 5 Correlation analysis between plsama uranium concentration and renal injury indexes |
4. 分层分析:依据年龄、性别、吸烟和饮酒状况进行分层分析(表 6),logistic回归分析结果显示,与60岁以下人群相比,60岁以上人群、不吸烟者及不饮酒者血铀与肾损伤的关联均具有统计学意义(OR=1.58、1.62、1.65, P < 0.05);不同性别血铀与肾损伤差异无统计学意义(P>0.05)。
|
|
表 6 血铀浓度与肾损伤关联的分层分析 Table 6 Stratified analysis of the relationship between plsama uranium concentration and renal injury |
5. 敏感性分析:采用MDRD公式重新估计eGFR值,对新定义的176名研究对象进行敏感性分析,logistic回归分析结果与之前保持一致(表 7)。调整混杂因素后,对数转换的血铀浓度与肾损伤之间存在关联(OR=2.44, P < 0.05)。随着血铀四分位浓度的增高,肾损伤的发生风险逐渐增大。在所有模型中,血铀浓度与肾损伤之间呈剂量反应关系(P趋势值 < 0.05)。
|
|
表 7 血铀浓度与肾损伤关联的敏感性分析 Table 7 Sensitivity analysis of the relationship between plasma uranium concentration and renal injury |
讨论
大量实验研究已证实铀的肾毒性作用,但目前还没有流行病学研究明确揭示血铀与人群肾损伤之间的关联。本研究的参与者为矿区附近的人群,血浆铀中位浓度为8.94 ng/L。利用血浆中的铀浓度作为标志物,分析血铀浓度与肾损伤之间的关联,结果表明血铀浓度与人群肾损伤间存在剂量反应关系。
先前的研究使用血浆、尿液或胎盘组织等样本反映机体的铀暴露情况[20-21]。本研究中,血浆铀浓度被用作衡量金属负荷的评价指标。Akerstrom等[22]发现尿液中的金属浓度波动很大且排泄量受排尿频率的影响,故尿液中的金属含量不能作为良好的生物指标。此外,铀通常与低分子量化合物如柠檬酸盐和碳酸氢盐络合[23],也可与血浆中的蛋白质络合,而使其在血浆中得以保留,故血液中的铀浓度更能反映机体的内暴露水平。
本研究中,病例组血铀浓度中位数为10.19 ng/L,全体研究对象的血铀浓度中位数为8.94 ng/L。该值显著高于德国(< 0.003 μg/L)[24]及法国(0.004 μg/L)[25]的非职业人群,与美国普通居民尿液中的铀浓度相当(0.009 μg/L)[26],这一现象归因于湖南地区特殊的地质环境。湖南素有“有色金属之乡”之美誉,已探明的矿产有铀、铜、铅、锌、锑、汞、铝等。湖南省也是我国铀矿资源较丰富且开发最早的省份,是我国早期重要的铀矿冶基地之一,在湖南的多地均探明有丰富的铀矿资源存储[27-28]。
本研究发现,血铀浓度与肾损伤之间存在正向关联,随着血铀浓度的升高肾损伤的发生风险也随之增大。虽然目前还缺乏流行病学层面的证据支持,但实验研究已证实铀是一种重要的肾毒性物质[29]。铀的肾毒性作用包括引起肾小管变性和肾细胞坏死,进而导致葡萄糖、白蛋白和β2-MG升高[30];而尿β2-MG排泄增加可以反映eGFR下降[31]。此外,SCr和血尿素氮(blood urea nitrogen,BUN)也可以间接影响eGFR,作为肾小球损伤的指标[32]。有学者推断铀的肾毒性机制可能包括氧化应激、线粒体毒性和炎症等。事实上,铀和其他有毒重金属一样,可以通过线粒体途径和炎症反应诱导氧化损伤和细胞凋亡;但具体的代谢途径及通路还有待进一步研究。
在分层分析中,本研究发现,60岁以上人群组血铀与肾损伤的关联比60岁以下人群更显著,这或许可归因于年龄对肾功能的影响。先前的研究表明,北京地区60岁以上老年人慢性肾病的患病率明显高于国内成年人的患病率,并确定年龄增加是慢性肾病发病的主要危险因素之一[33],本研究结果与之相一致。此外,本研究发现,不饮酒者血铀与肾损伤的关联更显著。Kawamoto等[34]发现在社区居民中,酒精消费和血清尿酸与肾损伤有协同相关。此外,有研究表明,目前饮酒者发生肾小球过度滤过的风险是从不饮酒者的1.51倍[35];每周大量饮酒与肾小球过度滤过的风险升高存在剂量依赖关系。以上的研究表明,饮酒会造成肾损伤,若其肾损伤效应明显强于铀,可能就会掩盖铀的肾毒性,进而表现为不饮酒者血铀暴露与肾损伤的关联更为明显。
本研究有以下几点优势:首先,本研究首次发现血铀浓度与肾损伤之间存在剂量反应关系;其次,本研究对所有参与者进行访谈,能够全面了解研究对象的基本情况,调整其他潜在危险因素;最后,湖南地区铀矿储量丰富,人群接触风险相对较高,结论具有公共卫生学意义。但是本研究也存在一定的局限性:第一,测量的铀水平可能在一定程度上反映了过去的接触水平,因为铀可以在人体中持续积累多年[36];第二,当前研究中,由于研究对象的BUN值存在较多缺失,故未将其纳入研究分析;第三,目前仅从人群角度探讨血铀与肾损伤的关系,未来还需要从机制层面来进一步验证。
综上所述,血铀浓度是肾损伤的危险因素,二者间存在剂量反应关系,随着血铀浓度的增加,肾损伤的发生风险也随之升高。这一发现可以为预防人群中肾脏疾病或损害的发生提供新的依据。
利益冲突 无
志谢 衷心感谢所有参与此次调查研究的工作人员
作者贡献声明 周盛祥负责文章构思,分析和解释数据,文章撰写和修改;唐艳负责对文章内容作批评性审阅,指导;唐鹏负责统计分析,对文章内容作批评性审阅;王阳灿负责资料的整理汇总,协助结果解释分析;邓蜀湘负责数据收集,指导数据分析;沈敏学负责指导统计分析,数据收集;杨飞负责获取研究经费,支持性贡献,对文章内容作批评性审阅
| [1] |
Ma M, Wang R, Xu L, et al. Emerging health risks and underlying toxicological mechanisms of uranium contamination: Lessons from the past two decades[J]. Environ Int, 2020, 145: 106107. DOI:10.1016/j.envint.2020.106107 |
| [2] |
刘翔, 陈小东, 邓志强, 等. 湖南省铀矿床类型、成矿系列成矿谱系与找矿新进展[J]. 地质学报, 2020, 94(1): 127-148. Liu X, Chen XD, Deng ZQ, et al. A study of different types of uranium deposits, metallogenic series, metallogenic pedigree and anew prospecting outlook in Hunan province[J]. Acta Geol Sin, 2020, 94(1): 127-148. DOI:10.19762/j.cnki.dizhixuebao.2020113 |
| [3] |
Faa A, Gerosa C, Fanni D, et al. Depleted uranium and human health[J]. Curr Med Chem, 2018, 25(1): 49-64. DOI:10.2174/0929867324666170426102343 |
| [4] |
Ge X, Liu Z, Hou Q, et al. Plasma metals and serum bilirubin levels in workers from manganese-exposed workers healthy cohort (MEWHC)[J]. Environ Pollut, 2020, 258: 113683. DOI:10.1016/j.envpol.2019.113683 |
| [5] |
刘玉龙, 李明华, 孙晓亮, 等. 贫铀的毒性及解毒促排药物研究进展[J]. 解放军药学学报, 2014, 30(5): 454-458. Liu YL, Li MH, Sun XL, et al. Research progress on toxicity of depleted uranium and drugs to detoxify and promote excretion[J]. Pharm J Chin PLA, 2014, 30(5): 454-458. DOI:10.3969/j.issn.1008-9926.2014.05.024 |
| [6] |
Luyckx VA, Cherney DZI, Bello AK. Preventing CKD in developed countries[J]. Kidney Int Rep, 2020, 5(3): 263-277. DOI:10.1016/j.ekir.2019.12.003 |
| [7] |
Saran R, Robinson B, Abbott KC, et al. US renal data system 2018 annual data report: Epidemiology of kidney disease in the United States[J]. Am J Kidney Dis, 2019, 73(3 Suppl 1): A7-A8. DOI:10.1053/j.ajkd.2019.01.001 |
| [8] |
Zhu G, Xiang X, Chen X, et al. Renal dysfunction induced by long-term exposure to depleted uranium in rats[J]. Arch Toxicol, 2009, 83(1): 37-46. DOI:10.1007/s00204-008-0326-6 |
| [9] |
Guéguen Y, Souidi M, Baudelin C, et al. Short-term hepatic effects of depleted uranium on xenobiotic and bile acid metabolizing cytochrome P450 enzymes in the rat[J]. Arch Toxicol, 2006, 80(4): 187-195. DOI:10.1007/s00204-005-0027-3 |
| [10] |
Yang F, Yi X, Guo J, et al. Association of plasma and urine metals levels with kidney function: A population-based cross-sectional study in China[J]. Chemosphere, 2019, 226: 321-328. DOI:10.1016/j.chemosphere.2019.03.171 |
| [11] |
王阳灿, 唐艳, 周盛祥, 等. 血浆铀浓度与肝损伤关联性的病例-对照研究[J]. 环境与职业医学, 2022, 39(10): 1077-1082. Wang YC, Tang Y, Zhou SX, et al. Case-control study of correlation between plasma uranium level and liver injury[J]. J Environ Occup Med, 2022, 39(10): 1077-1082. DOI:10.11836/JEOM22117 |
| [12] |
Gaitonde DY, Cook DL, Rivera IM. Chronic kidney disease: Detection and evaluation[J]. Am Fam Physician, 2017, 96(12): 776-783. |
| [13] |
Levey AS, Inker LA, Coresh J. GFR estimation: from physiology to public health[J]. Am J Kidney Dis, 2014, 63(5): 820-834. DOI:10.1053/j.ajkd.2013.12.006 |
| [14] |
Tang J, McFann KK, Chonchol MB. Association between serum 25-hydroxyvitamin D and nephrolithiasis: the National Health and Nutrition Examination Survey Ⅲ, 1988-94[J]. Nephrol Dial Transplant, 2012, 27(12): 4385-4389. DOI:10.1093/ndt/gfs297 |
| [15] |
Duan JY, Duan GC, Wang CJ, et al. Prevalence and risk factors of chronic kidney disease and diabetic kidney disease in a central Chinese urban population: a cross-sectional survey[J]. BMC Nephrol, 2020, 21(1): 115. DOI:10.1186/s12882-020-01761-5 |
| [16] |
Lu J, Lu Y, Wang X, et al. Prevalence, awareness, treatment, and control of hypertension in China: data from 1.7 million adults in a population-based screening study[J]. Lancet, 2017, 390(10112): 2549-2558. DOI:10.1016/S0140-6736(17)32478-9 |
| [17] |
Tsai HJ, Hung CH, Wang CW, et al. Associations among heavy metals and proteinuria and chronic kidney disease[J]. Diagnostics (Basel), 2021, 11(2): 282. DOI:10.3390/diagnostics11020282 |
| [18] |
Tian X, Shan X, Ma L, et al. Mixed heavy metals exposure affects the renal function mediated by 8-OHG: A cross-sectional study in rural residents of China[J]. Environ Pollut, 2023, 317: 120727. DOI:10.1016/j.envpol.2022.120727 |
| [19] |
Feng S, Deng S, Tang Y, et al. Microcystin-LR combined with cadmium exposures and the risk of chronic kidney disease: A case-control study in central China[J]. Environ Sci Technol, 2022, 56(22): 15818-15827. DOI:10.1021/acs.est.2c02287 |
| [20] |
Ahmed RS, Mohammed RS. Assessment of uranium concentration in blood of Iraqi females diagnosed with breast cancer[J]. Radiat Environ Biophys, 2021, 60(1): 193-201. DOI:10.1007/s00411-020-00881-8 |
| [21] |
Yin S, Tian T, Wang C, et al. Prenatal uranium exposure and risk for fetal neural tube defects: A case-control study in women living in a rural area of northern China[J]. J Hazard Mater, 2022, 424(Pt B): 127466. DOI:10.1016/j.jhazmat.2021.127466 |
| [22] |
Akerstrom M, Barregard L, Lundh T, et al. Variability of urinary cadmium excretion in spot urine samples, first morning voids, and 24 h urine in a healthy non-smoking population: implications for study design[J]. J Expo Sci Environ Epidemiol, 2014, 24(2): 171-179. DOI:10.1038/jes.2013.58 |
| [23] |
Cooper JR, Stradling GN, Smith H, et al. The behaviour of uranium-233 oxide and uranyl-233 nitrate in rats[J]. Int J Radiat Biol Relat Stud Phys Chem Med, 1982, 41(4): 421-433. DOI:10.1080/09553008214550461 |
| [24] |
Heitland P, Köster HD. Biomonitoring of 37 trace elements in blood samples from inhabitants of northern Germany by ICP-MS[J]. J Trace Elem Med Biol, 2006, 20(4): 253-262. DOI:10.1016/j.jtemb.2006.08.001 |
| [25] |
Goullé JP, Mahieu L, Castermant J, et al. Metal and metalloid multi-elementary ICP-MS validation in whole blood, plasma, urine and hair. Reference values[J]. Forensic Sci Int, 2005, 153(1): 39-44. DOI:10.1016/j.forsciint.2005.04.020 |
| [26] |
Okaneku J, Vearrier D, Mckeever R, et al. Urine uranium concentrations and renal function in residents of the United States-2001 to 2010[J]. Clin Toxicol(Phila), 2015, 53(10): 931-934. DOI:10.3109/15563650.2015.1094704 |
| [27] |
刘畅, 田建吉, 何德宝, 等. 湖南水口山铅锌多金属矿田中铀的赋存状态及其共生矿物组合[J]. 地质与勘探, 2022, 58(1): 1-11. Liu C, Tian JJ, He DB, et al. The uranium occurrence and paragenetic association of minerals in the Shuikoushan Pb-Zn polymetallic orefield, Hunan province[J]. Geol Explor, 2022, 58(1): 1-11. DOI:10.12134/j.dzykt.2022.01.001 |
| [28] |
秦丽, 张腾飞. 湖南省攸县鹅公坳地区铀成矿地质条件[J]. 价值工程, 2021, 40(17): 173-174. Qin L, Zhang TF. Geological conditions of uranium mineralization in Egong'ao Area, You County, Hunan province[J]. Value Engineering, 2021, 40(17): 173-174. |
| [29] |
Homma-Takeda S, Kokubo T, Terada Y, et al. Uranium dynamics and developmental sensitivity in rat kidney[J]. J Appl Toxicol, 2013, 33(7): 685-694. DOI:10.1002/jat.2870 |
| [30] |
Malard V, Gaillard JC, Bérenguer F, et al. Urine proteomic profiling of uranium nephrotoxicity[J]. Biochim Biophys Acta, 2009, 1794(6): 882-891. DOI:10.1016/j.bbapap.2009.01.010 |
| [31] |
Satarug S, Vesey DA, Nishijo M, et al. The inverse association of glomerular function and urinary β2-MG excretion and its implications for cadmium health risk assessment[J]. Environ Res, 2019, 173: 40-47. DOI:10.1016/j.envres.2019.03.026 |
| [32] |
Zhu G, Xiang X, Chen X, et al. Renal dysfunction induced by long-term exposure to depleted uranium in rats[J]. Arch Toxicol, 2009, 83(1): 37-46. DOI:10.1007/s00204-008-0326-6 |
| [33] |
中华医学会老年医学分会肾病学组, 国家老年疾病临床医学研究中心. 老年人慢性肾脏病诊治中国专家共识(2018)[J]. 中华老年医学杂志, 2018, 37(7): 725-731. Nephrology Group of Geriatrics Society, Chinese Medical Association, National Clinical Research Center for Geriatric Diseases. Expert consensus report on the diagnosis and treatment of chronic kidney disease in the Chinese elderly[J]. Chin J Geriatr, 2018, 37(7): 725-731. DOI:10.3760/cma.j.issn.0254-9026.2018.07.001 |
| [34] |
Kawamoto R, Kikuchi A, Akase T, et al. Alcohol consumption and serum uric acid are synergistically associated with renal dysfunction among community-dwelling persons[J]. J Clin Lab Anal, 2021, 35(6): e23812. DOI:10.1002/jcla.23812 |
| [35] |
Lin M, Su Q, Huang H, et al. Alcohol consumption and the risk for renal hyperfiltration in the general Chinese population[J]. Eur J Clin Nutr, 2017, 71(4): 500-505. DOI:10.1038/ejcn.2016.168 |
| [36] |
Reeves B, Beccia MR, Solari PL, et al. Uranium uptake in paracentrotus lividus sea urchin, accumulation and speciation[J]. Environ Sci Technol, 2019, 53(14): 7974-7983. DOI:10.1021/acs.est.8b06380 |
 2023, Vol. 43
2023, Vol. 43


