2. 贵州医科大学附属肿瘤医院头颈肿瘤科,贵阳 550003
2. Department of Head and Neck Oncology, Affiliated Cancer Hospital of Guizhou Medical University, Guiyang 550003, China
口咽癌是一种主要累及口咽壁、扁桃体、舌根和软腭的恶性肿瘤,90%以上的口咽癌病理诊断为鳞状细胞癌。长期吸烟和饮酒是口咽癌的重要致病因素,人乳头瘤病毒(human papillomavirus, HPV)感染是口咽癌的另一个重要危险因素,其发病率逐年上升[1]。HPV感染通常通过超过70%的p16蛋白(p16+)表达来进行诊断[2],p16表达被认为是口咽癌的独立预后因素。口咽部解剖结构的特殊性,口咽鳞癌的治疗需要在肿瘤的根治、生存率的提高和功能的保护、生活质量的提高之间取得平衡。局部晚期口咽鳞状细胞癌(locally advanced oropharyngeal squamous cell carcinoma,LA-OPSCC)患者常常选择非手术的放化疗综合治疗模式。同步放化疗是标准的治疗模式,但对于T4或者N2c~N3的患者,可考虑行诱导化疗以缩小肿瘤负荷,同时可能降低远处转移的风险,其常用的诱导化疗方案为多西他赛+顺铂+氟尿嘧啶(TPF)[3]。诱导化疗序贯同步放化疗比单纯放化疗有更高的无进展生存率[4]。放射治疗引起口腔黏膜炎、吞咽疼痛和吞咽困难等急性反应,导致患者进食减少,出现不同程度的营养不良。另外,多项研究已显示恶性肿瘤患者预后与其营养状况及免疫功能密切相关[5-6]。小野寺预后营养指数(prognostic nutritional index,PNI)是根据血清白蛋白和外周血总淋巴细胞计数计算得出的指标,可用于评估患者的营养和免疫状况[7]。OPSCC同步放化疗后使用PNI评估患者长期生存的报道少见。因此,本研究探索了PNI这一指标能否预测接受诱导化疗序贯放化疗LA-OPSCC患者的预后。
资料与方法1.病例资料:回顾性分析了2014年1月至2018年12月在贵州医科大学附属肿瘤医院接受诱导化疗序贯同步放化疗或序贯放疗LA-OPSCC患者的临床资料。纳入标准:①经本院病理学证实的OPSCC初治患者。②依据2009年第7版分期标准国际抗癌联盟(UICC)/美国抗癌联合委员会(AJCC)分期,临床分期为Ⅲ、ⅣA及ⅣB期。③治疗前患者至少能进流食,卡氏(KPS)评分≥70。④不合并其他肿瘤。⑤诱导化疗至少2个周期,放疗达根治剂量。⑥治疗前后血液学检查结果数据完整,有完整病理及临床资料。⑦无严重呼吸系统、循环系统、消化系统、泌尿系统等疾病。排除标准:①有可能影响PNI因素的情况,如并发感染、慢性炎症疾病、近期类固醇激素治疗。②在外院已行抗肿瘤治疗者。所有患者治疗前均行详细临床体格检查,胸腹部CT及头颈部磁共振成像(MRI)增强检查,骨扫描等,结合内镜确定临床分期。该研究由贵州医科大学附属肿瘤医院伦理委员会审核批准。
2. 治疗方案:接受以紫杉醇类联合铂类为主的诱导化疗,包括:TPF方案,多西他赛+洛铂,紫杉醇+顺铂;同步化疗采用3周方案,顺铂80 mg/m2静滴。放疗采用调强放射治疗技术(IMRT)或容积旋转调强技术(VMAT)技术,6 MV X射线,原发灶在诱导化疗后消退或缩小50%的,原发灶瘤床给予处方剂量66 Gy,2 Gy/次,残留的原发灶病灶及淋巴结病灶则给予处方剂量69.96 Gy,2.12 Gy/次;如原发灶诱导化疗后缩小不足50%的,则原发灶区域均给予处方剂量69.96 Gy,2.12 Gy/次。高危区域给予处方剂量60.06 Gy,1.82 Gy/次;低危淋巴引流区处方剂量50.96 Gy,1.82 Gy/次,5次/周。
3. PNI的计算:依据患者血常规及生化检查结果计算PNI,PNI=血清白蛋白值+5×外周血淋巴细胞总数。分别计算患者诱导化疗前、放疗前、放疗后1周内的PNI值。
4.疗效和不良反应评估及随访:原发灶及颈部淋巴结疗效综合评价按照实体瘤治疗疗效评价标准(RECIST 1.1版)进行,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD) 及疾病进展(progressive disease,PD)。治疗有缓解(CR+PR),治疗无缓解(SD+PD)。治疗相关不良反应参照常见不良反应评价标准(CTCAE 4.0)标准进行。观察总生存期(overall survival,OS)和无进展生存期(progression free survival,PFS)。所有患者均进行规律门诊复查及电话随访,放疗后2年内每3个月复查一次,2年后每6个月复查一次。
5. 统计学处理:采用SPSS 19.0软件,以总生存为终点进行受试者工作特征(receiver operating characteristic,ROC) 曲线及曲线下面积(area under curve,AUC) 计算约登指数(敏感性+1-特异性),确定PNI的最佳临界值(约登指数最大点对应PNI值),并将全组患者分为低PNI组及高PNI组。Kaplan-Meier法计算生存率并行Log-rank检验和单因素预后分析,采用Cox模型行多因素预后分析。P < 0. 05为差异有统计学意义。
结果1. 临床资料及疗效: 按照纳入和排除标准,共收集52例患者的临床病理资料,其中接受诱导化疗序贯同步放化疗(50例)及诱导化疗序贯放疗患者2例。原发部位包括腭扁桃体30例、舌根15例、软腭6例。其中,男44例(84.6%),女8例(15.4%);年龄26~75岁(中位数60.5岁),其中60岁以上25例(48.1%)。Ⅲ~ⅣA期32例(61.5%),ⅣB期20例(38.5%)。52例患者中免疫组化p16检测阳性23例(44.2%),见表 1。截止2021年12月30日,随访率98%。全组1、3、5年OS率分别为92.2%、56.8%、48.7%,PFS率分别为81.9%、56.2%、47.7%。
|
|
表 1 52例LA-OPSCC患者放疗后不同水平PNI与与临床特征的关系 Table 1 Relationships between PNI after radiotherapy and clinical features of 52 LA-OPSCC patients |
2. PNI的变化趋势及界值: 患者诱导化疗前、放疗前、放疗后1周内的PNI值分别为51.95±9.83、48.96±6.96、43.99±8.72,放疗后PNI值降低最为明显(t=4.86,P<0.001)。
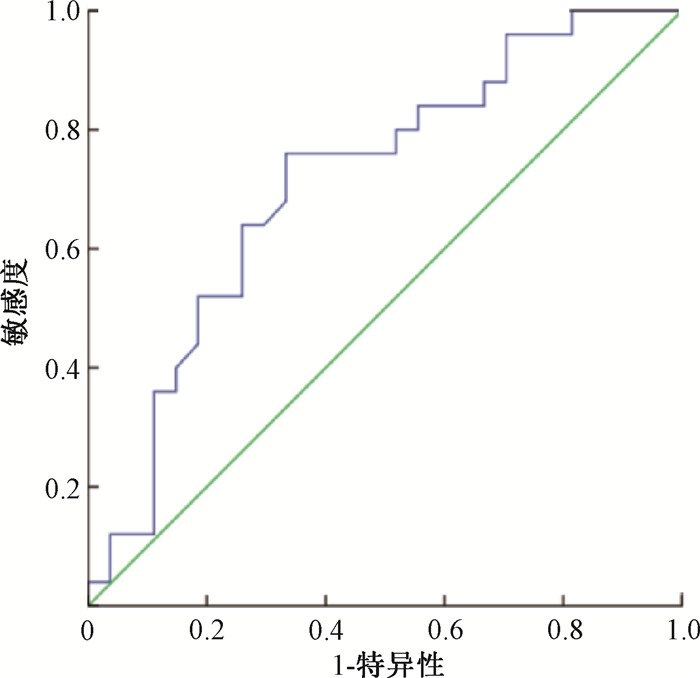
依据ROC曲线分别分析诱导化疗前、放疗前、放疗后1周内的PNI值,最终计算出放疗后PNI最佳临界值为42.4,AUC为0. 714,敏感性为66.7%, 特异性为72.0%,见图 1。将全组患者分为营养良好组(PNI≥42.4) 27例及营养不良组(PNI<42.4)25例。
|
注:PNI. 小野寺预后营养指数; LA-OPSCC.局部晚期口咽鳞状细胞癌 图 1 放疗后PNI预测52例LA-OPSCC预后的受试者工作特征曲线 Figure 1 Receiver operating characteristic curve of PNI after radiotherapy in the prediction of the prognosis of 52 LA-OPSCC patients |
3. 治疗后PNI与临床特征的关系:分析了放疗后营养良好组(PNI≥42.4) 与营养不良组(PNI<42.4)之间的临床特征相关性。表 1显示,年龄>60岁及诱导化疗后疗效评估无缓解的口咽癌患者,在放化疗后出现营养不良的比例更高(χ2=4.89、5.05,P<0.05)。而在性别、是否吸烟、治疗前体质量指数(BMI)、T分期、N分期、临床分期、p16状态、诱导化疗方案及总化疗疗程差异无统计学意义(P>0.05)。
4. 临床参数及放化疗后PNI对患者预后生存的影响:单因素分析显示,年龄、总分期、诱导化疗疗效、p16状态及放化疗后PNI与总生存相关(χ2=4.68、11.98、16.24、11.95、11.12,P<0.05)。PNI≥42.4组和PNI<42.4组的1、3、5年总生存率分别为100%、70.5%、62.6%和83.7%、38.2%、30.1%,见表 2。同样,总分期、总化疗疗程、诱导化疗疗效、p16状态及放化疗后PNI为无进展生存的影响因素(χ2=17.42、6.97、13.71、12.77、5.74,P < 0.05)。PNI≥42.4组和PNI<42.4组的1、3、5年无进展生存率分别为92.6%、65.5%、60.9%和68.9%、37.8%、29.7%,见表 2。多因素分析显示,总分期和p16状态为总生存及无进展生存的独立影响因素,而治疗后PNI为总生存的独立影响因素(HR=2.752,95%CI:1.095~6.917,P=0.031)。
|
|
表 2 Log-rank单因素分析52例LA-OPSCC患者的总生存和无进展生存率 Table 2 Overall survival and progression-free survival of 52 LA-OPSCC patients based on the Log-rank univariate analysis |
5. 急性不良反应:营养良好组(PNI≥42.4)中≥3级粒细胞下降及贫血的发生率明显低于营养不良组(PNI<42.4)(χ2=5.12、5.88,P<0.05);而放疗过程中营养良好组发生≥3级急性口腔黏膜炎及吞咽困难发生率有低于营养不良组的趋势,见表 3。≥3级吞咽困难者仅3例进行了经皮胃造瘘肠内营养支持,营养良好组1例及营养不良组2例,其余患者仅接受间断的肠外营养支持。
|
|
表 3 52例LA-OPSCC患者诱导化疗序贯放化疗后不同营养状况的急性不良反应发生情况 Table 3 Acute adverse reactions of 52 LA-OPSCC patients under different nutritional statuses after induction chemo- therapy followed by sequential chemoradiotherapy |
讨论
营养不良是包括口咽癌在内的头颈部肿瘤患者的一个重要问题,治疗前口咽病变较大时会引起进食梗阻疼痛导致营养物质摄入不足,放疗引起口腔黏膜炎、吞咽困难和口干,作为治疗干预最常见的后果可能会导致患者的营养状况较差。研究表明,营养不良的头颈部肿瘤患者发生治疗相关严重不良事件、治疗中断和生存期缩短的风险更高[8-9]。PNI是日本学者小野寺等[7]建立的评估胃肠道癌症患者围手术期营养、免疫状况及术后并发症的指标。在PNI计算公式中包含血清白蛋白和外周血淋巴细胞数,PNI低,意味着淋巴细胞和/或白蛋白的减少。低血清白蛋白已被用作各种癌症生存不良的独立指标[10]。肿瘤患者放疗期间由于摄入不足导致各种营养素缺乏,最终患者机体出现免疫功能功能失调[11]。外周血淋巴细胞计数被认为是通过激活宿主免疫反应来预防癌症的重要因素,特别是CD4+T和CD8+T细胞可发挥协同免疫效应,通过细胞毒介导作用抑制肿瘤细胞的增殖和迁移,还能分泌细胞因子抑制肿瘤生长。淋巴细胞减少可预示免疫监视受损[12-13]。以上研究表明,淋巴细胞减少和营养不良可能作为慢性免疫系统损害的预测因素。故PNI将二者结合分析判断治疗后患者的疗效和生存是可行的。
治疗期间的PNI变化通常被认为随着营养状况和实验室数据的恶化而下降。Arribas等[14]报道,几乎所有接受化疗或放疗的头颈部肿瘤患者都观察到PNI改变,提示OPSCC患者放化疗期间监测免疫营养状态的重要性。本研究中,患者放疗后PNI值降低最为明显,可能是放疗后放射性口腔黏膜炎及同期化疗导致进食困难加重、胃肠道不良反应及骨髓抑制等原因所导致的。依据ROC曲线分别分析诱导化疗前、放疗前、放疗后1周内的PNI值,最终计算出放疗后PNI最佳临界值为42.4,该临界值与Yoshida等[15]口腔癌放化疗的研究中PNI的临界值42.7相近。Bruixola等[16]进行了一项回顾性队列研究,发现PNI与原发肿瘤位置、HPV状态、酒精成瘾和吸烟显著相关,并作为头颈部肿瘤患者的独立预后标志。目前Meta分析发现头颈部鳞癌治疗前低PNI与较差的预后相关[17]。本研究发现诱导化疗前及放疗前PNI对患者生存无明显影响,这与近期一项研究结果一致[18],认为局部晚期口咽癌根治性放化疗中HPV阳性状态可能比治疗前营养参数对生存有更强的影响。无论口咽癌HPV状态如何,放化疗对其营养状态都造成不利影响,本研究显示放疗后PNI < 42.4组较PNI≥ 42.4组的1、3、5年OS、PFS率都明显降低。多因素分析PNI是LA-OPSCC诱导化疗序贯放化疗后OS的独立预后因素。
本研究比较了治疗后PNI与临床病理特征的关系,发现年龄> 60岁及诱导化疗后疗效评估无缓解的口咽癌患者,在放化疗后出现营养不良的比例更高,这可能与60岁以上患者有较低的血液学、肾脏和肝脏储备,潜在地增加了化疗不良反应,以及有更多的影响癌症药物代谢的合并症[19],同时放化疗治疗相关不良反应的增加,如吞咽困难等[20]。诱导化疗后原发病变无缓解者,接受放疗的剂量相较于病变消退或缩小者要较高,这也可能导致不良反应增加,加重营养不良的发生。本研究中仅有3例进行了经皮胃造瘘肠内营养支持(营养良好组1例及营养不良组2例),营养良好组中≥3级粒细胞下降及贫血的发生率明显低于营养不良组;而放疗过程中营养良好组发生≥3级急性口腔黏膜炎及吞咽困难发生率有低于营养不良组的趋势。提示对于年龄>60岁,或者诱导化疗无效的口咽癌患者,更要关注同步期间化疗药物剂量的调整,以及加强鼻饲管或经皮胃造瘘肠内营养支持治疗,以有助于患者减少营养不良的风险,改善长期生存。
除了治疗后PNI影响患者生存外,本研究中分期和p16状态亦是OS、PFS的独立预后因素。本研究中p16阳性患者为44.2%,发病部位以扁桃体居多,这与复旦肿瘤医院报道的结果相似[21]。总生存率和无进展生存率的分析结果表明,p16阳性比阴性显著提高1、3、5年OS、PFS率,p16是独立预后因素,预测预后的强度超过了传统的预后因素,如T、N分期,与O′Sullivan等[22]研究结果相同。
综上所述,治疗后PNI预测指标能够评估局部晚期口咽癌诱导化疗序贯放化疗后的预后,对于年龄> 60岁,或者诱导化疗无效的这类口咽癌患者,同步放化疗期间给予更多营养关注。本研究基于单中心回顾性分析,纳入研究患者偏少,需要多中心更大样本量前瞻性研究证实。
利益冲突 无
作者贡献声明 李媛媛负责课题设计、分析和论文撰写;王苗负责数据收集和分析;金风指导研究和论文修改;吴伟莉、龙金华和罗秀玲负责收集临床病例;龚修云和陈潇潇协助数据处理
| [1] |
Gooi Z, Chan JY, Fakhry C. The epidemiology of the human papillomavirus related to oropharyngeal head and neck cancer[J]. Laryngoscope, 2016, 126(4): 894-900. DOI:10.1002/lary.25767 |
| [2] |
Fakhry C, Lacchetti C, Rooper LM, et al. Human papillomavirus testing in head and neck carcinomas: ASCO clinical practice guideline endorsement of the College of American Pathologists guideline[J]. J Clin Oncol, 2018, 36(31): 3152-3161. DOI:10.1200/JCO.18.00684 |
| [3] |
Yokota T, Shibata M, Hamauchi S, et al. Feasibility and efficacy of chemoradiotherapy with concurrent split-dose cisplatin after induction chemotherapy with docetaxel/cisplatin/5-fluorouracil for locally advanced head and neck cancer[J]. Mol Clin Oncol, 2020, 13(4): 35. DOI:10.3892/mco.2020.2105 |
| [4] |
Hitt R, Grau JJ, López-Pousa A, et al. A randomized phase Ⅲ trial comparing induction chemotherapy followed by chemoradiotherapy versus chemoradiotherapy alone as treatment of unresectable head and neck cancer[J]. Ann Oncol, 2014, 25(1): 216-225. DOI:10.1093/annonc/mdt461 |
| [5] |
Liu X, Qiu H, Kong P, et al. Gastric cancer nutritional status and outcome[J]. Oncol Targets Ther, 2017, 10: 2107-2114. DOI:10.2147/OTT.S132432 |
| [6] |
De Oliveira Faria S, Howell D, Vamondes Kulcsar MA, et al. Nutritional outcomes in head and neck cancer patients: is intensive nutritional care worth it?[J]. Cancer Treat Res Commun, 2020, 25: 100233. DOI:10.1016/j.ctarc.2020.100233 |
| [7] |
Onodera T, Goseki N, Kosaki G. Prognostic nutritional index in gastrointestinal surgery of malnourished cancer patients[J]. Nihon Geka Gakkai Zasshi, 1984, 85(9): 1001-1005. |
| [8] |
Hsueh SW, Lai CC, Hung CY, et al. A comparison of the MNA-SF, MUST, and NRS-2002 nutritional tools in predicting treatment incompletion of concurrent chemoradiotherapy in patients with head and neck cancer[J]. Support Care Cancer, 2021, 29(9): 5455-5462. DOI:10.1007/s00520-021-06140-w |
| [9] |
Yamahara K, Mizukoshi A, Lee K, et al. Pretherapeutic nutritional/inflammatory factors as predictors for survival of both early and advanced staged head and neck cancer patients[J]. Auris Nasus Larynx, 2021, 48(4): 731-737. DOI:10.1016/j.anl.2020.11.007 |
| [10] |
Li G, Gao J, Liu ZG, et al. Influence of pretreatment ideal body weight percentile and albumin on prognosis of nasopharyngeal carcinoma: Long-term outcomes of 512 patients from a single institution[J]. Head Neck, 2014, 36(5): 660-666. DOI:10.1002/hed.23357 |
| [11] |
Tourkochristou E, Triantos C, Mouzaki A. The influence of nutritional factors on immunological outcomes[J]. Front Immunol, 2021, 12: 665968. DOI:10.3389/fimmu.2021.665968 |
| [12] |
Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203): 436-444. DOI:10.1038/nature07205 |
| [13] |
Singh R, Mishra MK, Aggarwal H. Infammation, immunity, and cancer[J]. Mediators Infamm, 2017, 2017: 6027305. DOI:10.1155/2017/6027305 |
| [14] |
Arribas L, Hurtós L, Taberna M, et al. Nutritional changes in patients with locally advanced head and neck cancer during treatment[J]. Oral Oncol, 2017, 71: 67-74. DOI:10.1016/j.oraloncology.2017.06.003 |
| [15] |
Yoshida R, Gohara S, Sakata J, et al. Onodera′s prognostic nutritional index correlates with tumor immune environment and survival in patients with oral squamous cell carcinoma undergoing chemoradiotherapy[J]. Transl Oncol, 2020, 13(12): 100850. DOI:10.1016/j.tranon.2020.100850 |
| [16] |
Bruixola G, Caballero J, Papaccio F, et al. Prognostic nutritional index as an independent prognostic factor in locoregionally advanced squamous cell head and neck cancer[J]. ESMO Open, 2018, 3(6): e000425. DOI:10.1136/esmoopen-2018-000425 |
| [17] |
Luan CW, Tsai YT, Yang HY, et al. Pretreatment prognostic nutritional index as a prognostic marker in head and neck cancer: a systematic review and meta-analysis[J]. Sci Rep, 2021, 11(1): 17117. DOI:10.1038/s41598-021-96598-9 |
| [18] |
Brewczyński A, Jabłońska B, Mazurek AM, et al. Analysis of selected nutritional parameters in patients with HPV-related and non-HPV-related oropharyngeal cancer before and after radiotherapy alone or combined with chemotherapy[J]. Cancers (Basel), 2022, 14(9): 2335. DOI:10.3390/cancers14092335 |
| [19] |
Balducci L, Lyman GH. Patients aged > or = 70 are at high risk for neutropenic infection and should receive hemopoietic growth factors when treated with moderately toxic chemotherapy[J]. J Clin Oncol, 2001, 19(5): 1583-1585. DOI:10.1200/JCO.2001.19.5.1583 |
| [20] |
Sachdev S, Refaat T, Bacchus ID, et al. Age most significant predictor of requiring enteral feeding in head-and-neck cancer patients[J]. Radiat Oncol, 2015, 10: 93. DOI:10.1186/s13014-015-0408-6 |
| [21] |
Xu T, Shen C, Wei Y, et al. Human papillomavirus (HPV) in Chinese oropharyngeal squamous cell carcinoma (OPSCC): A strong predilection for the tonsil[J]. Cancer Med, 2020, 9(18): 6556-6564. DOI:10.1002/cam4.3339 |
| [22] |
O′Sullivan B, Huang SH, Su J, et al. Development and validation of a staging system for HPV-related oropharyngeal cancer by the International Collaboration on Oropharyngeal cancer Network for Staging (ICON-S): a multicentre cohort study[J]. Lancet Oncol, 2016, 17(4): 440-451. DOI:10.1016/S1470-2045(15)00560-4 |
 2023, Vol. 43
2023, Vol. 43


