2. 重庆市人民医院肿瘤科,重庆 400010
2. Department of Oncology, Chongqing General Hospital, Chongqing 400010, China
放射治疗是胸部肿瘤的重要治疗手段,放射性肺损伤是胸部放疗最常见的并发症。早期不良反应表现为放疗后数小时至数天内发生放射性肺炎,晚期不良反应表现为治疗后数月至数年发生肺纤维化[1-2]。肺纤维化一旦形成,将不可逆转,对患者生活质量产生重大影响。
临床上以糖皮质激素缓解早期放射性肺炎症状,但糖皮质激素长期使用会导致免疫力下降、发生二重感染等诸多问题。中医在放射性肺损伤的防治方面有其独特的优势。在中医学中,麦冬具有滋阴生津、润肺清心的功效,常用于治疗肺燥导致的干咳、阴虚所致的痨嗽、体内热盛消渴等有较好的疗效[3]。已有研究证实,麦冬中药汤剂对辐射所致肺损伤具有防护作用,可降低小鼠肺组织的炎症因子表达,减少氧化产物生成,以及减轻晚期肺纤维化[4-5]。由于麦冬提取的有效成分众多,是何种成分起主要作用目前尚不清楚,限制了麦冬的进一步推广使用。麦冬皂苷D是麦冬的甾体皂苷类提取物之一,具有抗炎、抗氧化、抗肿瘤、抗纤维化等功效[6-9]。本研究在前人研究基础上,进一步探索麦冬皂苷D对放射性肺损伤的防护作用及其可能的作用机制。
材料与方法1.药物、试剂与仪器:麦冬皂苷D购自上海源叶生物技术公司;地塞米松购自上海阿拉丁生化科技公司;小鼠转化生长因子β1(TGF-β1)、白介素6(IL-6)、酶联免疫吸附试验(ELISA)试剂盒购自南京建成生物科技公司;8-OHdG抗体、Collagen Ⅰ抗体、Collagen Ⅲ抗体;PUMA抗体、p53抗体、caspase-3抗体、β-肌动蛋白购自英国Abcam抗体公司;直线加速器(Clinac iX)购自美国Varian公司;凝胶成像分析仪(Chemi DocTM)购自美国Bio-rad公司。
2.实验动物与照射方法:60只C57BL/6小鼠,SPF级,8周龄,体重(20±2)g,由重庆医科大学实验动物中心提供,生产许可证号:SYXK(渝)2018-0003。动物使用协议已经审查委员会批准,实验中动物的处置符合动物伦理学标准。小鼠适应性饲养1周后,采用单纯随机抽样法将小鼠分为4组:健康对照组(Con组)、单纯照射组(IR组)、照射+麦冬皂苷D组(IR+OP-D组)、照射+地塞米松组(IR+Dex组)。照射前3 d开始,Con组、IR组腹腔注射无菌生理盐水,IR+OP-D组腹腔注射10 mg/kg麦冬皂苷D溶液[10],IR+Dex组腹腔注射10 mg/kg地塞米松溶液[11],均每日1次,至照射后1周。
3.小鼠照射:使用4%水合氯醛10 ml/kg腹腔注射麻醉小鼠,用自主设计的模具固定小鼠呈仰卧位,四肢充分伸展,排成一行,使胸部在同一水平,上水平线平锁骨,下水平线平胸骨下缘,6 MV X射线15 Gy单次照射小鼠[12],照射野1.8 cm ×40 cm,剂量率200 cGy/min,源皮距1 m。
4.样本采集和处理:分别于照射后3 d、1周、6周,每组按单纯随机抽样法选取5只小鼠,4%水合氯醛10 ml/kg麻醉,摘取眼球取血,静置2 h,4℃,3 500 r/min,离心半径为8.5 cm,离心20 min,取上层血清用于ELISA检测。颈椎脱臼法处死小鼠,剪开小鼠胸腔,使用预冷生理盐水5 ml进行心脏灌注冲洗肺内血液。分离肺叶,左肺置于10%多聚甲醛中固定用于染色。右肺用冷冻管装好迅速放入液氮中冷冻,储存于-80℃冰箱用于Western blot检测。
5.苏木素-伊红(HE)染色、Masson染色:左肺用多聚甲醛固定24 h后取出,制成蜡块,4 μm切片,HE染色观察病理组织结构改变,Masson染色观察胶原沉积的情况。
6.免疫组织化学染色:切片脱蜡后用pH 6.0的柠檬酸抗原修复缓冲液修复抗原。加一抗溶液(1∶100)在4℃冰箱中孵育过夜,pH 7.4的磷酸盐缓冲液(PBS)冲洗3次,室温下二抗孵育50 min。pH 7.4的PBS洗脱二抗,加二氨基联苯胺(DAB)显色液,HE复染后脱水、透明、封片,用光学显微镜观察。
7.ELISA:检测血清炎症因子TGF-β1、IL-6按照ELISA试剂盒说明书进行操作,每个样品设置3个复孔,根据所得吸光度值,来计算待测品的浓度,结果以pg/mg表示。
8.Western blot:取小鼠右肺上叶组织,加入蛋白裂解液提取总蛋白,用二喹啉甲酸法(BCA法)测定蛋白浓度,根据测得的蛋白浓度加入缓冲液,按照说明书配制15%下层分离胶、4%上层浓缩胶,根据计算出的蛋白浓度换算成加样量,边缘样孔中加入蛋白maker 2 μl,电泳后进行聚偏二氟乙烯(PVDF)转膜,转膜后用PBS清洗,放入配制好的牛奶封闭液中封闭1 h,将PVDF膜取出放入一抗溶液,静置于4℃冰箱孵育过夜,将PVDF膜取出,洗涤后放入二抗溶液中孵育1 h,再次洗涤后滤纸吸干,电化学发光(ECL)法进行显色。
9.统计学处理:使用Graphpad 8.0.1软件进行统计学分析。数据符合正态分布,以x±s表示。两组数据比较采用独立样本t检验,多组间比较经检验符合方差齐性,采用单因素方差分析(ANOVA)。P < 0.05为差异有统计学意义。
结果1. HE染色结果:Con组HE染色肺泡结构完好,无水肿、出血,无明显淋巴细胞浸润。照后3 d可见肺泡结构轻度塌陷,未见明显出血、水肿、炎症浸润表现。照后1周可见肺间质明显增厚,出血水肿明显,小血管及支气管和肺泡周围可见大量淋巴细胞浸润。照后6周,肺泡间质充血水肿较前有所减轻,炎症较前有所吸收,但仍有少量炎症细胞浸润,间质胶原增生,轻度纤维化增厚,肺泡结构完整性受到破坏。和IR组相比,IR+OP-D组在照后3 d肺泡结构保存更加完好,无出血、水肿、炎症浸润表现。在照射后1周肺组织的出血、渗出、水肿、炎症浸润较IR组明显减轻。在照射后6周肺间质增厚程度、肺间质胶原增生程度较IR组明显减轻。病理学观察IR+OP-D组和IR+Dex组无明显差异,见图 1。
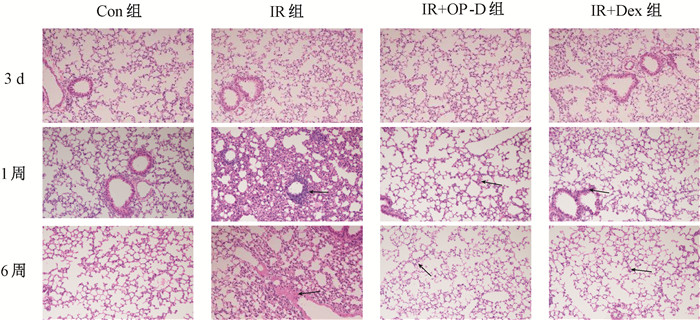
|
注:箭头指示为阳性细胞。Con组. 健康对照组;IR组. 单纯照射组;IR+OP-D组. 照射+麦冬皂苷D组;IR+Dex. 照射+地塞米松组 图 1 照射后3 d、1周、6周各组小鼠肺组织观察 HE染色×200 Figure 1 HE staining of the lung tissues of mice on the 3 d, 1 weeks and 6 weeks after irradiation HE staining ×200 |
2. Masson染色结果:Masson染色与HE染色的病理结果一致。照后3 d,各组肺组织均未见明显胶原沉积。照射后1周,IR组肺间质出现少量的纤维沉积。照射后第6周,IR组和Con组相比,肺组织出现明显的胶原纤维沉积,主要分布在肺间质及血管周围。照射后1和6周,IR+OP-D组和IR+Dex组肺组织的胶原沉积较IR组均有一定程度减轻,两组病理学观察无明显差异(图 2)。
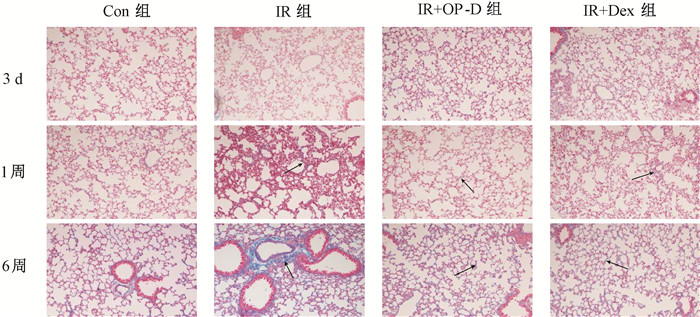
|
注:Con组. 健康对照组;IR组. 单纯照射组;IR+OP-D组. 照射+麦冬皂苷D组;IR+Dex. 照射+地塞米松组 图 2 照射后3 d、1周、6周小鼠肺组织观察 Masson染色×200 Figure 2 Masson staining of the lung tissues of mice at 3 d, 1 week and 6 week after irradiation Masson staining ×200 |
3. Ⅰ型和Ⅲ型胶原纤维免疫组织化学染色:结果见图 3,4。照射后6周,IR组肺组织中Ⅰ型和Ⅲ型胶原纤维染色较Con组增强(t=4.91、7.76,P < 0.05)。IR+OP-D组Ⅰ型和Ⅲ型胶原纤维表达均较IR组减低(t=6.41、7.50,P < 0.05),IR+Dex组Ⅰ型与IR组差异无统计学意义(P>0.05),Ⅲ型胶原纤维较IR组表达减低(t=5.09,P < 0.05)。
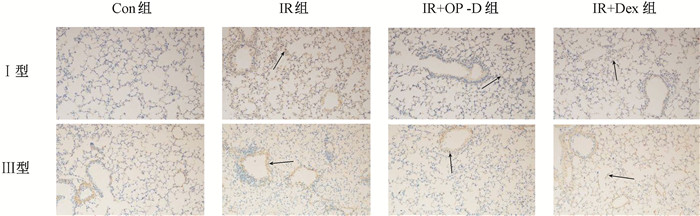
|
注:箭头指示为阳性细胞。Con组. 健康对照组;IR组. 单纯照射组;IR+OP-D组. 照射+麦冬皂苷D组;IR+Dex. 照射+地塞米松组 图 3 小鼠照射后6周Ⅰ型和Ⅲ型胶原纤维蛋白表达观察 免疫组织化学染色×200 Figure 3 The expressions of collagen Ⅰ and collagen Ⅲ in the lung tissues of mice at 6 weeks after irradiation Immunohistochemical staining ×200 |

|
注:1.健康对照组;2.单纯照射组;3.照射+麦冬皂苷D组;4.照射+地塞米松组。a与健康对照组相比,t=4.91、7.76,P < 0.05;b与单纯照射组相比,t=6.41、7.50、5.09,P < 0.05 图 4 小鼠照射后6周Ⅰ型、Ⅲ型胶原纤维蛋白相对表达水平 Figure 4 The relative expression levels of collagen Ⅰ and collagen Ⅲ in the lung tissues of mice at 6 weeks after irradiation |
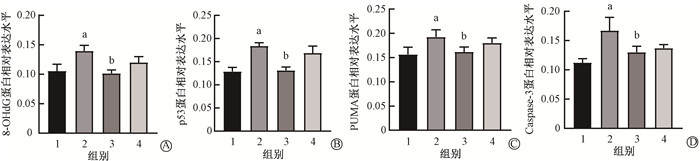
4. 8-OHdG、p53、PUMA、Caspase-3免疫组织化学染色:结果见图 5,6。小鼠在胸部接受电离辐射后1周,IR组8-OHdG、p53、PUMA、Caspase-3表达较Con组增加(t=7.84、11.77、7.21、9.55,P < 0.05),IR+OP-D组的表达较IR组降低(t=8.39、12.60、5.92、7.00,P < 0.05)。IR+Dex组和IR组相比,8-OHdG、p53、PUMA、Caspase-3的表达未降低(P>0.05)。
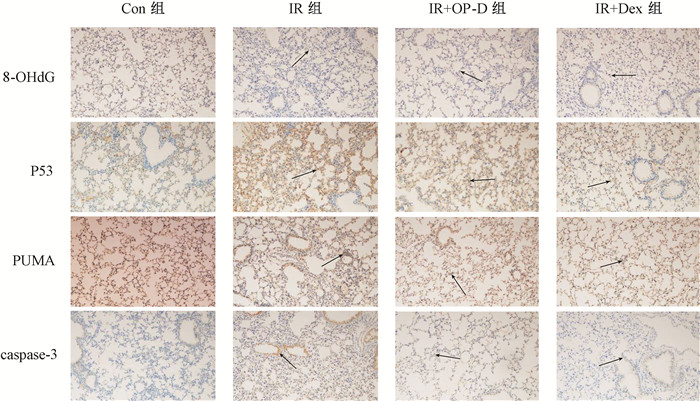
|
注:箭头指示为阳性细胞。Con组. 健康对照组;IR组. 单纯照射组;IR+OP-D组. 照射+麦冬皂苷D组;IR+Dex. 照射+地塞米松组 图 5 照射后1周小鼠肺组织8-OHdG、p53、PUMA、Caspase-3蛋白表达 免疫组织化学染色×200 Figure 5 The expressions of 8-OHdG, p53, PUMA and Caspase-3 in the lung tissues of mice at 1 week after irradiation Immunohistochemical staining ×200 |
|
注:1.健康对照组;2.单纯照射组;3.照射+麦冬皂苷D组;4.照射+地塞米松组。a与健康对照组相比,t=7.84、11.77、7.21、9.55,P < 0.05;b与单纯照射组相比,t=8.39、12.60、5.92、7.00,P < 0.05 图 6 照射后1周小鼠肺组织8-OHdG(A)、p53(B)、PUMA(C)、Caspase-3(D)蛋白相对表达水平 Figure 6 The relative expression levels of 8-OHdG(A), p53(B), PUMA(C) and Caspase-3(D) in the lung tissues of mice at 1 week after irradiation |
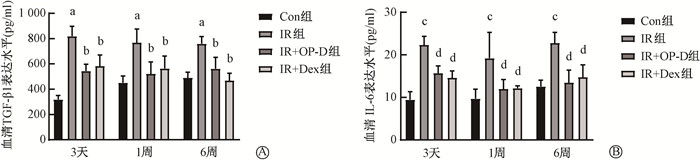
5. 照射后3 d、1周、6周血清TGF-β1和IL-6细胞因子的表达:结果见图 7。IR组在照后3 d即出现了促纤维化因子TGF-β1的显著上调,至照射后6周持续在高水平(t=16.96、7.81、9.28,P < 0.05)。和IR组相比,IR+OP-D组在照射后3 d、1周、6周均显著降低了小鼠血清中TGF-β1的表达(t=9.32、6.08、6.83,P < 0.05)。IR+Dex组与IR组相比,同样显著降低了小鼠血清中TGF-β1的表达(t=8.03、5.06、10.04,P < 0.05)。IR+OP-D组和IR+Dex组相比,两者差异无统计学意义(P>0.05)。IR组IL-6表达在电离辐射后3 d迅速升高(t=15.93、6.19、9.06,P < 0.05),至辐射后6周仍持续在高水平。和IR组相比,IR+OP-D组在照射后3 d、1周、6周对于电离辐射诱导的IL-6升高具有显著的抑制作用(t=8.22、4.70、8.28,P < 0.05)。IR+Dex组与IR组相比,同样显著降低了小鼠血清中IL-6的表达(t=9.54、4.59、7.12,P < 0.05);与IR+PO-D组相比,差异无统计学意义(P>0.05)。
|
注:Con组. 健康对照组;IR组. 单纯照射组;IR+OP-D组. 照射+麦冬皂苷D组;IR+Dex. 照射+地塞米松组。a与Con组相比,t=16.96、7.81、9.28,P < 0.05;b与IR组相比,t=9.32、8.03、6.08、5.06、6.83、10.04,P < 0.05;c与Con组相比,t=15.93、6.19、9.06,P < 0.05;d与IR组相比,t=8.22、9.54、4.70、4.59、8.28、7.12,P < 0.05 图 7 小鼠胸部照射后各组血清TGF-β1(A)和IL-6(B)表达水平 Figure 7 The levels of TGF-β1 (A) and IL-6 (B) in the serum of mice after chest irradiation |
6. 照射后1周各组p53、PUMA、Caspase-3蛋白的表达情况:结果见图 8。肺组织Western blot检测结果和免疫组织化学染色结果基本一致。电离辐射后1周,IR组和Con组相比,p53、PUMA、Caspase-3蛋白的表达均明显上升(t=8.10、11.05、8.28,P < 0.05)。和IR组相比,IR+OP-D组在照射后1周,P53、PUMA、Caspase-3表达上调受到抑制(t=5.96、5.21、5.85,P < 0.05)。IR+Dex组p53、PUMA、Caspase-3的表达未受到明显抑制作用,与IR组相比差异无统计学意义(P>0.05)。

|
注:1.健康对照组;2.单纯照射组;3.照射+麦冬皂苷D组;4.照射+地塞米松组。a与健康对照组相比,t=8.10、11.05、8.28,P < 0.05;b与单纯照射组相比,t=5.96、5.21、5.85,P < 0.05 图 8 照射后1周p53、PUMA、caspase-3蛋白的Western blot检测结果(A)及蛋白相对表达水平(B) Figure 8 Western blot assay (A) and the relative expression level (B) of p53, PUMA and caspase-3 protein in the lung tissues of mice at 1 week after irradiation |
讨论
放射性肺损伤是胸部肿瘤放疗的重要剂量限制因素,可影响肿瘤放疗的疗效和患者的生活质量[13]。放射性肺损伤的治疗以糖皮质激素为主,但其不良反应较大[14]。中医在放射性肺损伤的防治方面有独特优势[15]。本研究探讨麦冬皂苷D对放射性肺损伤的肺组织保护作用,并对可能的作用机制进行探讨。
辐射引起肺组织损伤有两种主要机制,电离辐射直接导致DNA损伤和间接导致活性氧产生[16],从而导致肺组织损伤。辐射导致水分子发生电离产生活性氧(ROS),如超氧化物、过氧化氢、羟基自由基等导致机体氧化应激损伤引起肺泡上皮细胞和血管内皮细胞凋亡[17],上述受损的细胞释放细胞因子吸引炎症细胞浸润,释放IL-6和TGF-β1,从而上调促氧化酶导致ROS的产生增加,并通过线粒体进一步刺激自由基产生[18],这一阶段主要表现为放射性肺炎。随着氧化应激、免疫反应、细胞凋亡等的发生,刺激成纤维细胞产生胶原蛋白形成瘢痕从而导致放射性肺纤维化的发生[19]。
本研究中,小鼠照射后1周,麦冬皂苷D组的肺组织炎性浸润、渗出显著减轻,照射后6周肺组织的纤维化沉积减轻,这和Yao等[4]运用麦冬中药汤剂对放射性肺损伤的肺保护作用结果一致。照射后6周的肺组织Ⅰ型胶原纤维和Ⅲ型胶原纤维免疫组织化学染色表明,麦冬皂苷D降低了Ⅰ型胶原纤维和Ⅲ型胶原纤维在肺组织间的沉积,地塞米松降低了Ⅲ型胶原纤维表达,对于Ⅰ型胶原纤维无明显抑制作用。且值得注意的是,在实验过程中,发现IR+Dex组出现了1例肺脓肿形成,IR+OP-D组未发现此类情况,这可能与地塞米松使用后的免疫抑制及感染相关。这表明麦冬皂苷D在缓解肺纤维化的远期疗效上可能优于地塞米松,且不良反应更小。麦冬皂苷D和地塞米松对于缓解肺纤维化的差异,可能需要进一步延长观察时间来证实。
8-OHdG是一种DNA氧化损伤的产物,8-OHdG的表达水平在一定程度上反映了机体的氧化应激水平和DNA损伤情况[20]。在电离辐射后1周,IR组8-OHdG在肺组织中的表达较健康对照组增多。麦冬皂苷D显著降低了电离辐射导致的8-OHdG的表达,抑制了肺组织的氧化应激反应。p53是DNA损伤反应的关键调节器,它的激活通过不同的靶基因或激活下游蛋白介导不同的功能,包括肿瘤抑制或响应急性不良反应[21]。p53激活促凋亡的Bcl-2家族成员的表达,包括PUMA和Noxa,响应辐射诱导的DNA损伤[22],从而激活Caspase-3导致肺组织细胞凋亡。对照射后1周的肺组织标本进行免疫组织化学分析和Western blot检测发现,两者结果基本一致,辐射上调p53介导的凋亡通路p53/PUMA/Caspase-3的表达,麦冬皂苷D抑制了p53、PUMA、Caspase-3的表达上调,地塞米松组未降低辐射后肺组织8-OHdG、p53、PUMA、Caspase-3的表达。这表明抑制肺组织受照后的氧化应激及凋亡相关蛋白的表达,可能是麦冬皂苷D发挥肺组织保护作用的机制之一。
TGF-β1在纤维化的形成中起着非常重要的作用。Anscher等[23]发现,胸部肿瘤患者在接受胸部放疗后血清TGF-β1水平持续升高。TGF-β1通过诱导成纤维细胞分化和肌成纤维细胞的聚集,使组织器官内胶原纤维沉积从而导致纤维化[24]。IL-6是一种炎症因子,通过检测血清IL-6的表达,可以获知机体炎症反应的水平[25]。从照射后第3天开始,TGF-β1和IL-6便迅速升高,直至照射后1周、6周仍维持在高水平,而麦冬皂苷D降低了TGF-β1和IL-6的表达,这和Yao等[4]用麦冬中药汤剂处理照射小鼠得到的结果一致,地塞米松组在抑制TGF-β1和IL-6的表达上也表现出相似的效果。
综上,本研究结果表明,麦冬皂苷D具有一定的辐射防护作用,其机制可能是减轻辐射引起的氧化应激反应,同时抑制肺组织细胞过度凋亡,减轻进一步的炎症反应,从而达到保护肺组织的作用。麦冬皂苷D与地塞米松对于放射性肺损伤的防护作用相当,但实验过程中观察到,相比于地塞米松,麦冬皂苷D处理后未观察到因药物不良反应死亡,也未观察到严重感染发生。相比麦冬中药汤剂,麦冬皂苷D给药方便,剂量可控,麦冬皂苷D应用于临床还需要更多的研究探索。总而言之,本研究为麦冬皂苷D在临床上的应用提供了实验依据,麦冬皂苷D也有望成为临床上治疗放射性肺损伤的重要手段。
利益冲突 所有研究者均未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 何秀兰负责实验操作、数据处理和论文撰写;罗治彬负责实验设计、论文思路指导及修改
| [1] |
Trott KR, Herrmann T, Kasper M. Target cells in radiation pneumopathy[J]. Int J Radiat Oncol Biol Phys, 2004, 58(2): 463-469. DOI:10.1016/j.ijrobp.2003.09.045 |
| [2] |
Wirsdörfer F, Jendrossek V. The role of lymphocytes in radiotherapy-induced adverse late effects in the lung[J]. Front Immunol, 2016, 7: 591. DOI:10.3389/fimmu.2016.00591 |
| [3] |
郭然, 赵林华, 王青, 等. 麦冬临床应用及其用量[J]. 吉林中医药, 2019, 39(9): 1161-1164. Guo R, Zhao LH, Wang Q, et al. Clinical application and dosage of Ophiopogon japonicus[J]. Jilin J Tradit Chin Med, 2019, 39(9): 1161-1164. DOI:10.13463/j.cnki.jlzyy.2019.09.012 |
| [4] |
Yao QW, Wang XY, Li JC, et al. Ophiopogon japonicus inhibits radiation-induced pulmonary inflammation in mice[J]. Ann Transl Med, 2019, 7(22): 622. DOI:10.21037/atm.2019.11.01 |
| [5] |
富晓彬. 麦冬对C57BL/6小鼠放射性肺纤维化的防治作用研究[D]. 福州: 福建医科大学, 2017. Fu XB. The effects of Maidong in ameliorating radiation-induced pulmonary fibrosis in mice C57BL/6[D]. Fuzhou: Fujian Medical University, 2017. |
| [6] |
Kou J, Sun Y, Lin Y, et al. Anti-inflammatory activities of aqueous extract from Radix ophiopogon japonicus and its two constituents[J]. Biol Pharm Bull, 2005, 28(7): 1234-1238. DOI:10.1248/bpb.28.1234 |
| [7] |
Qian J, Jiang F, Wang B, et al. Ophiopogonin D prevents H2O2-induced injury in primary human umbilical vein endothelial cells[J]. J Ethnopharmacol, 2010, 128(2): 438-445. DOI:10.1016/j.jep.2010.01.031 |
| [8] |
Zhang Y, Han Y, Zhai K, et al. Ophiopogonin-D suppresses MDA-MB-435 cell adhesion and invasion by inhibiting matrix metalloproteinase-9[J]. Mol Med Rep, 2015, 12(1): 1493-1498. DOI:10.3892/mmr.2015.3541 |
| [9] |
Wang Y, Huang X, Ma Z, et al. Ophiopogonin D alleviates cardiac hypertrophy in rat by upregulating CYP2J3 in vitro and suppressing inflammation in vivo[J]. Biochem Biophys Res Commun, 2018, 503(2): 1011-1019. DOI:10.1016/j.bbrc.2018.06.110 |
| [10] |
Zhang YY, Meng C, Zhang XM, et al. Ophiopogonin D attenuates doxorubicin-induced autophagic cell death by relieving mitochondrial damage in vitro and in vivo[J]. J Pharmacol Exp Ther, 2015, 352(1): 166-174. DOI:10.1124/jpet.114.219261 |
| [11] |
Jonasson S, Wigenstam E, Koch B, et al. Early treatment of chlorine-induced airway hyperresponsiveness and inflammation with corticosteroids[J]. Toxicol Appl Pharmacol, 2013, 271(2): 168-174. DOI:10.1016/j.taap.2013.04.037 |
| [12] |
陆忠华, 万美珍, 马燕, 等. 小鼠放射性肺损伤模型的建立与鉴定[J]. 江苏医药, 2013, 39(7): 761-763, 869. Lu ZH, Wan MZ, Ma Y, et al. Establishment and identification of the mice model with radiation-induced lung injury[J]. Jiangsu Med J, 2013, 39(7): 761-763, 869. DOI:10.19460/j.cnki.0253-3685.2013.07.006 |
| [13] |
Hanania AN, Mainwaring W, Ghebre YT, et al. Radiation-induced lung injury: assessment and management[J]. Chest, 2019, 156(1): 150-162. DOI:10.1016/j.chest.2019.03.033 |
| [14] |
Raghu G, Anstrom KJ, King TE Jr, et al. Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis[J]. N Engl J Med, 2012, 366(21): 1968-1977. DOI:10.1056/NEJMoa1113354 |
| [15] |
周罗瑜, 骆学新. 中医药治疗放射性肺损伤研究进展[J]. 中华中医药杂志, 2019, 34(3): 1138-1140. Zhou LY, Luo XX. Research progress on radioactive lung injury with traditional Chinese medicine[J]. China J Tradit Chin Med Pharm, 2019, 34(3): 1138-1140. |
| [16] |
Azzam EI, Jay-Gerin JP, Pain D. Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury[J]. Cancer Lett, 2012, 327(1-2): 48-60. DOI:10.1016/j.canlet.2011.12.012 |
| [17] |
Tak JK, Park JW. The use of ebselen for radioprotection in cultured cells and mice[J]. Free Radic Biol Med, 2009, 46(8): 1177-1185. DOI:10.1016/j.freeradbiomed.2009.01.023 |
| [18] |
Yahyapour R, Shabeeb D, Cheki M, et al. Radiation protection and mitigation by natural antioxidants and flavonoids: implications to radiotherapy and radiation disasters[J]. Curr Mol Pharmacol, 2018, 11(4): 285-304. DOI:10.2174/1874467211666180619125653 |
| [19] |
Johnson S, Shaikh SB, Muneesa F, et al. Radiation induced apoptosis and pulmonary fibrosis: curcumin an effective intervention?[J]. Int J Radiat Biol, 2020, 96(6): 709-717. DOI:10.1080/09553002.2020.1739773 |
| [20] |
Valavanidis A, Vlachogianni T, Fiotakis C. 8-hydroxy-2'-deoxyguanosine (8-OHdG): A critical biomarker of oxidative stress and carcinogenesis[J]. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev, 2009, 27(2): 120-139. DOI:10.1080/10590500902885684 |
| [21] |
Gudkov AV, Komarova EA. Pathologies associated with the p53 response[J]. Cold Spring Harb Perspect Biol, 2010, 2(7): a001180. DOI:10.1101/cshperspect.a001180 |
| [22] |
Lauber K, Ernst A, Orth M, et al. Dying cell clearance and its impact on the outcome of tumor radiotherapy[J]. Front Oncol, 2012, 2: 116. DOI:10.3389/fonc.2012.00116 |
| [23] |
Anscher MS, Kong FM, Andrews K, et al. Plasma transforming growth factor beta1 as a predictor of radiation pneumonitis[J]. Int J Radiat Oncol Biol Phys, 1998, 41(5): 1029-1035. DOI:10.1016/s0360-3016(98)00154-0 |
| [24] |
Kim KK, Sheppard D, Chapman HA. TGF-β1 signaling and tissue fibrosis.[J]. Cold Spring Harb Perspect Biol, 2018, 10(4): a022293. DOI:10.1101/cshperspect.a022293 |
| [25] |
Tanaka T, Narazaki M, Kishimoto T. IL-6 in inflammation, immunity, and disease[J]. Cold Spring Harb Perspect Biol, 2014, 6(10): a016295. DOI:10.1101/cshperspect.a016295 |
 2023, Vol. 43
2023, Vol. 43


