2. 江南大学附属医院肿瘤放疗科, 无锡 214122;
3. 上海中医药大学附属曙光医院放疗科, 上海 201203
2. Department of Radiation Oncology, Affiliated Hospital of Jiangnan University, Wuxi 214122, China;
3. Department of Radiation Oncology, Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
食管癌早期发病隐匿,极易发生局部和远处转移,多数患者就诊时已处于中晚期,失去了手术机会[1]。同步放化疗是非手术食管癌的标准治疗模式,但其5年生存率仅约20%[2]。如何提高食管癌患者的放疗疗效,一直是食管癌治疗中难以攻克的“瓶颈”,目前国际上缺乏公认的食管癌放疗增敏方案。近年来,靶向药物在提高食管癌的放疗疗效方面有一定的应用前景,值得深入探究。
表皮生长因子受体(epidermal growth factor receptor,EGFR)在食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)中存在广泛的过表达,与ESCC的发生、发展及预后密切相关[3-4],而我国食管癌的病理类型90%为鳞状细胞癌[5]。尼妥珠单抗是我国第一个被批准用于恶性肿瘤治疗的以EGFR为靶点的IgG 1型人源化单克隆抗体,目前已应用于鼻咽癌和神经胶质瘤等恶性肿瘤的治疗[6],但其联合同步放化疗治疗食管癌缺乏高级别的临床研究证据,尚处于探索阶段,有待进一步明确该联合治疗方案的疗效及安全性。本研究通过回顾性分析双中心的临床研究数据,评估同步放化疗联合尼妥珠单抗治疗非手术ESCC患者的疗效及安全性。
资料与方法1.临床资料:回顾性收集2014年1月至2020年12月在南京医科大学附属常州第二人民医院放疗科和江南大学附属医院肿瘤放疗科接受根治性放化疗的非手术ESCC患者503例,其中,同步放化疗联合尼妥珠单抗治疗患者69例(联合组),单纯同步放化疗患者434例(同步放化疗组)。纳入标准:① 病理确诊为食管鳞癌。② 不可手术或拒绝手术的初治患者。③ 依据中国食管癌非手术治疗的临床分期标准Ⅰ~Ⅳ期患者[7]。④ 根据实体瘤疗效评价标准(RECIST)1.1,至少有1个可测量病灶。⑤ KPS评分≥70。⑥ 所有患者均接受二维放疗(2D-RT)、三维适形放疗(3D-CRT)或调强适形放疗(IMRT)同期联合化疗。⑦ 无严重的基础疾病。⑧ 预计生存期不低于3个月。排除标准:① 临床资料不完整。② 合并其他恶性肿瘤。③ 治疗前接受过其他抗肿瘤相关的治疗。④ 存在放化疗禁忌证。本研究获得两中心医院伦理委员会批准(批件号:[2014]KY011-01和LS2014007),入组患者均签署了治疗知情同意书。由于两组患者临床资料部分不均衡,为平衡组间混杂因素给结果带来的影响,最大程度控制试验的偏倚,采用倾向性评分匹配法(propensity score matching,PSM)对两组患者进行1 :2匹配[8],协变量包括年龄、性别、病变部位、病变长度、T分期、N分期、M分期、TNM分期以及放疗剂量等。经过PSM后得到168例患者,其中,联合组61例,同步放化疗组107例,匹配后组间各项基本资料的差异无统计学意义(P>0.05)。匹配前后两组基线资料见表 1,2。
|
|
表 1 503例非手术食管鳞癌患者的临床基线资料 Table 1 Clinical baseline data of 503 patients with inoperable esophageal squamous cell carcinoma |
|
|
表 2 倾向性评分匹配后168例非手术食管鳞癌患者的临床基线资料比较 Table 2 Comparison of the clinical baseline data of 168 patients with inoperable esophageal squamous cell carcinoma after propensity score matching |
2.治疗方法:联合组采用同步放化疗联合尼妥珠单抗,同步放化疗组采用单纯同步放化疗。
(1) 放射治疗:所有患者均进行根治性放疗。靶区定义:大体肿瘤区(gross tumor volume,GTV)包括原发病灶和淋巴结转移灶;临床靶区(clinical target volume,CTV)定义为原发灶前后、左右外放0.5 cm、上下外放3~5 cm以及相应的淋巴引流区;计划靶区(planned target volume,PTV)为CTV基础上外放0.5 cm。原发灶和转移淋巴结根治剂量50~70 Gy/25~35次,淋巴结预防剂量45~50 Gy/23~25次,处方剂量包括95%PTV,正常组织不超过其最大耐受剂量,脊髓最大剂量<45 Gy,双肺V20<28%,心脏V40<45%。
(2) 化疗:全组168例患者均完成同步放化疗。其中,紫杉醇+顺铂(TP)方案57例,氟尿嘧啶+顺铂(FP)方案35例,多西他赛+顺铂(DP)方案21例,口服替吉奥单药(S1) 方案55例。168例患者中,联合组与同步放化疗组采用两药联合方案化疗(TP/DP/FP方案)患者分别为43和70例,采用单药化疗的患者分别为18和37例。所有患者同期化疗2个周期,放疗结束后继续原方案巩固化疗2~4个周期。
(3) 靶向治疗:200 mg尼妥珠单抗静脉滴注,自放疗第1天开始用药,1次/周,4~6次。
3.观察指标和评价标准:在放疗结束后第4周,通过胸腹部CT检查结果评价疗效,根据RECIST 1.1[9]可分为:完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)与疾病进展(progressive disease,PD)。其中,CR定义为所有靶病灶消失,且淋巴结短径<1 cm;PR定义为所有靶病灶直径总和较基线至少减少30%;SD定义为靶病灶最大径之和缩小程度未达PR,增加的程度未达PD,介于两者之间;PD定义为所有靶病灶直径总和至少增加20%,且增加的绝对值>0.5 cm或出现新的病灶。客观缓解率(objective response rate,ORR):(CR+PR)/总例数×100%,疾病控制率(disease control rate,DCR):(CR+PR+SD)/总例数×100%,总生存(overall survival,OS)时间定义为患者从接受治疗开始至死亡的时间。无进展生存(progression-free survival,PFS)时间定义为从治疗开始至患者首次出现疾病进展或死亡的时间。根据美国放射肿瘤学协作组(Radiation Therapy Oncology Group,RTOG)急性放射损伤分级标准以及不良事件通用术语标准(common terminology criteria for adverse events,CACTE)4.03版观察并记录患者治疗过程中出现的不良反应情况,分为0~4级。
4.随访:治疗期间每周评价1次不良反应。放疗结束后1个月评估近期疗效。之后2年内每3个月,2~5年内每6个月,5年以上每年进行1次随访。随访项目包括症状、体征、实验室检查以及影像学检查。随访方式包括门诊复查、电话访谈和邮件等。随访时间从初次接受治疗日期开始计算,末次随访时间为2022年6月30日。连续2次失访定义为死亡,死亡时间以第1次失访时间计算。截至末次随访日期共失访9例,随访率94.6%。
5.统计学处理:采用倾向性评分匹配方法分析联合组与同步放化疗组的临床基线资料,根据多因素logistic回归模型计算每位患者的倾向性评分(propensity score,PS),采用最邻近匹配法对两组患者进行1 :2配对,卡钳值取0.03。匹配协变量包括性别、年龄、病变部位、病变长度、T分期、N分期、M分期、TNM分期以及放疗剂量等,以此减少非随机选取患者造成的临床数据偏倚。采用SPSS 25.0统计学软件对数据进行分析,计数资料以频数和百分率(%)表示,采用χ2检验比较组间差异;计量资料符合正态分布,以x±s表示,采用独立样本t检验进行组间比较。采用Kaplan-Meier法计算两组OS率和PFS率,并行Log-rank检验,使用GraphPad Prism 8.0.2绘制生存曲线。P<0.05为差异具有统计学意义。
结果1.近期疗效:放疗结束1个月后,联合组CR 9例,PR 43例,SD 8例,PD 1例,同步放化疗组CR 12例,PR 64例,SD 22例及PD 9例,联合组和同步放化疗组的ORR分别为85.2%和71.0%,两组比较差异具有统计学意义(χ2=4.33,P=0.037);联合组与同步放化疗组的DCR分别为98.4%和91.6%,两组比较差异无统计学意义(P> 0.05),见表 3。
|
|
表 3 倾向性评分匹配后两组非手术食管鳞癌患者的近期疗效对比(例) Table 3 Comparison of short-term efficacy of patients with inoperable esophageal squamous cell carcinoma in two groups after propensity score matching(PSM) |
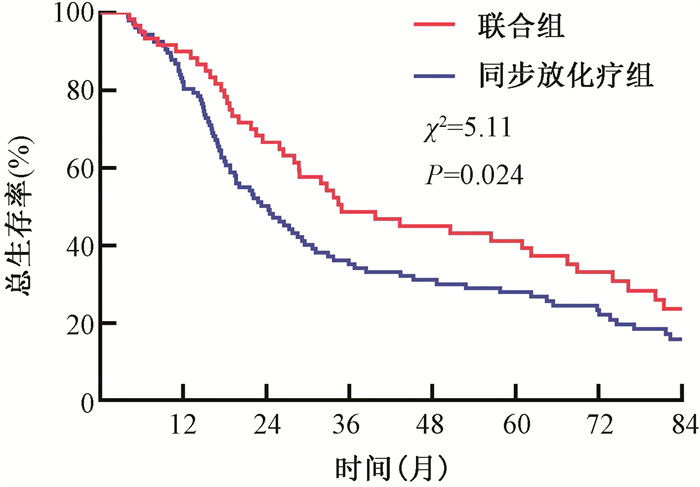
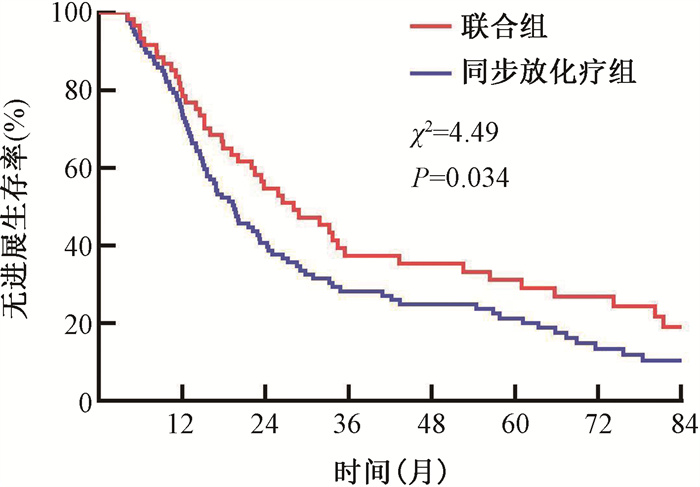
2.生存分析:联合组的中位PFS时间为28.07个月,1、3、5年PFS率分别为78.2%、37.5%和29.1%,同步放化疗组的中位PFS时间为19.54个月,1、3、5年PFS率分别为72.9%、28.3%和21.3%,两组患者PFS比较差异具有统计学意义(χ2=4.49,P=0.034);联合组的中位OS时间为34.93个月,1、3、5年OS率分别为88.5%、46.8%和37.4%,同步放化疗组的中位OS时间为24.3个月,1、3、5年OS率分别为81.3%、35.2%和28.0%,两组OS比较差异亦有统计学意义(χ2=5.11,P=0.024)。见图 1,2。
|
图 1 倾向性评分匹配后两种不同治疗方式下非手术食管鳞癌患者的总生存曲线 Figure 1 Overall survival curves of patients with inoperable esophageal squamous cell carcinoma treated with two different types of therapy after propensity score matching(PSM) |
|
图 2 倾向性评分匹配后两种不同治疗方式下非手术食管鳞癌患者的无进展生存曲线 Figure 2 Progression-free survival curves of patients with inoperable esophageal squamous cell carcinoma treated with two different types of therapy after propensity score matching(PSM) |
3.不良反应:168例患者治疗期间最常见的不良反应表现为放射性食管炎、放射性肺炎、骨髓抑制、恶心呕吐以及皮疹。其中,联合组≥3级骨髓抑制16例(26.2%)、≥3级放射性食管炎9例(14.8%)、≥3级放射性肺炎4例(6.6%)、≥ 3级恶心呕吐2例(3.3%);同步放化疗组≥3级骨髓抑制25例(23.4%)、≥3级放射性食管炎12例(11.2%)、≥3级放射性肺炎5例(4.7%)、≥ 3级恶心呕吐4例(3.7%),两组≥3级不良反应发生率差异均无统计学意义(P>0.05),两组患者1~2级皮疹的发生率差异亦无统计学意义(4.9% vs.1.9%,P=0.263),全组患者未出现治疗中断的情况,患者上述不良反应经对症治疗后得到缓解,见表 4。
|
|
表 4 倾向性评分匹配后两组患者急性不良反应比较(例) Table 4 Comparison of the acute adverse reactions of patients with inoperable esophageal squamous cell carcinoma in two groups after propensity score matching(PSM) |
讨论
研究表明,EGFR在ESCC中存在广泛的过表达,并与肿瘤浸润深度、淋巴结转移情况显著相关,EGFR过表达可能参与ESCC的发生与发展过程,且与较差的预后有关[10],可见,EGFR有望成为ESCC治疗很有前景的潜在靶点之一。尼妥珠单抗是以EGFR为靶点的新型人源化单克隆抗体,可特异性识别EGFR并结合于其胞外结合域,阻断EGFR与其特异性配体结合,从而切断下游信号通路传导[11]。有研究显示,其可通过抗体介导的细胞毒效应来抑制肿瘤细胞生长、增殖,从而增强ESCC细胞对放射的敏感性[12-13]。
在以上基础研究的前提下,孔月等[14]进行了一项Ⅰ期临床研究,评估了同步放化疗联合尼妥珠单抗治疗52例不可手术的局部晚期ESCC患者的近期疗效,获得了53.8%的ORR,显示出了较好的疗效。在另一项Ⅱ期临床研究中,傅国林[15]将80例不可手术的局部晚期ESCC患者随机分为观察组和对照组,对照组接受同步放化疗治疗,观察组在同步放化疗的基础上联合尼妥珠单抗,结果显示观察组的ORR高于对照组(80.0% vs.57.5%,P=0.030),这与本研究的结果相仿。Ramos-Suzarte等[16]进行了一项多中心的随机对照研究,将68例不可手术的局部晚期ESCC患者随机分为尼妥珠单抗联合同步放化疗组和单纯同步放化疗组,结果显示联合组的ORR(47.8% vs.15.4%)和DCR(60.9% vs.26.9%)均高于对照组(P<0.05)。与Ramos-Suzarte等[16]的结果相比,本研究入组的样本量更大,且获得了更高的ORR;不同的是本研究结果中两组患者DCR没有显著性差异,这提示联合治疗方案在短期内降低肿瘤负荷方面更有优势。以上结果均显示出尼妥珠单抗联合同步放化疗可显著提高非手术ESCC患者的近期疗效。
对于近期疗效的提高可否转化为远期生存的延长,曾程等[17]回顾分析了2015年至2020年的30例不可切除的局部晚期食管癌患者,均接受了尼妥珠单抗联合同步放化疗治疗,生存分析显示1、2、3年OS率分别为83%、57%、41%,PFS率分别为75%、47%、32%,这与本研究的1年、3年OS率和1年PFS率相似,不同的是,本研究设立了同步放化疗组,联合组与同步放化疗组相比,5年生存率较高且差异具有统计学意义,与另一项Ⅱ期回顾性研究的结果相当[18]。本研究结果与现代精准放疗技术背景下,ESCC患者的5年生存率相比略低,原因可能是本研究时间跨度较大,对于早年入组的患者,很大一部分采用了二维放疗和三维适形放疗技术,同时患者高龄、身体状况差等原因对入组患者的总体疗效评估具有一定影响。
评估临床治疗方案的可行性,除了疗效的分析,也需要关注治疗实施过程的安全性。本研究在安全性方面的结果与近年来国内外几项同步放化疗联合尼妥珠单抗治疗非手术食管癌的研究结论相当[19-20],同步放化疗联合尼妥珠单抗治疗非手术ESCC患者不会增加患者的不良反应,且发生4级的不良反应率较低。有研究显示,接受尼妥珠单抗治疗的患者相较其他抗EGFR单抗如西妥昔单抗的临床症状更轻,这可能与尼妥珠单抗高度人源化的特性相关[21]。期待未来有更多的临床试验,对同步放化疗基础上联合尼妥珠单抗与其他类型的靶向药物治疗非手术ESCC患者的疗效进行分析,探讨尼妥珠单抗能否较其他靶向药物具有更轻的不良反应。
综上所述,对于非手术的ESCC患者,在同步放化疗的基础上联合尼妥珠单抗能够提高患者的近期疗效,延长患者的生存时间,尼妥珠单抗与放化疗联合具有一定的协同效应,整体安全可耐受,具有一定的临床应用价值。本研究的不足之处在于研究设计是回顾性研究,虽然使用倾向性评分匹配方法来平衡组间基线资料的差异性,但回顾性研究对数据的质量要求较高,且仅能平衡已知混杂因素,具有一定的局限性。此外,治疗前未能对全组患者的食管癌肿瘤组织进行EGFR的测定,EGFR的表达对预后的影响有待进一步研究。期待开展更高级别的多中心前瞻性随机对照研究,进一步证实该治疗方案的有效性及安全性。
利益冲突 无
作者贡献声明 戴李宸负责数据整理、统计分析和论文撰写;黄建锋、于静萍负责指导研究设计和论文修改;胡莉钧、孟庆红负责指导影像学读片;吴佳、汪建林、孙菲、段秋华负责收集病例资料和随访
| [1] |
康静静, 惠周光. 食管癌术后放疗研究现状[J]. 临床外科杂志, 2016, 24(7): 562-565. Kang JJ, Hui ZG. Current status of research on postoperative radiotherapy for esophageal cancer[J]. J Clin Surg, 2016, 24(7): 562-565. DOI:10.3969/j.issn.1005-6483.2016.07.026 |
| [2] |
Yang JJ, Liu XG, Cao S, et al. Understanding esophageal cancer: the challenges and opportunities for the next decade[J]. Front Oncol, 2020, 10: 1727. DOI:10.3389/fonc.2020.01727 |
| [3] |
孙文泽, 苏进, 施璠, 等. EGFR与VEGF在食管鳞癌组织中的表达及其与疗效的关系[J]. 现代肿瘤医学, 2019, 27(6): 981-985. Sun WZ, Su J, Shi F, et al. Relationship of expressions of EGFR and VEGF in esophageal squamous cell carcinoma with therapy efficacy[J]. Modern Oncol, 2019, 27(6): 981-985. DOI:10.3969/j.issn.1672-4992.2019.06.018 |
| [4] |
Hatogai K, Fujii S, Kojima T, et al. Large-scale comprehensive immunohistochemical biomarker analyses in esophageal squamous cell carcinoma[J]. J Cancer Res Clin Oncol, 2017, 143(11): 2351-2361. DOI:10.1007/s00432-017-2482-7 |
| [5] |
Abnet CC, Arnold M, Wei WQ. Epidemiology of esophageal squamous cell carcinoma[J]. Gastroenterology, 2018, 154(2): 360-373. DOI:10.1053/j.gastro.2017.08.023 |
| [6] |
苏进, 许新华. 表皮生长因子受体在肿瘤中的研究进展[J]. 实用医学杂志, 2010, 26(2): 172-174. Su J, Xu XH. Research progress on epidermal growth factor receptor in tumors[J]. J Pract Med, 2010, 26(2): 172-174. DOI:10.3969/j.issn.1006-5725.2010.02.003 |
| [7] |
中国非手术治疗食管癌临床分期专家小组. 非手术治疗食管癌的临床分期标准(草案)[J]. 中华放射肿瘤学杂志, 2010, 19(3): 179-180. Chinese Expert Group on Clinical Staging of Non-surgical Treatment of Esophageal Cancer. Clinical staging criteria for nonsurgical treatment of esophageal cancer (draft)[J]. Chin J Radiat Oncol, 2010, 19(3): 179-180. DOI:10.3760/cma.j.issn.10044221.2010.03.001 |
| [8] |
常红, 陈淑良, 张策, 等. 倾向评分匹配法在医学科研工作中的应用及SPSS实操[J]. 中华医学科研管理杂志, 2017, 30(4): 268-272. Chang H, Chen SL, Zhang C, et al. Application of propensity score matching method in the medical scientific research and operation of SPSS[J]. Chin J Med Sci Res Manage, 2017, 30(4): 268-272. DOI:10.3760/cma.j.issn.1006-1924.2017.04.008 |
| [9] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [10] |
任伟, 刘宝瑞. 食管癌表皮生长因子受体信号通路相关靶向治疗的临床研究进展[J]. 癌症进展, 2019, 17(14): 1621-1626, 1651. Ren W, Liu BR. Advances in clinical research on targeted therapies related to the epidermal growth factor receptor signaling pathway in esophageal cancer[J]. Oncol Prog, 2019, 17(14): 1621-1626, 1651. DOI:10.11877/j.issn.1672-1535.2019.17.14.03 |
| [11] |
Yang YM, Pan H, Xu WW, et al. Advances in targeted therapy for esophageal cancer[J]. Signal Transduct Target Ther, 2020, 5(1): 229. DOI:10.1038/s41392-020-00323-3 |
| [12] |
Yu Y, Guan H, Jiang LY, et al. Nimotuzumab, an EGFR-targeted antibody, promotes radiosensitivity of recurrent esophageal squamous cell carcinoma[J]. Int J Oncol, 2020, 56(4): 945-956. DOI:10.3892/ijo.2020.4981 |
| [13] |
Qu L, Wang JH, Du JX, et al. Use of nimotuzumab combined with cisplatin in treatment of nasopharyngeal carcinoma and its effect on expressions of VEGF and MMP-2[J]. Clin Transl Oncol, 2021, 23(7): 1342-1349. DOI:10.1007/s12094-020-02522-4 |
| [14] |
孔月, 谷庆, 方敏, 等. 同步加量放化疗联合尼妥珠单抗治疗不可手术的局部晚期食管鳞癌疗效观察[J]. 浙江医学, 2021, 43(12): 1307-1310. Kong Y, Gu Q, Fang M, et al. Efficiency of chemotherapy concurrent with SIB-IMRT plus nimotuzumab in treatment of unresectable local-advanced esophageal squamous cell carcinoma[J]. Zhejiang Med J, 2021, 43(12): 1307-1310. DOI:10.12056/j.issn.1006-2785.2021.43.12.2021-823 |
| [15] |
傅国林. 尼妥珠单抗在局部晚期食管癌同步放化疗中的疗效观察[J]. 中国基层医药, 2017, 24(22): 3457-3461. Fu GL. Curative effect of nimotuzumab combined with concurrent chemoradiotherapy in the treatment of locally advanced esophageal carcinoma[J]. Chin J Prim Med Pharm, 2017, 24(22): 3457-3461. DOI:10.3760/cma.j.issn.1008-6706.2017.22.025 |
| [16] |
Ramos-Suzarte M, Lorenzo-Luaces P, Lazo NG, et al. Treatment of malignant, non-resectable, epithelial origin esophageal tumours with the humanized anti-epidermal growth factor antibody nimotuzumab combined with radiation therapy and chemotherapy[J]. Cancer Biol Ther, 2012, 13(8): 600-605. DOI:10.4161/cbt.19849 |
| [17] |
曾程, 杨丹, 杜荣旭, 等. 局部晚期不可手术食管癌同步放化疗联合尼妥珠单抗的初步临床分析[J]. 中华放射肿瘤学杂志, 2021, 30(4): 353-356. Zeng C, Yang D, Du RX, et al. Preliminary clinical analysis of concurrent chemoradiotherapy combined with nituzumab for inoperable locally advanced esophageal cancer[J]. Chin J Radiat Oncol, 2021, 30(4): 353-356. DOI:10.3760/cma.j.cn113030-20210127-00046 |
| [18] |
王旭, 张洁, 陈宏宏. 同步放化疗联合尼妥珠单抗治疗食管癌的疗效及预后因素分析[J]. 癌症进展, 2020, 18(17): 1782-1785, 1805. Wang X, Zhang J, Chen HH. Efficacy of concurrent chemoradiothrapy combined nimotuzumab in esophageal carcinoma and the prognostic factors[J]. Oncol Prog, 2020, 18(17): 1782-1785, 1805. DOI:10.11877/j.issn.1672-1535.2020.18.17.16 |
| [19] |
Chen YS, Wu XY, Hao DX, et al. Neoadjuvant nimotuzumab plus chemoradiotherapy compared to neoadjuvant chemoradiotherapy and neoadjuvant chemotherapy for locally advanced esophageal squamous cell carcinoma[J]. Oncotarget, 2019, 10(40): 4069-4078. DOI:10.18632/oncotarget.23861 |
| [20] |
de Castro Junior G, Segalla JG, de Azevedoet SJ, et al. A randomised phase Ⅱ study of chemoradiotherapy with or without nimotuzumab in locally advanced oesophageal cancer: NICE trial[J]. Eur J Cancer, 2018, 88: 21-30. DOI:10.1016/j.ejca.2017.10.005 |
| [21] |
Jing W, Yan WW, Liu YG, et al. Slight advantages of nimotuzumab versus cetuximab plus concurrent chemoradiotherapy in locally advanced esophageal squamous cell carcinoma[J]. Cancer Biol Ther, 2019, 20(8): 1121-1126. DOI:10.1080/15384047.2019.1598760 |
 2023, Vol. 43
2023, Vol. 43


