2. 空军军医大学军事预防医学系辐射防护医学教研室, 西安 710032
2. Department of Radiation Protection Medicine, School of Military Preventive Medicine, Air Force Military Medical University, Xi'an 710032, China
近年来,第5代移动通讯技术(5G)迅猛发展。截至2021年底,我国累计建成并开通5G基站142.5万个,总量占全球60%以上,建成全球最大5G网,5G移动电话用户达到3.55亿户[1]。随着人们暴露于5G手机辐射的时间和强度增加,越来越多的人开始关注5G手机辐射对健康的潜在影响。中枢神经系统是电磁辐射最敏感的靶点之一,研究结果显示,射频辐射(RF)可导致疲劳、头痛、失眠、耳鸣等症状[2-4],损伤学习记忆功能[5-6],甚至会诱导恶性肿瘤[7-9]。血脑屏障(BBB)存在于脑微血管和脑实质之间,是维持中枢神经系统内稳态的重要结构。有研究显示,暴露于手机发出的射频辐射会导致BBB通透性增加[10],同时,BBB相关蛋白表达水平的改变,但结论并不一致[11]。既往研究主要关注的通信频段是900 MHz、1.8 GHz等[12-13],而3.5与4.9 GHz是近期发展起来的5G通讯较常用的两个频段,其对BBB通透性的影响尚未见报道。因此,本研究采用3.5与4.9 GHz射频辐射建立小鼠5G手机通讯频段射频辐射暴露模型,伊文思蓝(EB)荧光实验和Western blot检测小鼠BBB通透性的改变及可能的分子机制。
材料与方法1.实验动物:健康成年(6~8周龄)雄性C57BL/6小鼠,共24只,购自空军军医大学实验动物中心, 生产许可证号:SCXK(陕)2019-001。体质量(21.6±1.0) g,按随机数表法随机分为假暴露(Sham)组、3.5 GHz RF组和4.9 GHz RF组,每组8只。饲养温度(23±1)℃,可自由进食进水,光照节律为12 h/12 h光照和黑暗循环,适应性饲养1周后开始照射。本研究的实验操作均按照空军军医大学实验动物中心福利与伦理委员会的指导方针进行,伦理号:IACUC-20220123。
2.射频暴露:射频暴露装置由信号发生器(Keysight N5171B,美国是德科技公司)、功率放大器(BONN BLMA0860-100,德国波恩公司)和辐射天线(XJT-DR10180,西安新加腾公司)组成。辐射天线发射频率3.5 GHz或4.9 GHz的脉冲辐射, 功率密度(PD)50 W/m2。将清醒的小鼠置于有孔的有机玻璃盒内,将盒子置于距离辐射天线70 cm处。两照射组小鼠分别全身连续照射35 d(1 h/d)。Sham组小鼠处理方法同前,但暴露装置信号发生器未开启。定期观察小鼠的健康状况,每3天测量1次体重。
3.Evans Blue荧光实验:辐照结束后次日取材。每组两只小鼠尾静脉注射2% EB,剂量为4 ml/kg。EB在体内循环1 h后进行取材,具体步骤如下:腹腔注射1%戊巴比妥钠进行麻醉,首先使用0.9%生理盐水进行心脏灌注,冲洗直至右心耳流出清亮液体,然后使用4%多聚甲醛(PFA)灌注固定。在冰上快速剥离大脑后,放入聚乙二醇和聚乙烯醇的水溶性混合物(OCT)包埋剂中,冻存于-80℃冰箱待用。使用冰冻切片机在-20℃环境下对脑组织进行冠状序列冰冻切片,厚度为15 μm,每隔10张留一张切片,每只小鼠留取约30张。贴片后在荧光显微镜下观察小鼠大脑皮层EB渗出情况。BBB通透性判断标准如表 1,每组共取3张切片,每张切片拍摄3张200倍图片用于统计分析,每张切片总得分=点数记分+强度记分+面积计分。
|
|
表 1 BBB通透性评分标准 Table 1 The scoring criteria of BBB permeability |
4.酶联免疫吸附实验(ELISA):小鼠腹腔注射1%戊巴比妥钠进行麻醉,然后剪开胸部进行心脏取血,4℃离心,3 000 r/min,离心半径8 cm,离心15 min后取上清,置于-80℃冰箱,待进行下一步实验。采用ELISA实验检测血清中S100B蛋白含量。每组6个样本,并设复孔,具体步骤参考小鼠S100B ELISA检测试剂盒(HY-100137,北京华英生物公司)。
5.蛋白质免疫印迹实验(Western blot):采用Western blot实验检测小鼠皮层BBB相关蛋白含量水平,每组按随机数表法随机选取3只小鼠的大脑皮层用于实验,具体步骤如下:1%戊巴比妥钠麻醉小鼠,0.9%生理盐水进行心脏灌注,在冰上快速断头取脑,取小鼠皮层组织,制备组织匀浆,使用全蛋白提取试剂盒(KGP250,南京凯基生物公司)提取皮层全蛋白。采用蛋白质定量试剂盒(西安米鼠生物公司)测定蛋白浓度,加入5 ×上样缓冲液,100℃加热10 min使其变性,自然冷却后备用。取40 μg蛋白样品进行电泳,凝胶电泳分离蛋白质后,采用湿转法将蛋白转移至0.45 μm孔径的聚偏二氟乙烯膜(PVDF),使用含有5%脱脂牛奶的Tris-HCl缓冲液(TBST)封闭2 h后,4℃过夜孵育一抗。一抗包括ZO-1(1 :2 000,美国Proteintech公司),Occludin(1 :2 000,美国Proteintech公司),Claudin-11(1 :2 000,美国Affinity公司),Connexin 43(Cx43,1 :1 000,美国Proteintech公司)。一抗孵育结束后,室温复温30 min,TBST清洗4次,每次5 min。室温孵育相应种属二抗(1 :5 000,西安壮志公司)2 h,TBST清洗4次,每次5 min。滴加超敏发光液在凝胶成像系统中曝光并保存图片。以β-肌动蛋白为内参标准化蛋白含量,用Image J软件进行图片分析。
6.统计学处理:使用SPSS 25.0软件进行分析。数据经正态性检验符合正态分布,以x±s表示。组间比较符合方差齐性,采用单因素方差分析,RF组与Sham组两两比较采用Dunnett-t检验。P< 0.05为差异有统计学意义。
结果1.射频辐射对小鼠血脑屏障通透性的影响:小鼠脑微血管EB荧光结果显示,与Sham组相比,3.5 GHz RF组和4.9 GHz RF组小鼠EB渗出明显增多,光斑数量和荧光强度明显增加,且4.9 GHz RF组小鼠渗出更加明显(图 1)。根据EB评分标准,得到半定量结果,Sham组、3.5 GHz RF组、4.9 GHz RF组得分分别为0、19.67±2.52、27.00±2.00。单因素方差分析表明,荧光综合得分组间存在显著差异(F=169.77,P < 0.001)。与Sham组比较,3.5 GHz RF组和4.9 GHz RF组小鼠BBB通透性增加(t=12.98、17.82,P < 0.001),且4.9 GHz RF组小鼠渗出更加明显。
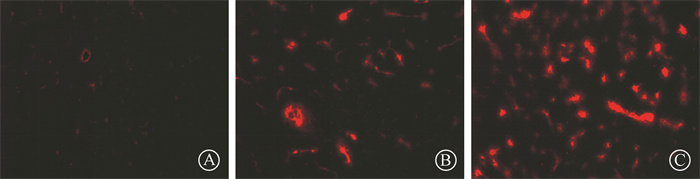
|
注:Sham.假暴露;RF.射频辐射 图 1 各处理组小鼠大脑皮层血脑屏障EB荧光检测结果×200 A.Sham组;B.3.5 GHz RF组;C.4.9 GHz RF组 Figure 1 EB fluorescence staining of cerebral cortex blood-brain barrier (BBB) in mice of each group ×200 A.Sham group; B.3.5 GHz RF group; C.4.9 GHz RF group |
2.射频辐射对小鼠血清S100B蛋白含量的影响:为了验证BBB通透性是否增加,通过ELISA检测了连续暴露35 d后小鼠血清中S100B蛋白含量水平。Sham组、3.5 GHz RF组和4.9 GHz RF组分别为(123.4±4.7)、(178.4±3.3) 和(165.2±6.3) pg/ml,单因素方差分析表明,组间S100B含量存在显著差异(F=203.71,P < 0.001)。与Sham组相比,3.5 GHz RF组和4.9 GHz RF组小鼠血清S100B蛋白水平显著升高(t=19.34、14.68,P < 0.001)。
3.射频辐射对小鼠血脑屏障紧密连接相关蛋白的影响:为了进一步观察BBB的改变,通过Western blot实验检测ZO-1、Occludin、Claudin-11表达水平变化(图 2)。如表 2所示,单因素方差分析表明,组间Occludin灰度值差异有统计学意义(F=21.46,P < 0.01)。与Sham组相比,3.5 GHz RF组和4.9 GHz RF组ZO-1相对表达量差异无统计学意义(P>0.05)。与Sham组相比,3.5 GHz RF组Occludin相对表达量显著下降,差异有统计学意义(t=-3.13,P < 0.05),4.9 GHz RF组下降更多(t=-6.55,P < 0.05)。与Sham组相比,Claudin-11相对表达量差异无统计学意义(P>0.05)。
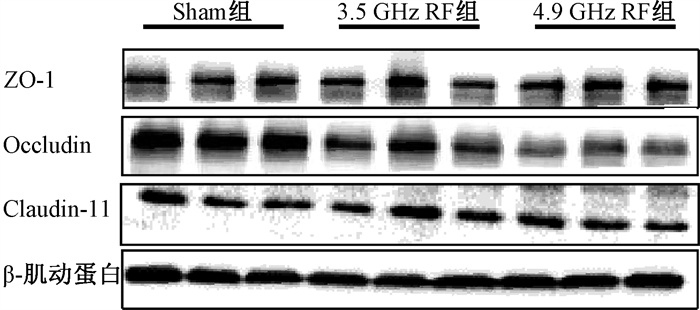
|
注:Sham.假暴露;RF.射频辐射 图 2 各组皮层BBB紧密连接相关蛋白Western blot代表性条带 Figure 2 Representative Western blot images of BBB tight junction associated proteins in cortex in each group |
|
|
表 2 紧密连接相关蛋白灰度值半定量结果(x±s) Table 2 Semi-quantitative results of the gray values of tight junction-related proteins measured by Western blot assay(x±s) |
4.射频辐射对小鼠血脑屏障缝隙连接相关蛋白的影响:为了探究BBB通透性增加是否与缝隙连接相关,检测了Connexin 43 (Cx43) 蛋白表达水平(图 3)。Sham组、3.5 GHz RF组和4.9 GHz RF组Cx43灰度值分别为1.00±0.05、0.91±0.07、0.90±0.04。单因素方差分析表明,组间Cx43灰度值差异无统计学意义(P>0.05)。
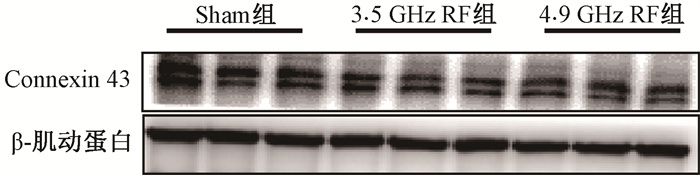
|
注:Sham.假暴露;RF.射频辐射 图 3 各组皮层BBB缝隙连接相关蛋白Cx43 Western blot代表性条带 Figure 3 Representative Western blot images of BBB gap junction associated protein Cx43 in cortex in each group |
讨论
BBB由毛细血管和脑微血管内皮细胞、周细胞、星形胶质细胞终足和基膜构成,将大脑与循环系统分隔开,防止神经毒性的血浆成分、血细胞和病原体进入大脑[14],以维持脑内环境的稳定。BBB在生理状态下仅允许小分子脂溶性物质及脑内所需营养物质透过,但在多种生物和理化因素等损伤作用下,其通透性会异常增加,进而导致脑内稳态的破坏[15]。BBB损伤会引起离子失调、水肿和神经炎症,从而造成神经元功能障碍、颅内压升高和神经元变性[16]。
EB荧光实验是检测BBB通透性的常用方法之一。EB是一种自带荧光的偶氮染料,与血清中的白蛋白高度亲和,当BBB受损时,结合了EB的白蛋白可进入脑实质,通过激发EB荧光可检测BBB的完整性。本研究发现,3.5或4.9 GHz射频辐射暴露后,小鼠脑皮层微血管周围EB荧光斑点增多,强度增强,面积增大,说明小鼠BBB通透性增加,且4.9 GHz效应更加明显。Tang等[17]应用EB荧光实验检测大鼠暴露于900 MHz后BBB的通透性,发现其在14 d增加,并在28 d后达到更高水平,与本研究结果一致。同时,既往研究发现,对大鼠进行频率为1 840 MHz、比吸收率(SAR)为2 W/kg、每日1 h、连续7 d的全身辐照,BBB通透性增加[18],本研究结果与其一致。以上表明,不同的频率和时间等暴露条件,均会导致血脑屏障的通透性增加。但也有研究存在差异,Cosquer等[19]发现,大鼠在2.45 GHz电磁场(EMF)暴露45 min后,通过EB荧光实验并未发现BBB通透性改变。这表明,不同射频辐射导致BBB通透性的增加需要特定的暴露条件,这可能是效应窗口存在导致的差异。
S100B是脑星形胶质细胞分泌的一种酸性钙结合蛋白[20],生理情况下,S100B不能透过BBB,当BBB受到破坏后,S100B可从脑实质穿过BBB进入血液中,导致血清中S100B含量迅速升高,因此,血清S100B水平经常被用于评价BBB的通透性[21]。本研究发现,3.5或4.9 GHz射频脉冲照射35 d后,小鼠血清中S100B含量较假照射组明显升高,与EB荧光结果一致。范红艳等[22]将小鼠暴露于频率为2 450 MHz,功率密度10.0 mW/cm2的微波辐射,连续照射28 d (90 min/d),发现血清S100B含量升高。这与本研究结果一致。但前期将大鼠全身暴露于74.25 W/m2,头部SAR为2.33 W/kg的射频辐射30 d(1 h /d),并未发现血清S100B含量升高[23]。同时,也有发现,人们暴露于890 MHz、SAR为2 W/kg的射频辐射30 min,在1 h后血清中S100B含量并未升高[10]。这表明频率、暴露强度和暴露时间不同,其对BBB的损伤程度可能不同。
紧密连接是BBB的重要组成部分, 紧密连接蛋白的表达和功能通常被用作评价BBB完整性的指标[24]。BBB的紧密连接由内皮细胞之间的紧密连接复合物构成,Claudins、Occludin是紧密连接的重要组成部分,这些跨膜蛋白通过多种细胞质衔接蛋白(如zonula occludens蛋白)进一步连接并稳定到细胞骨架上,其中与BBB通透性较密切的是ZO-1[25]。Claudin-11是一种含有207个氨基酸的四跨膜蛋白,与通透性也密切相关[26-27]。星形胶质细胞终足间存在大量的缝隙连接, 据报道,缝隙连接蛋白Cx43对BBB功能维持具有重要作用, 其减少可引起星形胶质细胞足突水肿, BBB功能下降[28]。本研究发现,3.5或4.9 GHz射频脉冲照射35 d后,小鼠皮层Claudin-11、ZO-1、Cx43表达水平无显著变化,但Occludin表达水平显著下降。Wang等[29]将构建的体外BBB模型暴露于频率为2.856 GHz、平均功率密度50 mW/cm2的微波中5 min,在暴露后1、6和12 h,Occludin表达下降,BBB通透性增加,与本研究结果一致,表明不同条件的射频辐射暴露均可能导致BBB的通透性增加,同时伴有Occludin表达下降。既往研究发现,大鼠在接受EMP暴露后,BBB通透性明显增加,并伴随ZO-1的定位的改变和蛋白水平的明显降低,但Occludin水平没有明显改变[30],这与本次的研究结果不一致,这提示,不同的电磁辐射,虽然均能导致BBB通透性增加,但其分子机制是不同的。以上结果提示3.5或4.9 GHz射频脉冲可能通过诱导Occludin表达减少从而破坏BBB结构,导致其通透性增加。上述研究结果的不一致,可能与电磁辐射自身的物理特性、研究对象的种属以及暴露条件的差异有关。
综上所述,在本实验条件下,功率密度为50 W/m2的3.5 GHz或4.9 GHz射频辐射连续照射小鼠35 d(1 h/d),可诱导小鼠大脑皮层血脑屏障通透性增加,其机制可能与5G手机通信频段射频辐射导致的大脑皮层紧密连接相关蛋白Occludin减少有关。
利益冲突 无
作者贡献声明 周桂强负责数据整理、统计分析、图表绘制、论文撰写;薛一哲负责实验操作,数据采集;张兆文、秦佟洲、郭玲、来盼盼协助实验操作和数据分析;高鹏协助数据分析和论文修改;王星、黄志飞、臧宇航、荆云涛协助数据整理与分析;丁桂荣负责指导课题设计和修改论文
| [1] |
中华人民共和国工业和信息化部. 2021年通信业统计公报解读[EB/OL]. https://www.miit.gov.cn/gxsj/tjfx/txy/index.html. Ministry of Industry and Information Technology, PRC. Interpretation of the 2021 communications industry statistical bulletin[EB/OL]. https://www.miit.gov.cn/gxsj/tjfx/txy/index.html. |
| [2] |
Szyjkowska A, Gadzicka E, Szymczak W, et al. The risk of subjective symptoms in mobile phone users in Poland-an epidemiological study[J]. Int J Occup Med Environ Health, 2014, 27(2): 293-303. DOI:10.2478/s13382-014-0260-1 |
| [3] |
Tettamanti G, Auvinen A, Åkerstedt T, et al. Long-term effect of mobile phone use on sleep quality: Results from the cohort study of mobile phone use and health (COSMOS)[J]. Environ Int, 2020, 140: 105687. DOI:10.1016/j.envint.2020.105687 |
| [4] |
Medeiros LN, Sanchez TG. Tinnitus and cell phones: the role of electromagnetic radiofrequency radiation[J]. Braz J Otorhinolaryngol, 2016, 82(1): 97-104. DOI:10.1016/j.bjorl.2015.04.013 |
| [5] |
Al-Khlaiwi TM, Habib SS, Meo SA, et al. The association of smart mobile phone usage with cognitive function impairment in Saudi adult population[J]. Pak J Med Sci, 2020, 36(7): 1628-1633. DOI:10.12669/pjms.36.7.2826 |
| [6] |
Schoeni A, Roser K, Röösli M. Memory performance, wireless communication and exposure to radiofrequency electromagnetic fields: A prospective cohort study in adolescents[J]. Environ Int, 2015, 85: 343-351. DOI:10.1016/j.envint.2015.09.025 |
| [7] |
Baan R, Grosse Y, Lauby-Secretan B, et al. Carcinogenicity of radiofrequency electromagnetic fields[J]. Lancet Oncol, 2011, 12(7): 624-626. DOI:10.1016/s1470-2045(11)70147-4 |
| [8] |
Naidenko OV. Evidence base on the potential carcinogenicity of radiofrequency radiation[J]. JAMA Oncol, 2022, 8(6): 1. DOI:10.1001/jamaoncol.2022.0925 |
| [9] |
Peleg M, Nativ O, Richter ED. Radio frequency radiation-related cancer: assessing causation in the occupational/military setting[J]. Environ Res, 2018, 163: 123-133. DOI:10.1016/j.envres.2018.01.003 |
| [10] |
Söderqvist F, Carlberg M, Hardell L. Biomarkers in volunteers exposed to mobile phone radiation[J]. Toxicol Lett, 2015, 235(2): 140-146. DOI:10.1016/j.toxlet.2015.03.016 |
| [11] |
丁桂荣, 郭国祯. 电磁辐射对血脑屏障通透性的影响及其机制研究进展[J]. 中华劳动卫生职业病杂志, 2009, 27(9): 562-565. Ding GR, Guo GZ. Effect of electromagnetic radiation on blood-brain barrier and its mechanism[J]. Chin J Ind Hyg Occup Dis, 2009, 27(9): 562-565. DOI:10.3760/cma.j.issn.1001.9391.2009.09.013 |
| [12] |
Hardell L, Carlberg M. Comments on the US National Toxicology Program technical reports on toxicology and carcinogenesis study in rats exposed to whole-body radiofrequency radiation at 900 MHz and in mice exposed to whole-body radiofrequency radiation at 1900 MHz[J]. Int J Oncol, 2019, 54(1): 111-127. DOI:10.3892/ijo.2018.4606 |
| [13] |
Wang K, Lu JM, Xing ZH, et al. Effect of 1.8 GHz radiofrequency electromagnetic radiation on novel object associative recognition memory in mice[J]. Sci Rep, 2017, 7: 44521. DOI:10.1038/srep44521 |
| [14] |
Sweeney MD, Zhao Z, Montagne A, et al. Blood-brain barrier: From physiology to disease and back[J]. Physiol Rev, 2019, 99(1): 21-78. DOI:10.1152/physrev.00050.2017 |
| [15] |
Daneman R. The blood-brain barrier in health and disease[J]. Ann Neurol, 2012, 72(5): 648-672. DOI:10.1002/ana.23648 |
| [16] |
Profaci CP, Munji RN, Pulido RS, et al. The blood-brain barrier in health and disease: Important unanswered questions[J]. J Exp Med, 2020, 217(4): 1-16. DOI:10.1084/jem.20190062 |
| [17] |
Tang J, Zhang Y, Yang L, et al. Exposure to 900 MHz electromagnetic fields activates the mkp-1/ERK pathway and causes blood-brain barrier damage and cognitive impairment in rats[J]. Brain Res, 2015, 1601: 92-101. DOI:10.1016/j.brainres.2015.01.019 |
| [18] |
高鹏, 张克英, 周艳, 等. 1840 MHz射频辐射对大鼠血脑屏障通透性的影响[J]. 现代生物医学进展, 2017, 17(30): 5827-5831. Gao P, Zhang KY, Zhou Y, et al. Effects of 1840 MHz radio frequency electromagnetic radiation on the barrier permeability of blood-brain in rats[J]. Prog Mod Biomed, 2017, 17(30): 5827-5831. DOI:10.13241/j.cnki.pmb.2017.30.006 |
| [19] |
Cosquer B, Vasconcelos AP, Fröhlich J, et al. Blood-brain barrier and electromagnetic fields: effects of scopolamine methylbromide on working memory after whole-body exposure to 2.45 GHz microwaves in rats[J]. Behav Brain Res, 2005, 161(2): 229-237. DOI:10.1016/j.bbr.2005.02.025 |
| [20] |
Michetti F, Di Sante G, Clementi ME, et al. Growing role of S100B protein as a putative therapeutic target for neurological-and nonneurological-disorders[J]. Neurosci Biobehav Rev, 2021, 127: 446-458. DOI:10.1016/j.neubiorev.2021.04.035 |
| [21] |
Koh SX, Lee JK. S100B as a marker for brain damage and blood-brain barrier disruption following exercise[J]. Sports Med, 2014, 44(3): 369-385. DOI:10.1007/s40279-013-0119-9 |
| [22] |
范红艳, 李曼, 李景璐, 等. 微波辐射对小鼠学习记忆的影响及鹿茸多肽的干预研究[J]. 中国药学杂志, 2017, 52(22): 1988-1992. Fan HY, Li M, Li JL, et al. Effect of microwave radiation on learning and memory abilities in mice and intervention study of pilose antler peptide[J]. Chin Pharm J, 2017, 52(22): 1988-1992. DOI:10.11669/cpj.2017.22.007 |
| [23] |
芮刚. 5.8 GHz微波暴露对大鼠学习记忆的影响研究[D]. 西安: 中国人民解放军空军军医大学, 2020. Rui G. Effects of 5.8 GHz microwave exposure on learning and memory in rats[D]. Xi'an:PLA Air Force Military Medical University, 2020. |
| [24] |
Knox EG, Aburto MR, Clarke G, et al. The blood-brain barrier in aging and neurodegeneration[J]. Mol Psychiatry, 2022, 27(6): 2659-2673. DOI:10.1038/s41380-022-01511-z |
| [25] |
Chow BW, Gu C. The molecular constituents of the blood-brain barrier[J]. Trends Neurosci, 2015, 38(10): 598-608. DOI:10.1016/j.tins.2015.08.003 |
| [26] |
Reinhold AK, Rittner HL. Barrier function in the peripheral and central nervous system—a review[J]. Pflugers Arch, 2017, 469(1): 123-134. DOI:10.1007/s00424-016-1920-8 |
| [27] |
Uchida Y, Sumiya T, Tachikawa M, et al. Involvement of claudin-11 in disruption of blood-brain, -spinal cord, and arachnoid barriers in multiple sclerosis[J]. Mol Neurobiol, 2019, 56(3): 2039-2056. DOI:10.1007/s12035-018-1207-5 |
| [28] |
De Bock M, De Smet M, Verwaerde S, et al. Targeting gliovascular connexins prevents inflammatory blood-brain barrier leakage and astrogliosis[J]. JCI Insight, 2022, 7(16): 1-19. DOI:10.1172/jci.insight.135263 |
| [29] |
Wang LF, Li X, Gao YB, et al. Activation of VEGF/Flk-1-ERK pathway induced blood-brain barrier injury after microwave exposure[J]. Mol Neurobiol, 2015, 52(1): 478-491. DOI:10.1007/s12035-014-8848-9 |
| [30] |
Ding GR, Qiu LB, Wang XW, et al. EMP-induced alterations of tight junction protein expression and disruption of the blood-brain barrier[J]. Toxicol Lett, 2010, 196(3): 154-160. DOI:10.1016/j.toxlet.2010.04.011 |
 2023, Vol. 43
2023, Vol. 43


