2. 苏州大学苏州医学院放射医学与防护学院 放射医学与辐射防护国家重点实验室, 苏州 215123
2. State Key Laboratory of Radiation Medicine and Protection, School of Radiation Medicine and Protection, Suzhou Medical College of Soochow University, Suzhou 215123, China
利用X射线进行常规放射治疗(conventional radiotherapy,CONV-RT)是对抗肿瘤的重要手段,约50%的癌症患者需要接受放射治疗[1]。然而,CONV-RT除了向肿瘤细胞提供致命剂量,同时,周围正常组织不可避免地受到照射,由此带来的不良反应可能严重影响癌症患者的健康和生活质量[2]。超高剂量率放疗(FLASH radiotherapy,FLASH-RT)是以超高剂量率(>40 Gy/s)照射,照射时间一般 < 1 s,与先前的放疗技术相比,FLASH-RT可以明显提升正常组织对辐射的耐受性,该效应在保证对肿瘤杀伤效果等同于CONV-RT的情况下,对正常组织具有更好的保护作用[3]。因此,FLASH-RT效应在放射生物学中具有极其重要的作用。在最近发表的一项FLASH-RT治疗骨转移瘤的临床试验中(FAST-01),FLASH质子治疗对四肢骨转移癌的治疗效果符合预期,且无明显的不良反应[4],说明FLASH-RT在临床环境中是可行的。这是FLASH-RT的首次临床试验,也是将FLASH-RT应用于临床的漫长过程的第一步。然而,迄今为止,FLASH-RT的放射生物学机制尚未明晰。因此,阐明其生物学机制,对基础研究和临床工作具有重大意义。本研究旨在以C57BL/6J雄性小鼠为研究对象,观察FLASH-RT和CONV-RT对肝组织形态学影响,并探究FLASH-RT和CONV-RT对小鼠肝脏辐射损伤的转录组学表达谱差异,为深入研究FLASH-RT的生物学机制,进一步提升肿瘤的治疗效果提供理论基础和实验依据。
材料与方法1.实验动物与分组:C57BL/6J雄性小鼠11只,6~8周龄,体重18~22 g,健康无特定病原体级,购于成都达硕实验动物有限公司[生产许可证号:SCXK(川)2020-030],饲养于苏州大学无特定病原体级动物房屏障环境内,饲养温度18~25℃,相对湿度40%~70%,所有小鼠饲养1周适应环境后,按体重随机区组法分为健康对照组(Ctrl组,4只)、常规照射组(CONV-RT组,4只)和超高剂量率照射组(FLASH-RT组,3只)。
2.仪器与照射:小鼠腹腔注射戊巴比妥麻醉。用胶布将小鼠固定在塑料板上,以减少在辐射暴露期间的运动。FLASH辐照利用成都太赫兹自由电子激光设施的PARTER研究平台进行[5],以100 Gy/s的剂量率对腹部进行单剂量12 Gy照射,源皮距为19 cm,射野为2 cm × 2 cm。常规辐射采用6 MeV X射线(X-RAD SMART,Precision X-ray,美国North Branford公司)照射,以2 Gy/min的剂量率对腹部进行单剂量12 Gy照射。健康对照组小鼠在相同条件下接受0 Gy假辐射。
3.样本收集和HE染色分析:FLASH-RT和CONV-RT处理12 d后,常氧条件下用颈椎脱臼法处死实验用小鼠,取研究所需的肝脏组织,经TRIzol(上海宏生生物有限公司)裂解法提取总RNA后,送由北京诺禾致源科技股份有限公司进行RNA-Seq分析。肝脏标本经固定、石蜡包埋、3 μm切片、烘片、脱蜡复水后,苏木素-伊红染色,用中性树脂和盖玻片封片。
4.文库制备及测序:按照常规流程建库、获得文库。文库构建完成后,先使用Qubit 2.0 Fluorometer进行初步定量,随后使用Agilent 2100 bioanalyzer对文库的插入片段进行检测,符合预期后,实时定量聚合酶链反应(qRT-PCR)对文库有效浓度进行准确定量(文库有效浓度高于2 nmol/L),以保证文库质量。库检合格后,用Illumina Nova Seq6000进行测序,并产生150 bp配对末端读数。
5.数据分析:使用HISAT2(v2.0.5) 构建参考基因组的索引,并使用HISAT2(v2.0.5) 将配对末端clean reads与参照基因组比对。
(1) 差异表达分析:使用edgeR软件包(3.22.5) 进行。使用Benjamini & Hochberg方法调整P值。padj≤0.05且|log2(foldchange)|≥1被设定为显著差异表达的阈值。
(2) GO分析:通过clusterProfiler(3.8.1) 软件实现差异表达基因的基因本体论(Gene Ontology,GO)富集分析,对各组差异基因进行GO功能分析以注释并推测这些基因可能的作用。P < 0.05的GO条目为差异有统计学意义。
(3) KEGG分析:通过京都基因与基因组百科数据库(KEGG)可以了解生物系统的高级功能和效用,如细胞、生物体和生态系统等。本研究使用cluster Profiler(3.8.1) 软件分析KEGG通路中差异表达基因的统计富集。P < 0.05为显著富集的阈值。
(4) 差异mRNA对应的基因启动子区域分析:本研究使用cytoscape(3.7.2) 软件中的iRegulon插件预测靶基因的转录因子及motif,预测的motif的标准化富集得分(normalize enrichment score,NES)设定为3。
6.实时定量PCR分析:经TRIzol裂解法提取总RNA,并反转录成cDNA。利用SYBR Green试剂盒(南京诺唯赞生物科技公司)进行实时定量PCR检测。引物由苏州金唯智生物科技有限公司合成。β-肌动蛋白引物序列:正向5′ T G G A A T C C T G T G G C A T C C A T G A A A C 3′,反向5′ T A A A A C G C A G C T C A G T A A C A G T C C G 3′;Stat1引物序列:正向5′ G C T G C C T A T G A T G T C T C G T T T 3′,反向5′ T G C T T T T C C G T A T G T T G T G C T 3′;Irf9引物序列:正向5′ G C C G A G T G G T G G G T A A G A C 3′,反向5′ G C A A A G G C G C T G A A C A A A G A G 3′;Rela引物序列:正向5′ A G G C T T C T G G G C C T T A T G T G 3′,反向5′ T G C T T C T C T C G C C A G G A A T A C 3′。每组样品设3个复孔,按照2-ΔΔCt法计算基因表达水平。
7.统计学处理:采用SPSS 13.0软件进行统计学分析,计量数据符合正态分布的以 x±s表示,两组间比较采用两独立样本t检验。P < 0.05为差异有统计学意义。
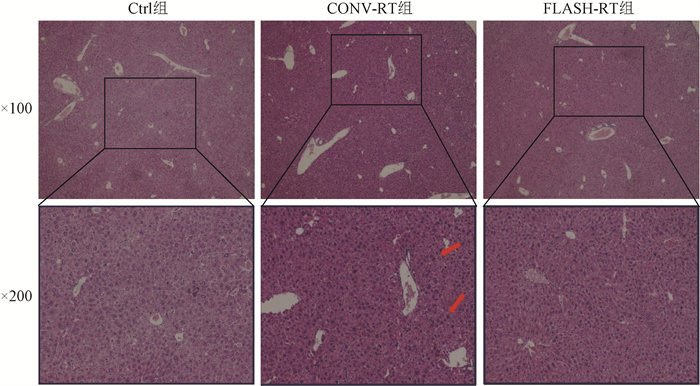
结果1. FLASH-RT和CONV-RT对小鼠肝脏组织形态的影响:为探讨不同辐射方式对小鼠肝组织的影响,分别采用FLASH-RT和CONV-RT建立小鼠肝损伤模型。通过HE染色观察小鼠肝脏组织的形态变化,与Ctrl组相比,CONV-RT组小鼠的肝脏组织被膜下出现多灶坏死,部分肝细胞出现水肿,间质中见大量炎细胞浸润,而FLASH-RT组小鼠的肝脏被膜下偶见坏死,肝细胞水肿不明显,间质炎细胞浸润程度明显减轻(图 1)。上述结果说明,与CONV-RT相比,FLASH-RT能够明显地降低肝脏组织的炎症反应。
|
注:红色箭头标记处为炎细胞灶性浸润区 图 1 Ctrl、CONV-RT和FLASH-RT组小鼠肝脏组织形态的变化 HE染色 Figure 1 The liver histomorphology changes of mice in Ctrl, CONV-RT and FLASH-RT groups HE staining assay |
2. FLASH-RT和CONV-RT对小鼠肝脏组织基因表达谱的影响:为了揭示FLASH-RT的潜在作用机制,对FLASH-RT组、CONV-RT组及Ctrl组小鼠的肝脏组织进行RNA seq分析,以确定FLASH-RT所引起的基因表达变化。分析结果显示,在FLASH-RT组与CONV-RT组之间共发现1 762个差异表达基因,其中包含Gm24196、Mup8、Gm17334、Ccdc114、Gm26020在内的660个上调基因,包含Tff2、Hemgn、Rhag、Add2、Rhd在内的1 102个下调基因;这些基因中,Gm24196上调幅度最大,Tff2下调幅度最大。在FLASH-RT组与Ctrl组之间共发现1 918个差异表达基因,其中上调基因728个,下调基因1 190个;这些基因中,Gm26710上调幅度最大,Pabpc4l下调幅度最大。在CONV-RT组与Ctrl组之间共发现1 569个差异表达基因,其中上调基因1 046个,下调基因523个。这些基因中,Gata1上调幅度最大,Gm38070下调幅度最大。
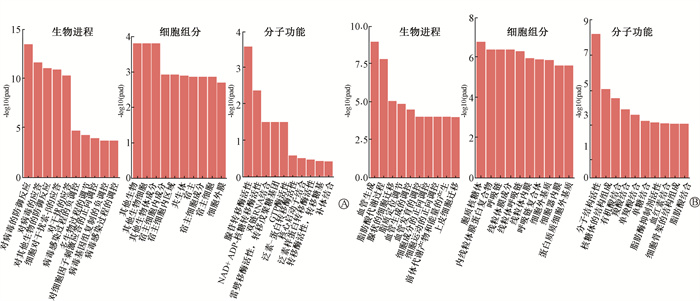
3.差异基因的GO功能分析:如图 2所示,FLASH-RT组和CONV-RT组小鼠肝脏组织之间差异基因涉及多种GO功能,如发生上调的生物进程中的对病毒的防御反应、应答、对其他生物的防御反应等;细胞组分中的其他生物、其他生物细胞、其他生物体成分等;分子功能中的腺苷转移酶活性、NAD+ ADP-核糖转移酶活性、双链RNA结合等功能(图 2A),以及发生下调的生物进程中的血管生成、脂肪酸代谢过程、腺状的细胞迁移等;细胞组分中的胞质核糖体、内线粒体膜蛋白复合物、呼吸链等;分子功能中的分子结构活性、核糖体的结构组成、有机酸结合等功能(图 2B)。FLASH-RT组和Ctrl组小鼠肝脏组织之间差异基因涉及多种GO功能,包括发生上调的生物进程中的对其他生物的防御反应、对病毒的应答、对其他生物的防御反应等;细胞组分中的内质网伴侣复合物、宿主细胞内组分、宿主细胞内区域等;分子功能中的双链RNA结合、腺苷转移酶活性、核心启动子结合等功能,以及发生下调的生物进程中的ATP代谢过程、电子传递链、线粒体ATP合成耦合电子传递等;细胞组分中的线粒体内膜蛋白复合体、线粒体内膜、线粒体蛋白复合体等;分子功能中的电子转移活性、辅因子结合、核糖体的结构组成等功能。CONV-RT组和Ctrl组小鼠肝脏组织之间差异基因涉及多种GO功能,包括发生上调的生物进程中的免疫反应的正向调节、白细胞迁移、吞噬作用等;细胞组分中的膜侧、浆膜的外侧、细胞皮质等;分子功能中的细胞骨架的结构组成、肌动蛋白结合、细胞因子受体活性等功能,以及发生下调的生物进程中的消化道发育、消化系统发育、心肌细胞凋亡过程的负向调控等;细胞组分中的顶端质膜、基底质膜、封闭连接等;分子功能中的细胞内配体门控离子通道活性、钙释放通道活性、配体门控钙通道活性等功能。
|
图 2 FLASH-RT组和CONV-RT组之间小鼠肝脏组织中差异基因mRNA富集倍数上调(A)以及下调(B)的生物进程、细胞组分和分子功能分析 Figure 2 Analysis of biological process, cell composition and molecular function of the up-regulation (A) and down-regulation (B) of differential gene mRNA enrichment in mouse liver between FLASH-RT group and CONV-RT group |
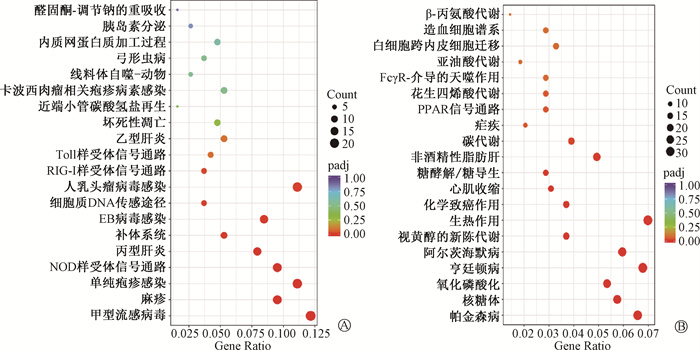
4.小鼠肝脏组织差异基因的KEGG通路分析:如图 3所示,FLASH-RT组与CONV-RT组之间小鼠肝脏组织差异基因涉及甲型流感病毒及单纯疱疹病毒感染等相关通路(上调,图 3A)以及生热作用、亨廷顿病等相关通路(下调,图 3B)。FLASH-RT组与Ctrl组之间小鼠肝脏组织差异基因涉及甲型流感病毒及NOD样受体信号通路等上调的相关通路,以及生热作用、亨廷顿病等下调的相关通路。CONV-RT组与Ctrl组之间小鼠肝脏组织差异基因涉及吞噬体及肺结核等上调的相关通路,以及紧密连接、人类乳头瘤病毒感染等下调的相关通路。
|
图 3 FLASH-RT组和CONV-RT组之间上调(A)及下调(B)小鼠肝脏组织中差异基因mRNA的KEGG通路分析 Figure 3 KEGG pathway analysis of differential gene mRNA in the liver of mice up-regulated (A) and down-regulated (B) between FLASH-RT and CONV-RT Groups |
5. FLASH-RT诱导的mRNA转录分析:利用Cytoscape分析差异mRNA对应的基因启动子区域,预测motif的标准化富集得分(normalize enrichment score,NES)设定为3,筛选出相应的转录因子和motif。推测的转录因子及motif如表 1所示,例如,在FLASH-RT和CONV-RT组中,转录因子Irf9、Stat1、Dmrt1、Rela和Creb3l1等可能与上调的mRNA有关,其中Irf9和Stat1的转录因子结合基序的NES超过8。转录因子Elk3、Spic和Gata2等可能与下调的mRNA有关。
|
|
表 1 不同照射条件下诱导的mRNA转录分析 Table 1 Transcriptional analysis of mRNAs under different irradiation conditions |
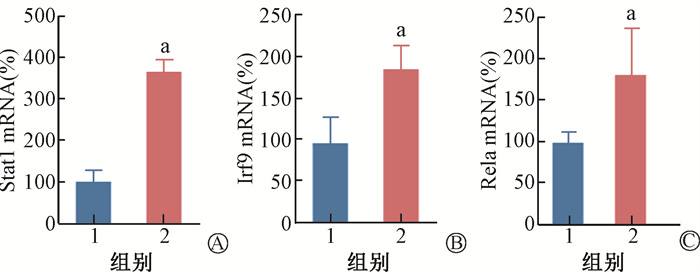
6.实时定量PCR验证基因表达:利用实时定量PCR对Stat1等3个基因的表达进行了验证,结果显示,与CONV-RT组相比,FLASH-RT组Stat1、Irf9和Rela基因的表达量明显升高,差异具有统计学意义(t=6.62、2.11、1.67,P < 0.05,图 4)。
|
注:1.CONV-RT组;2.FLASH-RT组;a与CONV-RT组比较,t=6.62、2.11、1.67,P < 0.05 图 4 FLASH-RT和CONV-RT照射后基因表达水平的改变A. Stat1;B. Irf9;C. Rela Figure 4 Changes of gene expression levels in FLASH-RT and CONV-RT groups A. Stat1; B. Irf9; C. Rela |
讨论
放射治疗是对恶性肿瘤或少数良性病变进行治疗的一种重要方法。与CONV-RT相比,FLASH-RT可以采用超过40 Gy/s的超高剂量率对肿瘤靶区进行照射,缩短了分次照射时间和总治疗时间,从而在控制局部肿瘤的同时,减少对正常组织的损伤,有效地改善患者预后。因此,FLASH-RT在肿瘤治疗中是一种更优的治疗,具有巨大的应用潜力,基于此,FLASH-RT已成为当前放疗领域的研究热点[6-7]。本研究意在进一步探究FLASH-RT对小鼠肝脏组织基因表达谱的影响。
肝脏是放射敏感器官,放射性肝炎或辐射性肝病是继发于肝脏放疗后最严重的并发症,是由于放射治疗引起的一种亚急性肝损伤(radiation-induced liver disease,RILD)[8]。肝活检结果显示,内皮水肿、肝静脉末梢狭窄、肝窦充血、实质萎缩和胶原增生。RILD的发病机制包括与血管变化、胶原蛋白合成增加和关键生长因子和细胞因子的激活相关的复杂的和多细胞反应,关键生长因子和细胞因子包括肿瘤坏死因子α (TNF-α)、转化生长因子β (TGF-β)等。虽然近年来对RILD的发病机制的认识有所提高,但其分子机制仍不清楚。在本研究中,观察FLASH-RT和CONV-RT对小鼠肝脏组织形态的影响,结果发现,与CONV-RT组相比,FLASH-RT组小鼠肝脏被膜下坏死灶减少,炎细胞数量明显减少,肝细胞水肿程度显著降低,提示FLASH辐射能够有效地降低肝脏组织的炎症反应。转录组测序(RNA-sequencing,RNA-seq)技术以高通量测序技术进行测序分析,提供关于多种条件下各种生物基因表达水平的丰富信息[9-10]。从这些信息中产生了差异表达基因(differentially expressed genes,DEGs),其表达水平在两种或两种以上的条件下被确定为显著差异表达[11-12]。为了明确FLASH辐射对小鼠肝脏组织内源基因表达的影响,以FLASH-RT、CONV-RT及Ctrl的肝脏组织为材料进行了RNA-seq分析。本研究以P < 0.05作为DEGs筛选条件,共鉴定出46 702条基因,其中有1 762条在FLASH-RT组与CONV-RT组之间差异表达,1 918条在FLASH-RT组与Ctrl组之间差异表达,1 569条在CONV-RT组与Ctrl组之间差异表达。
对肝脏组织的差异基因进行GO富集分析,有趣的是,在FLASH-RT组与CONV-RT组和FLASH-RT组与Ctrl组之间,显著上调的GO term均属于GO功能3个亚类之中的生物过程,于是推测FLASH辐射对小鼠肝脏组织生物过程中的相关功能造成影响,从而影响肝脏的组织形态与炎症反应。KEGG通路富集分析的结果显示,FLASH-RT组与CONV-RT组和FLASH-RT组与Ctrl组上调的差异表达基因中共同显著富集的通路包括甲型流感病毒、单纯疱疹病毒感染、NOD样受体信号通路,FLASH-RT组与CONV-RT组和FLASH-RT组与Ctrl组下调的差异表达基因中共同显著富集的通路主要包括生热作用、亨廷顿病、帕金森病及阿尔茨海默病等相关通路。上述结果提示,FLASH-RT的机制可能与免疫反应有关。
对差异mRNA对应的基因启动子区域进行评估,结果发现,在FLASH-RT组与CONV-RT组和FLASH-RT组与Ctrl组之间,Stat1在上调的mRNA的转录因子结合基序中显著富集。其中,在FLASH-RT组与CONV-RT组之间的660个上调的差异表达基因中,Stat1可以调控361个靶基因,在FLASH-RT组与Ctrl组之间的728个上调的差异表达基因中,Stat1可以调控377个靶基因。信号转导与转录激活因子1(Stat1) 是转录因子家族(Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b和Stat6) 的成员,对于细胞对细胞因子和生长因子的反应至关重要。在静息细胞中,STATs蛋白定位在细胞质中,在接受特定刺激后可转移到细胞核。STATs转录因子能够检测各种环境信号,并将其转导到细胞核,直接影响基因调控。Stat1作为干扰素信号通路的关键调节因子,参与多种生物活动,如胚胎发育,器官发生,先天和适应性免疫,细胞生长和分化,以及程序性细胞死亡[13]。Stat1已被证实是氧化还原敏感蛋白。研究表明,细胞缺氧后Stat1依赖于氧化还原的方式被激活,并与细胞存活密切相关[14]。Liu等[15]报道,心肌细胞经过缺氧处理后,Stat1的表达和磷酸化水平显著上调。上述研究证实,Stat1是组织缺氧过程中的一个关键分子。有文献提出氧耗竭使辐射诱导的游离氧自由基减少从而避免正常组织损伤的可能[2],本研究结果与此相符。综上所述,转录因子Stat1可能被FLASH照射激活。
本研究对小鼠受照后肝脏组织基因表达水平的变化进行了分析,研究结果表明,与CONV-RT相比,FLASH-RT能够有效地降低肝脏组织的炎症反应,这种低放射不良反应可能与组织缺氧引起辐射抵抗有关。本实验结果为进一步探究FLASH-RT的生物学机制提供了理论基础。
利益冲突 无
作者贡献声明 杨天宇负责实验设计、数据分析和论文撰 写;徐蒙蒙、胡文涛、张永胜协助实验;曹志飞指导实验 设计和论文的修改
| [1] |
Maxim PG, Keall P, Cai J. FLASH radiotherapy: Newsflash or FLASH in the pan?[J]. Med Phys, 2019, 46(10): 4287-4290. DOI:10.1002/mp.13685 |
| [2] |
Zhou GM. Mechanisms underlying FLASH radiotherapy, a novel way to enlarge the differential responses to ionizing radiation between normal and tumor tissues[J]. Radiat Med Prot, 2020, 1(1): 35-40. DOI:10.1016/j.radmp.2020.02.002 |
| [3] |
罗辉, 闫明阳, 贾雪超, 等. 超高剂量率放疗在恶性肿瘤中的应用[J]. 中华放射医学与防护杂志, 2021, 41(8): 636-640. Luo H, Yan MY, Jia XC, et al. Application of FLASH radiotherapy with an ultra-high dose rate in malignant tumor[J]. Chin J Radiol Med Prot, 2021, 41(8): 636-640. DOI:10.3760/cma.j.issn.0254-5098.2021.08.013 |
| [4] |
Mascia AE, Daugherty EC, Zhang Y, et al. Proton FLASH radiotherapy for the treatment of symptomatic bone metastases: The FAST-01 nonrandomized trial[J]. JAMA Oncol, 2023, 9(1): 62-69. DOI:10.1001/jamaoncol.2022.5843 |
| [5] |
Gao F, Yang Y, Zhu H, et al. First demonstration of the FLASH effect with ultrahigh dose rate high-energy X-rays[J]. Radiother Oncol, 2022, 166: 44-50. DOI:10.1016/j.radonc.2021.11.004 |
| [6] |
Harrington KJ. Ultra high dose-rate radiotherapy: Next steps for FLASH-RT[J]. Clin Cancer Res, 2019, 25(1): 3-5. DOI:10.1158/1078-0432.CCR-18-1796 |
| [7] |
De La Pinta Alonso C. Radiation-induced liver disease in the era of SBRT: a review[J]. Expert Rev Gastroenterol Hepatol, 2020, 14(12): 1195-1201. DOI:10.1080/17474124.2020.1814744 |
| [8] |
Finotello F, Di Camillo B. Measuring differential gene expression with RNA-seq: challenges and strategies for data analysis[J]. Brief Funct Genomics, 2015, 14(2): 130-142. DOI:10.1093/bfgp/elu035 |
| [9] |
McDermaid A, Monier B, Zhao J, et al. Interpretation of differential gene expression results of RNA-seq data: review and integration[J]. Brief Bioinform, 2019, 20(6): 2044-2054. DOI:10.1093/bib/bby067 |
| [10] |
McDermaid A, Monier B, Zhao J, et al. Interpretation of differential gene expression results of RNA-seq data: review and integration[J]. Brief Bioinform, 2019, 20(6): 2044-2054. DOI:10.1093/bib/bby067 |
| [11] |
Oshlack A, Robinson MD, Young MD. From RNA-seq reads to differential expression results[J]. Genome Biol, 2010, 11(12): 220. DOI:10.1186/gb-2010-11-12-220 |
| [12] |
Pertea M, Kim D, Pertea GM, et al. Transcript-level expression analysis of RNA-seq experiments with HISAT, StringTie and Ballgown[J]. Nat Protoc, 2016, 11(9): 1650-1667. DOI:10.1038/nprot.2016.095 |
| [13] |
Ovadia A, Sharfe N, Hawkins C, et al. Two different STAT1 gain-of-function mutations lead to diverse IFN-γ-mediated gene expression[J]. NPJ Genom Med, 2018, 3: 23. DOI:10.1038/s41525-018-0063-6 |
| [14] |
Terui K, Haga S, Enosawa S, et al. Hypoxia/re-oxygenation-induced, redox-dependent activation of STAT1 (signal transducer and activator of transcription 1) confers resistance to apoptotic cell death via hsp70 induction[J]. Biochem J, 2004, 380(Pt 1): 203-209. DOI:10.1042/BJ20031891 |
| [15] |
Liu S, He Y, Shi J, et al. STAT1-avtiviated LINC00961 regulates myocardial infarction by the PI3K/AKT/GSK3β signaling pathway[J]. J Cell Biochem, 2019, 120(8): 13226-13236. DOI:10.1002/jcb.28596 |
 2023, Vol. 43
2023, Vol. 43


