2. 华北水利水电大学数学与统计学院, 郑州 450046;
3. 香港大学生物科学学院, 香港 999077
2. School of Mathematics and Statistics, North China University of Water Resources and Electric Power, Zhengzhou 450046, China;
3. University of Hong Kong, Hong Kong 999077, China
超高剂量率放疗采用的照射剂量率为目前临床常规放疗的100~1 000倍,极大地缩短了照射时间,因此,又被称为FLASH放疗[1]。在过去的10年中,临床前研究及来自瑞士洛桑大学附属医院的全球首例皮肤淋巴瘤患者试验表明,FLASH放疗不仅能够保持与常规放疗相同的肿瘤控制率,而且可显著减轻正常组织放射损伤,危及器官耐受性增强,此种现象称之为FLASH效应[2-4]。目前,FLASH照射在诱导生物大分子DNA损伤中的效果及其生物学效应尚不明确。与常规照射相比,FLASH照射能够在微秒至毫秒级别的范围内给予设定的剂量,其极短的照射时间给量化分析照射诱导DNA链断裂损伤工作带来了挑战。
pBR322为人工构建的质粒,为环形双链的DNA分子,拥有超螺旋构型;该质粒不具备活细胞所拥有的DNA自我修复机制,可有效保留DNA损伤情况,有利于量化分析DNA链断裂损伤[5]。因此,本研究采用pBR322质粒作为研究对象,探讨FLASH照射在诱导DNA链断裂损伤中的生物学效应。
材料与方法1.实验材料:pBR322质粒DNA、SYBRTMSafe DNA凝胶染色剂(美国赛默飞世尔公司),Samwirin A(SW, 美国MCE公司),Varian TrueBeam SN1403、Varian 23CX医用直线加速器(美国瓦里安公司),Bugbox M低氧培养箱(英国Ruskinn公司),Gafchromic HD-V2型免冲洗胶片、FilmQATM Pro胶片分析系统(美国Ashland公司),Milli-Q Integral 3超纯水仪(德国默克密理博公司),电泳仪POWER PAC 300、紫外荧光成像分析系统(美国Bio-Rad公司)。
2.样品制备:将超纯水(溶解氧<10×10-9,电导率为18.2 μS/cm)或含0.01%的SW超纯水根据实验需要分别于生理(4%)和空气(21%)氧含量的条件下放置24 h。实施外照射前,取pBR322质粒DNA,移至0.2 ml的离心管(50 μl/管)备用。此外,取适量DNA样本依次梯度稀释用于制作DNA荧光强度与浓度标准曲线。
3.照射:样品分为对照组、常规照射组和FLASH照射组。照射均采用9 MeV电子线。FLASH照射采用改造后的Varian 23CX加速器,剂量率125 Gy/s;常规照射采用Varian TrueBeam SN1403加速器,剂量率为0.05 Gy/s。照射剂量分别为:1、3、5、10、15、30、50 Gy,采用Gafchromic EBT3胶片(剂量范围0.2~10 Gy)和Gafchromic HD-V2胶片(剂量范围10~1 000 Gy)测量验证FLASH照射剂量率。改造直线加速器用于实施FLASH照射具体过程和验证步骤见文献[6]。
4.琼脂糖凝胶电泳:采用水平琼脂糖凝胶电泳法检测质粒DNA损伤。取适量琼脂糖加入TAE缓冲液,于100℃加热至完全融化,配制终浓度为0.8%的琼脂糖凝胶,温度降至60℃后铺制电泳凝胶。将10 μl样品与1 μl的10×凝胶加样缓冲液(40%蔗糖和0.25%溴酚蓝)混合。室温下加入样品,并以50 V电压电泳150 min。电泳完毕后,将琼脂糖凝胶浸入染色液(147 ml去离子水、3 ml的1 × TAE缓冲液和1 μl的SYBRTM Safe DNA凝胶染色剂)中染色40 min。紫外荧光成像分析系统采集图像,观察并分析图像中超螺旋带DNA(supercoiled DNA,S,正常DNA)、开环带DNA[open circle DNA,C,合并单链断裂(SSB)DNA]、线性带DNA[linear DNA,L,合并双链断裂(DSB)DNA]的荧光强度。
5.FLASH照射的相对生物效应(RBE):正常DNA为超螺旋状态,发生断裂损伤的DNA表现为SSB和DSB两种形式,McMahon等[7]认为照射后质粒DNA断裂损伤程度与照射剂量成正比,DSB和SSB的产生具有随机性。其构建的DNA断裂损伤计算方程为:
| $ S=S_0 \mathrm{e}^{-\left(\beta_S+\beta_D\right) D} $ | (1) |
| $ C = {{\rm{e}}^{ - {\beta _D}D}}\left[ {{C_0}{{\rm{e}}^{ - \frac{1}{2}\beta _S^2{\mathtt{ρ}}{D^2} + }}{S_0}\left( {{{\rm{e}}^{ - \frac{1}{2}\beta _S^2{\mathtt{ρ}}{D^2} - {{\rm{e}}^{ - {\beta _S}}}^D}}} \right)} \right] $ | (2) |
| $ L = 1 - \left( {{C_0} + {S_0}} \right){{\rm{e}}^{ - \left( {{\beta _D}D + \frac{1}{2}\beta _S^2{\mathtt{ρ}}{D^2}} \right)}} $ | (3) |
式中,C为开环带(即SSB率);L为线性带(即DSB率);S为超螺旋带;S0、C0和L0分别为对照组样品中相应形式的DNA量;D为照射剂量,Gy;βS为1 Gy照射后的SSB率;βD为1 Gy照射后的DSB率。ρ为常数,与DNA碱基对数目有关。其中,βS和βD计算如下:
| $ \begin{array}{c} y\left( {{{\rm{\beta }}_S};{{\rm{\beta }}_D}} \right) = \\ \sum\limits_{ - \infty }^{ + \infty } {\sqrt {\frac{2}{3}\left( {D_S^2 + D_C^2 + D_L^2} \right)} } \frac{1}{{\sqrt {2\pi } \sigma }}{{\rm{e}}^{ - \frac{{\left( {D_S^2 + D_C^2 + D_L^2} \right)}}{{3{\sigma ^2}}}}} \end{array} $ | (4) |
式中,S为超螺旋带;C为开环带;L为线性带;σ为照射时实际剂量的标准差,Gy。
RBE以特定剂量某种射线照射产生的生物学效应为参考标准,用于评估不同种类的射线所诱导相同的生物效应所需要的剂量比。RBE值受到包括剂量率在内多种因素的影响。考虑到超高剂量率照射所具有的正常组织保护生物学优势,本研究以常规照射为参考,建立FLASH照射的RBE公式:
| $ \operatorname{RBE}_{(\mathrm{C} ; \mathrm{L})}=\frac{D_{\mathrm{FLASH}}}{D_{\mathrm{CONV}}} $ | (5) |
式中,DFLASH为FLASH照射的剂量,DCONV为常规照射的剂量。RBEC和RBEL分别为FLASH照射实现与常规照射相同的生物效能的剂量比。RBEC和RBEL的相应的标准差通过βS和βD计算。
6.统计学处理:SPSS 22.0软件用于统计分析。数据集的正态性检验采用Shapiro-Wilk法,非参数方差齐性检验采用Levene法,Kruskal-Wallis法用于检验独立样本的总体分布差异,符合方差齐性应用方差分析评估组间差异。P<0.05为差异具有统计学意义。
结果1.生理氧含量(4%)下FLASH照射后质粒DNA断裂损伤分析:为便于定量分析DNA琼脂糖凝胶电泳结果,建立了DNA荧光强度与浓度的标准曲线。如图 1,DNA浓度和荧光强度呈线性关系,说明定量分析荧光强度可用于估算DNA含量。
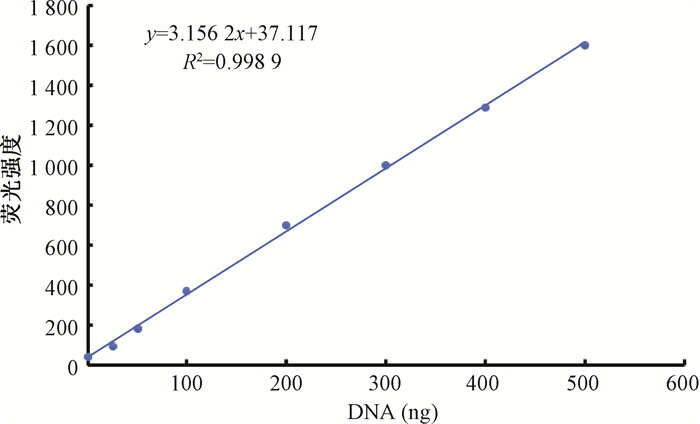
|
图 1 pBR322质粒DNA进行琼脂糖凝胶电泳实验以建立DNA浓度和荧光强度标准曲线 Figure 1 Agarose gel electrophoresis of pBR322 plasmid was performed to generate a standard curve for DNA concentration and its fluorescence intensity |
采用琼脂糖凝胶电泳实验对比分析了生理氧含量(4%)条件下,1、3、5、10、15、30、50 Gy常规照射和FLASH照射后pBR322质粒DNA损伤情况。结果表明,对照组仅存在超螺旋带DNA,而常规照射组和FLASH照射组不仅可以观察到超螺旋带DNA,而且合并开环带DNA和线性带DNA;与此同时,线性带的荧光强度均随着照射剂量的增加而明显增强(图 2A)。这表明FLASH照射和常规照射均可导致DNA断裂损伤,大剂量照射所诱导的DNA断裂损伤表现为线性带增加。值得注意的是,当置于超纯水的质粒DNA分别接受常规照射和FLASH照射后,尽管两组质粒开环带DNA发生率差异无统计学意义(P>0.05),但剂量≥10 Gy时,FLASH照射组质粒线性带DNA发生率较常规照射组明显减轻(t=5.28、5.79、7.01、7.66, P<0.05, 图 2B,2C)。
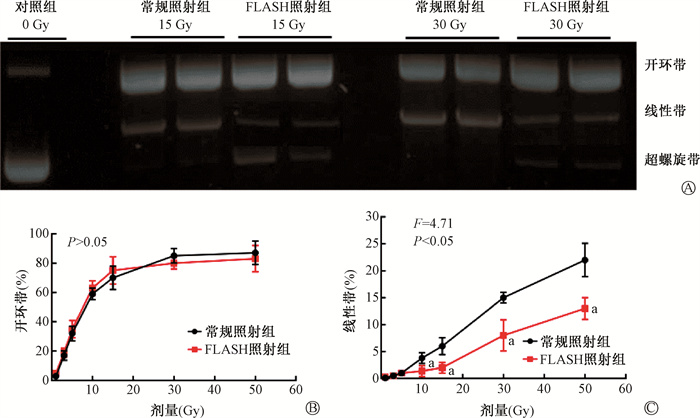
|
注:a与同一剂量常规照射组比较,t=5.28、5.79、7.01、7.66,P < 0.05 图 2 生理氧含量(4%)下常规照射和FLASH照射后的pBR322质粒DNA电泳变化A.电泳图谱;B.开环带DNA;C.线性带DNA Figure 2 Electrophoresis of pBR322 plasmid irradiated with conventional and FLASH irradiation under physioxia (4%) A. Representative image of agarose gel electrophoresis; B. Open circle DNA; C. Linear DNA |
2.清除自由基对照射后质粒DNA断裂损伤的影响:在4%氧含量条件下,将自由基清除剂SW加入放置质粒DNA的超纯水,再对质粒实施照射。结果显示,在1、3、5、10、15、30、50 Gy常规照射和FLASH照射后的DNA断裂损伤情况差异无统计学意义(P>0.05,图 3)。因此,FLASH和常规照射直接引发的DNA损伤无明显差别,自由基在FLASH和常规照射后的放射损伤中发挥作用。
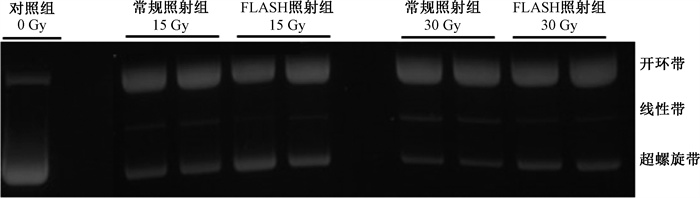
|
图 3 生理氧含量(4%)下pBR322质粒DNA置于含自由基清除剂的超纯水中接受常规和FLASH照射后电泳图 Figure 3 Electrophoresis of pBR322 plasmid in ultrapure water containing free radical scavenger. The plasmid solution was irradiated with conventional and FLASH irradiation under physioxia (4%), respectively |
3.氧含量对照射后DNA损伤的影响:进一步对比分析了空气氧含量(21%)条件下,FLASH照射后质粒DNA损伤程度。结果表明,21%的氧含量时,在1、3、5、10、15、30、50 Gy FLASH和常规照射后,DNA链断裂损伤差异无统计学意义(P>0.05,图 4)。此外,在21%氧含量条件下,采用自由基清除剂SW预加入超纯水中,再对质粒实施照射。结果显示,清除自由基可减轻照射后的DNA断裂损伤程度,但常规和FLASH照射两者之间差异无统计学意义(P>0.05)。所以,在21%氧含量条件下,FLASH照射较常规照射并未能减轻放射损伤;而且,FLASH照射时,DNA链断裂损伤受氧含量的影响。
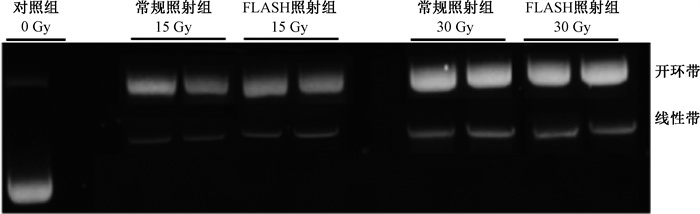
|
图 4 空气氧含量(21%)下接受常规和FLASH照射后的pBR322质粒DNA电泳图 Figure 4 Electrophoresis of pBR322 plasmid irradiated with conventional and FLASH irradiation under normoxia (21%) |
4. FLASH照射的RBE:生理氧含量条件下,FLASH照射诱导质粒DNA断裂损伤的RBE见表 1。当照射剂量相同时,FLASH照射每Gy诱导线性带DNA的损伤速率为常规照射的(2.78±0.03) 倍。同样,FLASH照射每Gy诱导开环带DNA的损伤速率为常规照射的(1.85±0.17) 倍。因此,即使采用相同的高能电子线,FLASH和常规照射的RBE存在差异。
|
|
表 1 FLASH照射诱导pBR322质粒DNA断裂的生物学效应(x±s) Table 1 Biological effectiveness of FLASH irradiation in inducing pBR322 plasmid DNA strand breaks(x±s) |
讨论
本研究采用pBR322质粒对比分析FLASH与常规照射后DNA损伤情况。结果表明,FLASH与常规照射通过直接作用诱导DNA链断裂损伤的程度一致,且受氧含量的影响;电离辐射间接作用产生的自由基与FLASH照射后线性带DNA发生率降低有关。
在经典的放射生物学中,电离辐射作用于生物DNA分子时通过直接作用和间接作用导致DNA链断裂损伤。其中,射线的能量能够直接沉积于生物大分子,引起DNA单链或双链断裂、碱基的破坏或脱落、氢键破坏及螺旋结构中出现交联等,该效应称为直接作用[8]。同时,在有氧条件下,射线能够在毫秒的时间内电离生物体内的水分子,激发产生化学性质极不稳定的H·、OH·、O2-·、eaq-、H2和化学性质相对稳定的H2O2;通过这些自由基及扩散的离子作用于生物分子,产生生物学效应(如自由基引发DNA损伤、结构改变,破坏细胞膜或诱导细胞膜脂质氧化应激、造成蛋白质失活等),即间接作用[9]。氧含量与生物体放射敏感性密切相关,该现象又称为氧效应。研究表明,高线性能量传递的射线作用于生物组织时主要通过直接作用诱导生物学效应;而低线性能量传递的射线诱导的生物学效应中,约70%为间接作用所致,仅30%表现为直接作用,氧效应在低线性能量传递的射线中最为明显[10]。氧含量的变化对机体一系列生物过程有重要影响,生理条件下,人体器官氧含量介于3%~10%,平均约4%,远低于21%的空气氧含量,被称为生理氧含量[11]。来自瑞士洛桑大学附属医院Vozenin等[2]研究认为氧含量影响FLASH放疗的生物学效应。部分学者尝试以氧消耗及其相关学说来阐述FLASH效应[12-13]。因此,在进行FLASH照射的研究中,有必要探讨氧含量对FLASH照射生物效应的影响;并在模拟生理氧含量的条件下,明确电离辐射直接作用和间接作用在FLASH效应中的权重。
在生理氧含量条件下培养的正常细胞增殖速率高于空气氧含量,呈现出不同的表型,可表现为放射抵抗[14]。而降低组织氧含量有可能减轻放射损伤。Durante等[15]认为FLASH照射可在极短时间内注入全部能量并瞬间耗竭细胞内的氧分子,组织未能及时有效地再氧合,因此表现为放射抵抗。计算机模型也证实放射性氧耗竭可减轻对正常细胞的损伤[13]。FLASH照射后细胞的氧增强比升高,也从侧面反映了细胞氧含量的快速下降[16]。有学者认为FLASH效应与快速氧耗竭密切相关,而且,还受组织微环境氧含量的影响:当组织氧含量为0.5%~4%时,可观察到FLASH效应;当氧含量为0或21%时,FLASH与常规照射相比并不能减轻正常组织放射损伤[17]。基于蒙特卡罗(MC)法的模拟分析表明,FLASH照射的氧消耗作用仅在低氧分压的细胞中最为明显[18]。本研究中,FLASH照射减轻质粒DNA损伤仅在生理氧含量条件下观察到,这也进一步证实,组织微环境氧含量影响FLASH效应。
既往有研究报道,电离辐射后瞬间生成的自由基可以109/s的速率与周围的生物分子发生反应[19]。SW是从接骨木中提取的一种天然化合物,具有抗氧化活性;在生理pH值下,SW表现出良好的自由基清除活性,能够以78倍于水溶性维生素E的速率清除水分子电离产生的自由基[20]。因此,SW可用作高效的自由基清除剂。本研究中,当孵育pBR322质粒的超纯水中未加入SW时,观察到FLASH照射后,线性带DNA发生率较常规放疗降低;然而,在应用SW清除自由基后,FLASH照射组和常规照射组质粒DNA的线性带DNA发生率差异无统计学意义。这表明FLASH和常规照射通过直接作用诱导生物DNA分子损伤无差别,FLASH照射后,线性带DNA发生率降低主要与电离辐射的间接作用有关。Shi等[21]基于小鼠模型发现FLASH照射后胞浆DNA片段数量显著低于常规照射,提出“DNA完整性”假说,即FLASH效应与瞬时照射期间DNA分子相对完整性得以保存有关。Wardman[22]描述了电离辐射间接作用引发的化学效应可能与FLASH效应有关,然而,组织细胞化学组成和水不同,这可能会影响电离辐射后自由基的产生。Hu等[23]认为FLASH照射瞬间可产生大量的自由基,导致高比例的自由基重组,从而减轻正常组织的氧化损伤;对于含有高浓度抗氧化剂的细胞,如部分肿瘤细胞,抗氧化剂会与过氧自由基发生竞争。因此,自由基重组的比例较低,这可能是肿瘤组织FLASH照射后并未发现控制率降低的原因之一。本研究采用pBR322质粒模型证实FLASH照射后DNA链断裂损伤率较常规照射减轻,并进一步揭示电离辐射间接作用产生的自由基与FLASH效应密切相关。未来需要更多的研究来阐述FLASH照射产生的自由基在维持DNA相对完整性中的作用。
FLASH放疗是肿瘤治疗领域发展过程中的一个里程碑。揭示FLASH效应的生物学机制有助于FLASH放疗的临床转化。国际上与FLASH放疗相关的临床试验陆续展开。美国辛辛那提儿童医院质子中心于2020年开展全球首项质子FLASH放疗临床试验FAST-01(NCT04592887),研究对象为合并临床症状的躯干表浅部位骨转移瘤患者,结果初步显示了FLASH放疗的安全性和有效性[24]。在此基础上,该中心于2022年启动了FAST-02临床试验(NCT05524064),纳入合并临床症状的胸部骨转移瘤患者,以进一步明确FLASH治疗效果。瑞士洛桑大学附属医院于2021年开展了恶性黑色素瘤皮肤转移的FLASH放疗剂量递增(22~34 Gy) Ⅰ期临床试验(NCT04986696),目前患者入组中。这些研究的不断推进给FLASH放疗的临床应用带来了曙光。
综上所述,本研究结果表明电离辐射产生的自由基可能与FLASH效应有关,而且,生理氧含量为FLASH照射减轻正常组织放射损伤的必需条件。FLASH放疗具有瞬时、高效的特点,这对推进放疗技术的发展具有重要意义。因此,未来关于FLASH放疗的临床前研究需模拟正常组织和肿瘤生长微环境,以期待能够更加精准地阐述FLASH放疗的生物学机制,并加速临床转化。
利益冲突 所有作者没有任何利益冲突,未接受任何不当的职务或财务利益
志谢 感谢瑞士洛桑大学附属医院放疗科全体成员对本文的指导与帮助,感谢瑞士洛桑大学生物医学系提供的支持
作者贡献声明 罗辉、袁期刚、Phyllis Zhang、马蕾杰负责实验、数据整理分析与论文撰写;毛荣虎、雷宏昌、孙亚楠、宋帅、王晓辉负责部分数据及文献整理,协助论文撰写;葛红指导论文命题、思路、结构及修改
| [1] |
罗辉, 闫明阳, 贾雪超, 等. 超高剂量率放疗在恶性肿瘤中的应用[J]. 中华放射医学与防护杂志, 2021, 41(8): 636-640. Luo H, Yan MY, Jia XC, et al. Application of FLASH radiotherapy with an ultra-high dose rate in malignant tumors[J]. Chin J Radiol Med Prot, 2021, 41(8): 636-640. DOI:10.3760/cma.j.issn.0254-5098.2021.08.013 |
| [2] |
Vozenin MC, De Fornel P, Petersson K, et al. The advantage of flash radiotherapy confirmed in mini-pig and cat-cancer patients[J]. Clin Cancer Res, 2019, 25(1): 35-42. DOI:10.1158/1078-0432.CCR-17-3375 |
| [3] |
Bourhis J, Sozzi WJ, Jorge PG, et al. Treatment of a first patient with FLASH-radiotherapy[J]. Radiother Oncol, 2019, 139: 18-22. DOI:10.1016/j.radonc.2019.06.019 |
| [4] |
Bourhis J, Montay-Gruel P, Goncalves Jorge P, et al. Clinical translation of FLASH radiotherapy: why and how?[J]. Radiother Oncol, 2019, 139: 11-17. DOI:10.1016/j.radonc.2019.04.008 |
| [5] |
Jamborová Z, Brabcová KP, Michaelidesová AJ, et al. Radiation damage to DNA plasmids in the presence of borocaptates[J]. Radiat Prot Dosim, 2022, 198(9-11): 532-536. DOI:10.1093/rpd/ncac094 |
| [6] |
马蕾杰, 毛荣虎, 雷宏昌, 等. 改造常规医用加速器实现Flash-RT及物理性能测量[J]. 中华放射肿瘤学杂志, 2022, 31(11): 1022-1027. Ma LJ, Mao RH, Lei HC, et al. Transform routine medical accelerators to achieve FLASH-RT and physical performance measurements[J]. Chin J Radiat Oncol, 2022, 31(11): 1022-1027. DOI:10.3760/cma.j.cn113030-20210830-00325 |
| [7] |
McMahon SJ, Currell FJ. A robust curve-fitting procedure for the analysis of plasmid DNA strand break data from gel electrophoresis[J]. Radiat Res, 2011, 175(6): 797-805. DOI:10.1667/RR2514.1 |
| [8] |
Huang RX, Zhou PK. DNA damage response signaling pathways and targets for radiotherapy sensitization in cancer[J]. Signal Transduct Target Ther, 2020, 5(1): 60. DOI:10.1038/s41392-020-0150-x |
| [9] |
Loh ZH, Doumy G, Arnold C, et al. Observation of the fastest chemical processes in the radiolysis of water[J]. Science, 2020, 367(6474): 179-182. DOI:10.1126/science.aaz4740 |
| [10] |
Rezaee M, Hill RP, Jaffray DA. The exploitation of low-energy electrons in cancer treatment[J]. Radiat Res, 2017, 188(2): 123-143. DOI:10.1667/RR14727.1 |
| [11] |
McKeown SR. Defining normoxia, physoxia and hypoxia in tumours-implications for treatment response[J]. Br J Radiol, 2014, 87(1035): 20130676. DOI:10.1259/bjr.20130676 |
| [12] |
Pawelke J, Brand M, Hans S, et al. Electron dose rate and oxygen depletion protect zebrafish embryos from radiation damage[J]. Radiother Oncol, 2021, 158: 7-12. DOI:10.1016/j.radonc.2021.02.003 |
| [13] |
Pratx G, Kapp DS. A computational model of radiolytic oxygen depletion during FLASH irradiation and its effect on the oxygen enhancement ratio[J]. Phys Med Biol, 2019, 64(18): 185005. DOI:10.1088/1361-6560/ab3769 |
| [14] |
Kumar B, Adebayo AK, Prasad M, et al. Tumor collection/processing under physioxia uncovers highly relevant signaling networks and drug sensitivity[J]. Sci Adv, 2022, 8(2): eabh3375. DOI:10.1126/sciadv.abh3375 |
| [15] |
Durante M, Brauer-Krisch E, Hill M. Faster and safer? FLASH ultra-high dose rate in radiotherapy[J]. Br J Radiol, 2018, 91(1082): 20170628. DOI:10.1259/bjr.20170628 |
| [16] |
Gao F, Yang Y, Zhu H, et al. First demonstration of the FLASH effect with ultrahigh dose rate high-energy X-rays[J]. Radiother Oncol, 2021, 166: 44-50. DOI:10.1016/j.radonc.2021.11.004 |
| [17] |
Tinganelli W, Sokol O, Quartieri M, et al. Ultra-high dose rate (FLASH) carbon ion irradiation: Dosimetry and first cell experiments[J]. Int J Radiat Oncol Biol Phys, 2022, 112(4): 1012-1022. DOI:10.1016/j.ijrobp.2021.11.020 |
| [18] |
Zhu H, Li J, Deng X, et al. Modeling of cellular response after FLASH irradiation: A quantitative analysis based on the radiolytic oxygen depletion hypothesis[J]. Phys Med Biol, 2021, 66(18): 185009. DOI:10.1088/1361-6560/ac226d |
| [19] |
Wardman P. The importance of radiation chemistry to radiation and free radical biology (the 2008 Silvanus Thompson Memorial Lecture)[J]. Br J Radiol, 2009, 82(974): 89-104. DOI:10.1259/bjr/60186130 |
| [20] |
Ngoc TD, Ha MVT, Le TN, et al. Antioxidant activity of natural Samwirin A: Theoretical and experimental insights[J]. ACS Omega, 2021, 6(41): 27546-27551. DOI:10.1021/acsomega.1c04569 |
| [21] |
Shi X, Yang Y, Zhang W, et al. FLASH X-ray spares intestinal crypts from pyroptosis initiated by cGAS-STING activation upon radioimmunotherapy[J]. Proc Natl Acad Sci U S A, 2022, 119(43): e2208506119. DOI:10.1073/pnas.2208506119 |
| [22] |
Wardman P. Approaches to modeling chemical reaction pathways in radiobiology[J]. Int J Radiat Biol, 2022, 98(9): 1399-1413. DOI:10.1080/09553002.2022.2033342 |
| [23] |
Hu A, Qiu R, Li WB, et al. Radical recombination and antioxidants: a hypothesis on the FLASH effect mechanism[J]. Int J Radiat Biol, 2022, 1-9. DOI:10.1080/09553002.2022.2110307 |
| [24] |
Mascia AE, Daugherty EC, Zhang Y, et al. Proton FLASH radiotherapy for the treatment of symptomatic bone metastases: The fast-01 nonrandomized trial[J]. JAMA Oncol, 2022, 23: e225843. DOI:10.1001/jamaoncol.2022.5843 |
 2023, Vol. 43
2023, Vol. 43


