放射性皮肤损伤(radiation-induced skin injury)在医疗照射、职业性暴露、应急照射等情况中时有发生。放射性皮肤损伤又称为放射性皮炎、皮肤辐射损伤等[1]。研究发现,辐射直接损伤皮肤及其深部组织细胞,导致皮肤干燥、失去弹性、色素沉着、软组织纤维化、毛细血管扩张,引起放射性皮炎,且对皮肤组织中的血管内皮细胞造成不可逆的损伤。受损的皮肤长期不愈合且易感染,病变最终发展为皮肤组织纤维化,甚至癌变,严重影响患者的生活质量[2]。目前,一些外用药物的评价试验也未能证明可有效预防和治疗放射性皮肤损伤[3]。已有研究表明,放射性皮肤损伤与细胞早衰、细胞凋亡等存在相关性[4]。为了阐明细胞早衰在放射性皮肤损伤中发挥的作用及机制,本文对放射性皮肤损伤现状、电离辐射诱导的细胞早衰研究进展及细胞早衰在放射性皮肤损伤伤口愈合中的作用进行综述。
一、放射性皮肤损伤现状皮肤对电离辐射较为敏感,皮肤受到电离辐射会发生急性或慢性生物效应[5],即造成放射性皮肤损伤。放射性皮肤损伤是辐射诱导的各种炎症因子引起的基底层干细胞和祖细胞的损失以及血管的损伤。根据损伤出现时间的长短,放射性皮肤损伤可分为急性放射性皮肤损伤和慢性放射性皮肤损伤。急性放射性皮肤损伤的症状有干性脱屑、湿润脱屑、皮肤坏死、溃疡以及出血[6];慢性放射性皮肤损伤的症状有慢性溃疡、放射性角化病、毛细血管扩张、纤维化以及皮肤癌[7]。
当辐射伴随其他任何形式的创伤(烧伤、手术创伤等)时,会发生放射损伤复合创伤,即放创复合伤。其主要特征包括休克,往往成为早期死亡的主要原因;造血和免疫系统受到明显抑制,影响预后;严重的胃肠损害导致吸收和分泌功能障碍,增加感染风险;伤口愈合延迟[8]。由于同时存在创伤和放射损伤,两方面损伤相互影响,延迟并加剧皮肤细胞凋亡和炎症反应及增加组织坏死[9],从而导致损伤部位愈合延迟或经久不愈。目前,放创复合伤的治疗方法涉及预防和恢复辐射导致的细胞损伤和凋亡,调节早期炎症反应,诱导巨噬细胞分化,纠正生长因子和细胞外基质调节失衡促进创面愈合等[10]。上述治疗方法的具体作用靶点未完全明确,针对损伤部位难愈机制来改进现有疗法或提出新的治疗方式尤为重要。
1. 皮肤细胞早衰与放射性皮肤损伤的关系:放射性皮肤损伤的机制近年来已成为国内外学者研究的热点。细胞衰老(cellular senescence)是指细胞在各种应激(包括端粒缩短、DNA损伤或致癌应激等)条件下发生的不可逆和持续的细胞周期停滞[11]。一般分为由端粒缩短引起的复制性衰老(replicative senescence)和各种应激诱导的细胞早衰(premature senescence)。这些类型的衰老具有共同的衰老相关分泌表型(senescence-associated secretory phenotype, SASP)[12]。细胞早衰是指由于DNA损伤或其他应激而发生增殖能力和生理功能下降,细胞形态和功能发生变化,提前出现退行性改变[13]。
辐射可引起细胞周期阻滞,从而影响细胞周期的进程,进而导致细胞早衰[14],持续的DNA损伤和衰老细胞的积累与放射性皮肤损伤的发展有关[15]。McCart等[4]的研究发现,小鼠受到17 Gy X射线照射后,皮肤出现干性脱屑、红斑和轻度溃疡,同时,17.9 Gy X射线照射小鼠胸部皮肤后,p21WAF1表达增加。Wang等[15]研究发现,p62-Keap1-NRF2通路发热激活可抑制放射性溃疡中的细胞早衰的发生。虫草素通过直接与AMP依赖性蛋白激酶(AMP-activated protein kinase,AMPK)的α1和γ1亚基结合而激活AMPK通路,促进依赖于p62的Keap1自噬性降解,因此,NRF2从Keap1解离后移至细胞核,并激活抗氧化基因的转录,最终抑制放射性溃疡中细胞早衰的发生。Wang等[16]研究证明,在放射性溃疡发生时,衰老相关蛋白p16表达增加,达沙替尼联合槲皮素(DQ)可通过清除衰老细胞从而减轻放射性溃疡程度,提示细胞早衰在放射性溃疡的发展中发挥重要作用。Park等[17]研究发现,zileuton可通过抑制5-脂氧合酶(5-LO)阻止衰老细胞中SASP的表达,有效减轻辐射诱导的皮肤溃疡症状。40 Gy X射线照射真皮成纤维细胞和皮肤组织后5-LO表达增加,5-LO可通过抑制p38磷酸化调控SASP的发生,从而影响细胞衰老水平。
2. 辐射诱导细胞早衰信号通路:电离辐射可诱导细胞早衰的发生[18],目前已知的辐射诱导细胞早衰涉及的信号通路主要有3条,见图 1。
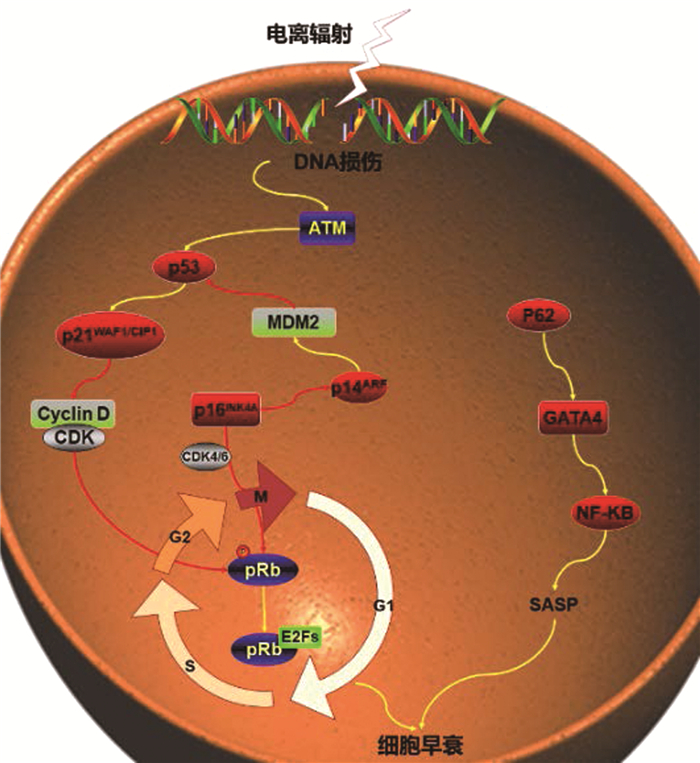
|
图 1 细胞早衰相关信号通路 Figure 1 Signal pathways related to premature cellular senescence |
(1) p53/p21WAF1/CIP1早衰信号通路:电离辐射可引起细胞发生持续性DNA损伤反应(DDR),毛细血管扩张性共济失调突变激酶(ataxia telangiectasia-mutated kinase, ATM)被招募到损伤部位,导致肿瘤抑制蛋白p53的积累,p53启动细胞周期依赖性激酶抑制剂(CDKi)p21WAF1/CIP1的转录。p21WAF1/CIP1通过抑制细胞周期细胞周期蛋白依赖性激酶(cyclin-CDK)复合物的激酶活性,进而抑制视母细胞肿瘤抑制蛋白(Rb)的磷酸化;并随后与E2Fs结合,形成Dream复合物,从而导致细胞周期阻滞,引起细胞早衰[19]。p21WAF1/CIP1主要诱导细胞早衰的发生[20-21],维持细胞早衰状态则依赖于P16INK4A。
(2) p16INK4A/pRB早衰信号通路:INK4/ARF位点编码3种肿瘤抑制基因,即由CDKN2A基因编码的p16INK4A和p14ARF以及由CDKN2B基因编码的p15INK4B[22]。其中,p16INK4A在调控衰老过程中的细胞周期阻滞发挥关键作用,p16INK4A可抑制CDK416介导的RB磷酸化,从而阻断细胞周期进程;同时p16INK4A还负调控p14ARF的表达。p14ARF通过与鼠双微体2(murine double minute 2, MDM2)结合,抑制p53的降解,从而将p53和p-RB信号通路相关联起来[23]。p-RB是cyclin-CDK复合物的主要靶点之一,其主要功能是与E2F复合物结合后使其失活,从而抑制E2F靶基因的转录。去磷酸化后的RB与E2Fs结合,形成Rb-E2F复合物,与E2F靶基因的启动子区域结合,抑制细胞周期进展所需基因的转录,导致细胞早衰的发生[24]。
(3) p62介导的早衰信号通路:衰老细胞可通过SASP改变周围细胞的微环境从而诱导细胞早衰的发生[25]。SASP的发生受多种信号通路的调控,如GATA4/p62介导的自噬、p38MAPK、JAK2/STAT3、炎症小体、mTOR、磷酸肌醇-3-激酶(PI3K)通路、HSP90、非编码RNAs、macroH2A1和ATM等[26]。其中,p62/SQSTM1(sequestosome-1,SQSTM1)又称自噬衔接子蛋白,是一种泛素结合蛋白,在细胞自噬和细胞早衰中都起着调节作用[27]。在正常细胞中,与p62结合的GATA结合蛋白4(GATA-binding protein 4, GATA4)通过选择性自噬被降解,而DNA损伤细胞中的自噬受到抑制,从而使GATA-4积累,积累的GATA-4通过激活核转录因子(nuclear factor-kappa B, NF-κB)诱导SASP的发生。因此,GATA4通过独立于p53和p16INK4A的衰老途径诱导SASP的发生,引起细胞早衰[28]。p62还可以调节Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein-1, Keap1)自噬的发生,通过p62-Keap1-NRF2通路调节细胞抗氧化应激活性,从而影响辐射诱导的细胞早衰的发生[15]。同时,电离辐射可通过p38丝裂原活化蛋白激酶(p38 MAPK)和NF-κB的激活,调节SASP因子并影响周围未照射细胞[11],并进一步诱导细胞发生早衰。
衰老细胞的存在会对胚胎发育、器官形成、组织衰老和再生、炎症、伤口愈合和肿瘤抑制产生影响[20, 29]。值得一提的是,越来越多的证据表明细胞早衰会影响伤口愈合。皮肤受照后可产生炎症反应,引起白细胞介素-1(interleukin-1, IL-1)表达增加,进而导致基质金属蛋白酶(matrix metalloproteinases, MMPs)表达水平增加[30]。MMPs和不同的生长因子如血管内皮生长因子(vascular endothelial growth factor, VEGF)、血小板衍生生长因子A(platelet-derived growth factor A, PDGF-A)存在于愈合组织中,表明衰老细胞参与组织修复和伤口愈合过程[31]。细胞衰老的短暂存在可促进组织再生和伤口愈合,长期存在的细胞衰老会引起组织老化,抑制慢性伤口的愈合[32]。目前,皮肤细胞早衰如何影响放射性皮肤损伤伤口愈合过程尚不完全清楚。
二、皮肤细胞早衰与放射性皮肤损伤伤口愈合的关系研究进展正常的伤口愈合过程分止血、炎症、成纤维细胞增殖并迁移到受伤部位、细胞外基质重塑这4个阶段。而在放射性皮肤损伤等慢性伤口中,伤口愈合过程会停滞在炎症阶段,反复发炎[33]。通常为了应对组织损伤,成纤维细胞分化为肌成纤维细胞,协调正常组织修复,包括细胞外基质蛋白的合成、沉积和收缩,从而促使伤口闭合[34]。受照后的成纤维细胞和皮肤组织中发生细胞早衰且SASP表达增加[17],成纤维细胞发生早衰后其功能受到影响,包括细胞数量的减少及迁移和增殖能力的降低[35],影响伤口愈合进展。
1. 短暂诱导的细胞早衰促进伤口愈合:研究表明,细胞衰老在伤口愈合的增殖阶段在肉芽组织中被短暂诱导,并在发展到重塑阶段之前被有效去除[36]。同时也有研究表明,在皮肤损伤小鼠模型中,清除衰老细胞会导致肉芽组织形成不良,肌成纤维细胞数量急剧减少,从而引起伤口闭合延迟[31, 37]。因此,衰老细胞的短暂存在可促进皮肤伤口愈合进程。
研究发现在伤口愈合阶段细胞早衰可抑制纤维化的发生[38]。在肝脏和皮肤等不同器官中,增殖并产生细胞外基质的肌成纤维细胞被诱导发生早衰,其增殖受到抑制并表现出衰老细胞的基质降解表型。基质信号蛋白(cellular communication network factor 1 CCN1)激活DDR及p53,产生活性氧,进而激活p16INK4a/pRb通路,从而导致细胞早衰并抑制纤维化的发生。因此,成纤维细胞早衰是皮肤损伤伤口愈合中的一种反应,其功能是在组织修复过程中限制纤维化的发生。
Chia等[39]研究发现,p21和p53在年轻健康受试者的伤口愈合过程中表达显著增加。Hou和Kim[40]发现人参皂苷Rb1可通过激活p38MAPK/MSK2/NF-κB通路促进SASP介导的伤口愈合过程。p38MAPK下游的靶蛋白丝裂原和应激活化蛋白激酶1(MSK1)和2 (MSK2)可磷酸化NF-κB p65亚基的Ser276位点,从而在氧化应激刺激下激活NF-κB,诱导SASP的发生。SASP增加生长因子的分泌,刺激角质形成细胞的迁移和肌成纤维细胞向成纤维细胞的转化,促进伤口愈合。
放射性皮肤损伤的伤口愈合过程中,可能衰老细胞的短暂存在促进了伤口愈合并限制纤维化。且衰老细胞在发挥限制纤维化及促进伤口愈合作用后需及时去除。
2. 持续的细胞早衰减缓伤口愈合进程:放射性皮肤损伤的伤口愈合不良形成慢性伤口,且伤口区域往往有持续存在的衰老细胞[41]。慢性伤口愈合时各阶段无法正常推进,积累的衰老细胞会抑制细胞增殖并扰乱旁分泌信号级联反应,从而延缓伤口愈合。
Akt也称蛋白激酶B(protein kinase B, PKB),是一种丝氨酸/苏氨酸激酶,在肿瘤发生和代谢、细胞凋亡和细胞自噬过程中起重要作用。哺乳动物雷帕霉素靶标(mTOR)是Akt发挥致癌功能时的关键下游因子,可调控细胞存活和增殖。辐射等应激因素可激活p53以及下游的p21,p21负调控Akt/mTOR通路并抑制MDM2、cyclin D的表达,从而诱导细胞早衰的发生,延缓伤口愈合过程[42]。而PI3K/Akt/mTOR通路的激活可抑制成纤维细胞衰老的发生,加速伤口愈合[43]。Cao等[44]研究发现,基质细胞衍生因子1α(Stromal cell-derived factor-1, SDF-1α)与其受体C-X-C型趋化因子受体4(C-X-C motif chemokine receptor 4, CXCR4)结合后可调控急性放射性皮肤损伤和纤维化的多个相关信号通路,可通过PI3K-MAPK信号通路促进Smad2介导的纤维化。
综上所述,电离辐射诱导DNA损伤和皮肤细胞发生早衰,DNA损伤和衰老细胞在放射性皮肤损伤中持续存在,促进放射性皮肤损伤的进程。因此,抑制细胞早衰或者清除衰老细胞可能是减轻放射性皮肤损伤的有效治疗策略。细胞早衰在放射性皮肤损伤伤口愈合过程中发挥重要作用。短暂诱导的细胞衰老可促进放射性皮肤损伤的伤口愈合,在伤口愈合的增殖阶段,衰老细胞被短暂诱导,到重塑阶段被有效去除,从而发挥其促进伤口愈合的作用;肌成纤维细胞的衰老可阻止其过度增殖,限制纤维化的发生。而衰老成纤维细胞的积累,导致伤口呈慢性伤口并进入持续的炎症阶段而难以愈合。越来越多的研究表明,细胞早衰在放射性皮肤损伤等慢性伤口的发生中发挥作用,通过控制细胞早衰可达到促进伤口愈合的目的。目前,预防或减轻放射性皮肤损伤的有效治疗方法仍未建立,进一步阐明细胞早衰在放射性皮肤损伤及伤口愈合中的作用,对放射性皮肤损伤治疗具有重要理论指导意义。
利益冲突 全体作者按以下贡献声明独立撰写,未接受有关公司的任何赞助,不涉及各相关方的利益冲突
作者贡献声明 陈婕负责综述撰写;田梅、高玲负责思路指导、综述审阅和修改
| [1] |
Burnett LR, Hughes RT, Rejeski AF, et al. Review of the terminology describing ionizing radiation-induced skin injury: a case for standardization[J]. Technol Cancer Res Treat, 2021, 20: 2091185727. DOI:10.1177/15330338211039681 |
| [2] |
Yang X, Ren H, Guo X, et al. Radiation-induced skin injury: pathogenesis, treatment, and management[J]. Aging (Albany NY), 2020, 12(22): 23379-23393. DOI:10.18632/aging.103932 |
| [3] |
Singh M, Alavi A, Wong R, et al. Radiodermatitis: a review of our current understanding[J]. Am J Clin Dermatol, 2016, 17(3): 277-292. DOI:10.1007/s40257-016-0186-4 |
| [4] |
McCart EA, Thangapazham RL, Lombardini ED, et al. Accelerated senescence in skin in a murine model of radiation-induced multi-organ injury[J]. J Radiat Res, 2017, 58(5): 636-646. DOI:10.1093/jrr/rrx008 |
| [5] |
Soriano JL, Calpena AC, Souto EB, et al. Therapy for prevention and treatment of skin ionizing radiation damage: a review[J]. Int J Radiat Biol, 2019, 95(5): 537-553. DOI:10.1080/09553002.2019.1562254 |
| [6] |
Hymes SR, Strom EA, Fife C. Radiation dermatitis: clinical presentation, pathophysiology, and treatment 2006[J]. J Am Acad Dermatol, 2006, 54(1): 28-46. DOI:10.1016/j.jaad.2005.08.054 |
| [7] |
Martin MT, Vulin A, Hendry JH. Human epidermal stem cells: role in adverse skin reactions and carcinogenesis from radiation[J]. Mutat Res Rev Mutat Res, 2016, 770(Pt B): 349-368. DOI:10.1016/j.mrrev.2016.08.004 |
| [8] |
Ran XZ, Shi CM, Zheng HE, et al. Experimental research on the management of combined radiation-burn injury in China[J]. Radiat Res, 2011, 175(3): 382-389. DOI:10.1667/RR2198.1 |
| [9] |
Jadhav SS, Meeks CJ, Mordwinkin NM, et al. Effect of combined radiation injury on cell death and inflammation in skin[J]. Apoptosis, 2015, 20(7): 892-906. DOI:10.1007/s10495-015-1116-2 |
| [10] |
冉永红, 高继宁, 卢丙慧, 等. 放创复合伤创面难愈机制及治疗的研究进展[J]. 中华放射医学与防护杂志, 2018, 38(11): 874-880. Ran YH, Gao JN, Lu BH, et al. Research progresses in the mechanism and treatment of the impaired wound healing of combined radiation-trauma injury[J]. Chin J Radiol Med Prot, 2018, 38(11): 874-880. DOI:10.3760/cma.j.issn.0254-5098.2018.11.015 |
| [11] |
Li M, You L, Xue J, et al. Ionizing radiation-induced cellular senescence in normal, non-transformed cells and the involved DNA damage response: a mini review[J]. Front Pharmacol, 2018, 9: 522. DOI:10.3389/fphar.2018.00522 |
| [12] |
Mohamad KN, Safuan S, Shamsuddin S, et al. Aging of the cells: Insight into cellular senescence and detection methods[J]. Eur J Cell Biol, 2020, 99(6): 151108. DOI:10.1016/j.ejcb.2020.151108 |
| [13] |
何艳, 刘静. 细胞衰老及其在抗肿瘤研究中的应用[J]. 生命科学, 2010, 22(5): 411-415. He Y, Liu J. Cell senescence and its critical role in antitumor research[J]. Chin Bull Life Sci, 2010, 22(5): 411-415. DOI:10.13376/j.cbls/2010.05.003 |
| [14] |
Quaas M, Muller GA, Engeland K. p53 can repress transcription of cell cycle genes through a p21(WAF1/CIP1)-dependent switch from MMB to DREAM protein complex binding at CHR promoter elements[J]. Cell Cycle, 2012, 11(24): 4661-4672. DOI:10.4161/cc.22917 |
| [15] |
Wang Z, Chen Z, Jiang Z, et al. Cordycepin prevents radiation ulcer by inhibiting cell senescence via NRF2 and AMPK in rodents[J]. Nat Commun, 2019, 10(1): 2538. DOI:10.1038/s41467-019-10386-8 |
| [16] |
Wang H, Wang Z, Huang Y, et al. Senolytics (DQ) mitigates radiation ulcers by removing senescent cells[J]. Front Oncol, 2019, 9: 1576. DOI:10.3389/fonc.2019.01576 |
| [17] |
Park M, Na J, Kwak SY, et al. Zileuton alleviates radiation-induced cutaneous ulcers via inhibition of senescence-associated secretory phenotype in rodents[J]. Int J Mol Sci, 2022, 23(15): 8390. DOI:10.3390/ijms23158390 |
| [18] |
Chen Z, Cao K, Xia Y, et al. Cellular senescence in ionizing radiation (Review)[J]. Oncol Rep, 2019, 42(3): 883-894. DOI:10.3892/or.2019.7209 |
| [19] |
Whittaker SR, Mallinger A, Workman P, et al. Inhibitors of cyclin-dependent kinases as cancer therapeutics[J]. Pharmacol Ther, 2017, 173: 83-105. DOI:10.1016/j.pharmthera.2017.02.008 |
| [20] |
He S, Sharpless NE. Senescence in health and disease[J]. Cell, 2017, 169(6): 1000-1011. DOI:10.1016/j.cell.2017.05.015 |
| [21] |
Song S, Lam EW, Tchkonia T, et al. Senescent cells: emerging targets for human aging and age-related diseases[J]. Trends Biochem Sci, 2020, 45(7): 578-592. DOI:10.1016/j.tibs.2020.03.008 |
| [22] |
Gil J, Peters G. Regulation of the INK4b-ARF-INK4a tumour suppressor locus: all for one or one for all[J]. Nat Rev Mol Cell Biol, 2006, 7(9): 667-677. DOI:10.1038/nrm1987 |
| [23] |
Rayess H, Wang MB, Srivatsan ES. Cellular senescence and tumor suppressor gene p16[J]. Int J Cancer, 2012, 130(8): 1715-1725. DOI:10.1002/ijc.27316 |
| [24] |
Fischer M, Muller GA. Cell cycle transcription control: DREAM/MuvB and RB-E2F complexes[J]. Crit Rev Biochem Mol Biol, 2017, 52(6): 638-662. DOI:10.1080/10409238.2017.1360836 |
| [25] |
Nelson G, Wordsworth J, Wang C, et al. A senescent cell bystander effect: senescence-induced senescence[J]. Aging Cell, 2012, 11(2): 345-349. DOI:10.1111/j.1474-9726.2012.00795.x |
| [26] |
Kumari R, Jat P. Mechanisms of cellular senescence: cell cycle arrest and senescence associated secretory phenotype[J]. Front Cell Dev Biol, 2021, 9: 645593. DOI:10.3389/fcell.2021.645593 |
| [27] |
马丽萍, 刘青杰, 田梅, 等. 辐射诱导p62/SQSTM1介导的细胞早衰研究进展[J]. 中华放射医学与防护杂志, 2020, 40(12): 968-972. Ma LP, Liu QJ, Tian M, et al. The research progress on radiation-induced and p62/SQSTM1-mediated premature cellular senescence[J]. Chin J Radiol Med Prot, 2020, 40(12): 968-972. DOI:10.3760/cma.j.issn.0254-5098.2020.12.013 |
| [28] |
Kang C, Xu Q, Martin TD, et al. The DNA damage response induces inflammation and senescence by inhibiting autophagy of GATA4[J]. Science, 2015, 349(6255): a5612. DOI:10.1126/science.aaa5612 |
| [29] |
Wang AS, Dreesen O. Biomarkers of cellular senescence and skin aging[J]. Front Genet, 2018, 9: 247. DOI:10.3389/fgene.2018.00247 |
| [30] |
Kim JH, Kolozsvary AJJ, Jenrow KA, et al. Mechanisms of radiation-induced skin injury and implications for future clinical trials[J]. Int J Radiat Biol, 2013, 89(5): 311-318. DOI:10.3109/09553002.2013.765055 |
| [31] |
Demaria M, Ohtani N, Youssef SA, et al. An essential role for senescent cells in optimal wound healing through secretion of PDGF-AA[J]. Dev Cell, 2014, 31(6): 722-733. DOI:10.1016/j.devcel.2014.11.012 |
| [32] |
Pils V, Ring N, Valdivieso K, et al. Promises and challenges of senolytics in skin regeneration, pathology and ageing[J]. Mech Ageing Dev, 2021, 200: 111588. DOI:10.1016/j.mad.2021.111588 |
| [33] |
Mirzadegan E, Golshahi H, Kazemnejad S. Current evidence on immunological and regenerative effects of menstrual blood stem cells seeded on scaffold consisting of amniotic membrane and silk fibroin in chronic wound[J]. Int Immunopharmacol, 2020, 85: 106595. DOI:10.1016/j.intimp.2020.106595 |
| [34] |
Merkt W, Zhou Y, Han H, et al. Myofibroblast fate plasticity in tissue repair and fibrosis: Deactivation, apoptosis, senescence and reprogramming[J]. Wound Repair Regen, 2021, 29(4): 678-691. DOI:10.1111/wrr.12952 |
| [35] |
Henderson EA. The potential effect of fibroblast senescence on wound healing and the chronic wound environment[J]. J Wound Care, 2006, 15(7): 315-318. DOI:10.12968/jowc.2006.15.7.26932 |
| [36] |
Demaria M, Desprez PY, Campisi J, et al. Cell autonomous and non-autonomous effects of senescent cells in the skin[J]. J Invest Dermatol, 2015, 135(7): 1722-1726. DOI:10.1038/jid.2015.108 |
| [37] |
Pils V, Terlecki-Zaniewicz L, Schosserer M, et al. The role of lipid-based signalling in wound healing and senescence[J]. Mech Ageing Dev, 2021, 198: 111527. DOI:10.1016/j.mad.2021.111527 |
| [38] |
Kim KH, Chen CC, Monzon RI, et al. Matricellular protein CCN1 promotes regression of liver fibrosis through induction of cellular senescence in hepatic myofibroblasts[J]. Mol Cell Biol, 2013, 33(10): 2078-2090. DOI:10.1128/MCB.00049-13 |
| [39] |
Chia CW, Sherman-Baust CA, Larson SA, et al. Age-associated expression of p21 and p53 during human wound healing[J]. Aging Cell, 2021, 20(5): e13354. DOI:10.1111/acel.13354 |
| [40] |
Hou J, Kim S. Possible role of ginsenoside Rb1 in skin wound healing via regulating senescent skin dermal fibroblast[J]. Biochem Biophys Res Commun, 2018, 499(2): 381-388. DOI:10.1016/j.bbrc.2018.03.170 |
| [41] |
Samdavid TR, Shvedova M, Shin GH, et al. Elevated skin senescence in young mice causes delayed wound healing[J]. Geroscience, 2022, 44(3): 1871-1878. DOI:10.1007/s11357-022-00551-1 |
| [42] |
Berlanga-Acosta J, Mendoza-Mari Y, Martinez MD, et al. Expression of cell proliferation cycle negative regulators in fibroblasts of an ischemic diabetic foot ulcer. A clinical case report[J]. Int Wound J, 2013, 10(2): 232-236. DOI:10.1111/j.1742-481X.2012.12000.x |
| [43] |
Wei F, Wang A, Wang Q, et al. Plasma endothelial cells-derived extracellular vesicles promote wound healing in diabetes through YAP and the PI3K/Akt/mTOR pathway[J]. Aging (Albany NY), 2020, 12(12): 12002-12018. DOI:10.18632/aging.103366 |
| [44] |
Cao J, Zhu W, Yu D, et al. The involvement of SDF-1α/CXCR4 axis in radiation-induced acute injury and fibrosis of skin[J]. Radiat Res, 2019, 192(4): 410-421. DOI:10.1667/RR15384.1 |
 2023, Vol. 43
2023, Vol. 43


