2. 贵州医科大学附属医院肿瘤科, 贵阳 550004
2. Department of Oncology, Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China
早期研究已经证实术后放化疗可以改善局部进展期直肠癌(locally advanced rectal cancer, LARC)患者的局部控制率和总生存率[1-2],但术前放化疗可以进一步改善患者局部控制率和病理完全缓解率(pathologic complete response,pCR)[3-5]。因此,术前放化疗已成为LARC的标准治疗模式。当直肠癌患者行新辅助同步放化疗(concurrent chemoradiotherapy, CCRT)时,骨盆骨髓不可避免地会受到一定剂量的照射,从而可能导致不同程度的急性血液学不良反应(hematologic toxicity, HT)。既往研究显示,在联合单药氟尿嘧啶的同步放化疗中,急性HT(中重度)发生率可达6%~20%[2-3, 6-7],联合更强化疗同步方案的放疗在获得更高的pCR率的同时,3~4级急性HT发生率可达25%~30%[6, 8]。频繁或严重的急性HT会增加感染风险和治疗费用,降低治疗耐受性,甚至影响疗效[9-10]。既往一系列研究表明,在盆腔放疗中,急性HT与骨盆骨髓(pelvic bone marrow,PBM)的剂量体积相关[11-16],但与急性HT相关的剂量体积却并不一致,且较少有针对直肠癌CCRT的研究。因此,进一步探索LARC中新辅助CCRT导致的急性HT与PBM剂量体积的真实关系,对控制急性HT尤为重要。本研究旨在探明LARC患者在接受新辅助CCRT时,PBM剂量体积与急性HT的关系,并确定有效的预测因子和阈值,为优化放疗计划及降低急性HT提供临床依据。
资料与方法1. 临床资料:回顾性收集2017年10月至2019年5月在贵州医科大学附属肿瘤医院接受新辅助CCRT治疗的46例LARC患者资料。入组标准:卡氏评分≥80;病理确诊为局部进展期直肠腺癌;无明显放疗禁忌。排除标准:既往接受过盆腔放疗;其他肿瘤病史。其中,2例治疗前白细胞低于正常值,3例因个人原因未完成CCRT,故最终41例患者纳入分析。
2. 治疗方案:放疗采用5野调强放疗(IMRT),使用6 MV X射线于俯卧位治疗(瑞典Elekta直线加速器)。所有靶区和危及器官(organs at risk,OARs)的勾画及OARs的剂量限制均根据美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)0822标准执行。所有患者放疗期间同步5-氟尿嘧啶(5-FU,225 mg/m2·d) 或卡培他滨(875 mg/m2,2次/d)化疗。
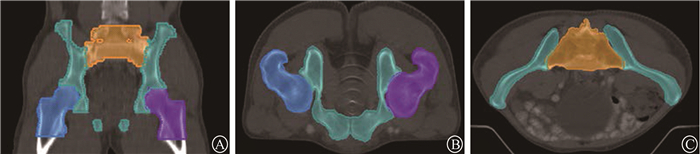
3. 骨髓区域勾画及剂量-体积参数:在Pinnecal 3.0系统的骨窗上勾画骨盆,勾画依据参考Yang等[9]的研究。将PBM分为3个解剖部位,如图 1所示:①髋骨骨髓(CBM):双侧髋骨、坐骨和耻骨的骨髓。②骶骨骨髓(SBM):从L5~S1接合处延伸至尾骨的骨髓。③股骨骨髓(FBM):双侧股骨头和股骨近端的骨髓。髋骨骨髓体积(coxal bone marrow volume,CV)、骶骨骨髓体积(sacrum bone marrow volume,SV)和股骨骨髓体积(femoral bone marrow volume,FV)从系统内的剂量体积直方图(DVH)获得。总骨盆骨髓体积(total pelvic bone marrow volume,TV)是三者的总和。至少接受x Gy照射的骨髓体积参数为Vx (V5、V10、V15、V20、V25、V30、V35、V40)。
|
注:橙色为骶骨;青色为髋骨;蓝色和紫色分别为右侧与左侧近端股骨 图 1 骶骨、髋骨以及股骨的勾画范围 A.骨盆冠状面示意图;B、C.骨盆横断面示意图 Figure 1 The delineation method of the patient′s pelvic region A. The schematic diagram of the pelvis coronal plane; B, C. The schematic diagram of the pelvis cross-section |
4. 血液学不良反应评估:患者治疗前的全血细胞计数均在正常范围内。在CCRT开始至放疗结束后3周,患者每周至少进行1次的全血细胞计数,记录包括白细胞(WBC)、中性粒细胞(ANC)、血红蛋白(HB)、血小板计数(PLT)中最严重的不良反应事件。急性HT通过美国国立癌症研究所通用不良反应标准5.0(National Cancer Institute common toxicity criteria version 5.0,NCI-CTC V5.0)进行评估分级。
5. 统计学处理:本研究的研究变量是患者全骨盆(TV)及不同骨盆区域(CV、SV、FV)剂量体积参数(Vx)。结局变量为≥2级的各类急性HT。相关的协变量包括患者年龄、性别、体质量指数(BMI)、cT分期、cN分期、同步化疗方案。采用单因素及多因素logistic回归分析不同剂量水平的骨髓受照体积与不同程度急性HT间的相关性。应用广义相加模型(GAM)和分段回归检测PBM剂量体积与各类急性HT间潜在的非线性关系和阈值效应。数据分析使用Epower 2.2(X&Y Solutions, 美国)完成。P<0.05为差异有统计学意义。
结果1. 一般资料:研究中发生≥2度白细胞降低、中性粒细胞降低、血红蛋白降低、血小板降低的患者数分别为12例、5例、7例、1例,占总研究人数百分比为29.3%、12.2%、17.1%、2.4%。相关研究变量在急性HT中的分布见表 1。发生≥2度白细胞降低的患者有12例,年龄均值53.8岁,BMI均值22.4 kg/m2,TV的均值为1 408 ml,性别分布在≥2度白细胞降低中差异有统计学意义(χ2=4.64, P<0.05),其余变量的分布差异均无统计学意义(P>0.05)。
|
|
表 1 研究相关变量在发生≥2度白细胞降低中的分布 Table 1 The distribution of related factors in Grade ≥2 leukopenia |
2. logistic回归分析:单因素及多因素logistic回归分析模型Ⅰ(协变量:年龄、性别、cT分期、cN分期、同期化疗方案)显示,所有剂量参数均与≥2度白细胞降低不相关(表 2~5)。模型Ⅱ(协变量:年龄、性别、cT分期、cN分期、同期化疗方案,相同剂量的SV)显示,骨盆骨髓的低剂量体积与≥2度白细胞减少(TV5、CV5、CV10)显著相关。在SV与急性HT的多因素logistic回归分析中,仅在模型Ⅱ(在协变量中增加相同剂量水平的CV)中,SV5、SV10与≥2度白细胞减少显著相关,且OR值均 < 1。FV与急性HT均未见到显著相关性。
|
|
表 2 总骨盆骨髓的受照剂量体积与≥2度白细胞降低的logistic回归分析 Table 2 Sensitivity analysis of ≥2 grade leukopenia related to each irradiated TV based on logistic regression |
|
|
表 3 髋骨骨髓的受照剂量-体积与≥2度白细胞降低的logistic回归分析 Table 3 Sensitivity analysis of ≥2 grade leukopenia related to each irradiated CV based on logistic regression |
|
|
表 4 骶骨骨髓的受照剂量体积与≥2度白细胞降低的logistic回归分析 Table 4 Sensitivity analysis of ≥2 grade leukopenia related to each irradiated SV based on logistic regression |
|
|
表 5 近端股骨骨髓的受照剂量体积与≥2度白细胞降低的logistic回归分析 Table 5 Sensitivity analysis of ≥2 grade leukopenia related to each irradiated FV based on logistic regression |
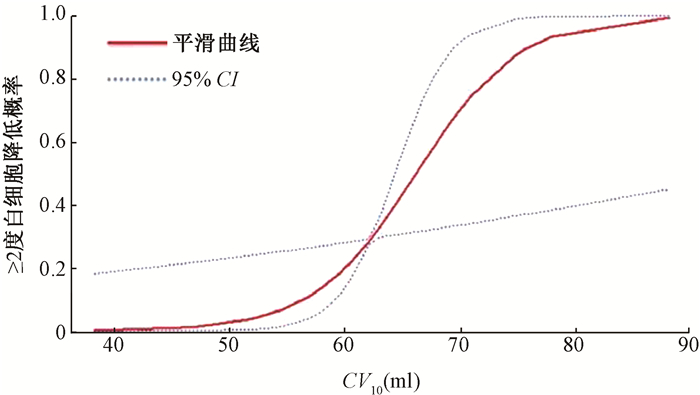
3. 非线性拟合及阈值效应分析:广义加性模型显示CV10与≥2度白细胞减少之间存在非线性关系(图 2)。本研究比较了logistic回归模型(CV10与≥2度白细胞减少的关系拟合为线性关系)和3段logistic回归模型(CV10与≥2度白细胞减少的关系拟合为曲线关系),对数似回归模型拟合。采用广义相加模型(GAM)和递归算法,得到≥2度白细胞减少的CV10的拐点为(575、702 ml),其中575 ml为CV10对应≥2度白细胞减少症的风险阈值。当CV10低于阈值时,未观察到与≥2度白细胞减少间的显著相关性,并且OR均接近于1;当CV10超过阈值时,≥2度白细胞减少的风险随着CV的增加而显著增加,OR(95%CI)为1.85(1.08,2.16)(表 6)。
|
注:CV10为接受≥10 Gy骨髓体积,体积单位为10 ml 图 2 基于广义加性模型(GAM)≥2度白细胞降低与髋骨骨髓剂量-体积之间的平滑曲线 Figure 2 The smooth curvefits between the ≥2 grade leukopenia and coxal volume base on generalized additive model (GAM) |
|
|
表 6 CV10与≥2度白细胞降低三分段线性回归结果及阈值效应分析 Table 6 Three piecewise linear regression of CV10 and ≥2 grade leukopenia |
4. 通过线性回归分析CV与SV的骨髓受照剂量体积,结果显示CV和SV在所有剂量体积上均存在显著的负的线性相关,如表 7所示。
|
|
表 7 同一剂量下髋骨骨髓及骶骨骨髓的受照剂量体积的线性回归分析 Table 7 Linear regression analysis of CV and SV at the same dose |
讨论
急性HT是LARC患者行CCRT时常见的不良反应,频繁或严重的急性HT可能会增加感染风险,甚至延误治疗,最终影响疗效[9-10]。近年来,为了获得更好的治疗反应和局部控制率,全程新辅助治疗(total neoadjuvant therapy,TNT)和联合更强化疗方案的新辅助同步放化疗逐渐成为局部进展期直肠癌术前治疗的新趋势[17-18]。然而在上述治疗模式中,由于与术前放疗同步或序贯的化疗强度增加,使得患者发生急性HT的风险也相应升高[6, 8, 19]。因此,尽可能降低放化疗期间血液学不良反应发生的风险有利于患者更好地完成术前新辅助治疗。本研究旨在探索盆腔照射时骨髓受照剂量体积与血液学不良反应的真实关系,尽可能地通过优化放疗计划降低盆腔放疗相关的血液学不良反应风险。
在本研究中,单因素及多因素logistic回归分析(模型Ⅰ)均未见到急性HT与骨髓剂量体积的显著相关性。然而,增加SV作为协变量进行调整后的多因素logistic分析显示,低剂量的TV或CV与不同的急性HT间存在不同程度的相关性。这与Huang等[11]在直肠癌及Mell等[14-15]在宫颈癌及肛管癌的研究结果相似,均认为骨盆骨髓的低剂量体积是导致急性HT的重要因素,但Yang等[9]的研究结果却认为骶骨的高剂量体积与急性HT相关,该结果的差异可能是由于研究中采用不同的放疗技术导致的。Yang等[9]的研究中采用3D-CRT技术进行放疗,相较于本研究采用的IMRT,3D-CRT的高剂量体积更大[20],同时这两种放疗技术间的靶区分布也存在一定差异,因此,急性HT的影响因素在这两种不同的放疗技术间可能不同,但具体的原因还有待进一步探索。相较于IMRT和3D-CRT技术,新一代放疗技术(VMAT、TOMO)在有效降低靶区外的高剂量体积的同时却会增加盆骨骨髓的低剂量体积[20-21],所以上述研究结果提示临床医生应该更关注采用新一代技术进行盆腔放疗患者的低剂量盆腔骨髓受照体积的控制。
与既往研究不同的是,本研究第一次将相应的SV作为协变量纳入骨髓受照体积与急性HT之间的多因素logistic回归分析中。原因是当总骨盆骨髓拆分为3部分(髋骨骨髓、骶骨骨髓、股骨骨髓)并分别分析它们与急性HT的相关性时,发现CV是急性HT的危险因素,其OR值普遍>1,而SV的OR值均<1。这说明CV和SV对急性HT的作用是截然不同的,且可能存在相互影响。通过线性回归分析CV和SV的关系,结果显示CV和SV存在显著的负线性相关。通过对不同角度射野的剂量及权重分析,很好地解释了这一结果,在靶区处方剂量恒定的条件下,经过骶骨的后方射野(以0°射野为主)与经过髋骨的两侧方射野的剂量为负相关,而髋骨骨髓的造血功能显著强于骶骨骨髓[22],所以当骶骨骨髓承担更多的剂量照射时(0°射野剂量权重更大时),髋骨骨髓承担的受照剂量就会相应减少,从而使得骨盆骨髓总体的造血功能得到更好的保护。所以在分析CV与急性HT的相关性时,将对应的SV作为协变量进行调整可以更真实地体现CV与急性HT间的关系。
Huang等[11]及Mell等[14-15]在分析IMRT中急性HT相关骨盆骨髓剂量体积参数时,都仅对全骨盆骨髓进行分析,而Yang等[9]的研究也未对不同部位骨盆骨髓在急性HT的作用进行多因素分析。本研究基于对组成TV的3部分骨髓(髋骨、骶骨、股骨)与急性HT进行多因素logistic回归分析,结果显示低剂量水平的CV(CV5,CV10)与急性HT的风险显著相关,是急性HT的危险因素;而低剂量水平SV(SV5,SV10)与急性HT为负相关,FV则与急性HT无显著相关性。说明CV是骨盆骨髓中导致急性HT的决定性因素。根据上述分析结果,相较于TV,CV是预测急性HT风险更好的指标。
为了提高本研究的临床价值,应用广义相加模型和分段回归对CV与急性HT之间可能存在的非线性关系和阈值效应进行进一步分析。广义相加模型显示,CV10与≥2度的白细胞减少存在非线性关系。在3部分logistic回归分析中,由于对数似然比P<0.05,可以确认CV10与≥2度白细胞减少间存在阈值效应,在CV10小于阈值575 ml时,没有观察到CV10与≥2度白细胞减少的显著相关性,然而当CV10超过阈值后,CV的增加将显著增加≥2度白细胞减少的风险。基于上述结果,在对直肠癌新辅助调强放疗计划进行优化时,为了有效降低≥2白细胞急性HT的风险,同时又能充分利用正常组织受量,认为采用V10的阈值575 ml作为计划优化的参考值较为合理。但由于本研究样本量较小,同时地区和人群差异也可能会对阈值产生影响。
在直肠癌新辅助IMRT放疗中,较TV而言,CV是预测急性HT的更优指标。与急性HT相关的CV主要集中在低剂量水平(CV5、CV10)。本研究中的阈值(CV10=575 ml)可为直肠癌盆腔放疗中降低急性HT风险提供放疗计划优化的参考。
利益冲突 本研究由署名作者按以下贡献声明独立开展,未因进行该研究接收任何不正当的职务或财务利益,对研究的独立性和科学性予以保证
作者贡献声明 黄思成、王刚提出研究思路、设计研究方案、研究实施及论文撰写;董洪敏、陈唯唯、李小凯、陈望花、李国栋、李蕾蕾、陈娟负责收集临床数据、靶区勾画;王文玲参与论文讨论及修改
| [1] |
Gastrointestinal Tumor Study Group. A controlled trial of adjuvant chemotherapy, radiation therapy or combined chemo-radiation therapy following curative resection for rectal carcinoma[J]. N Engl J Med, 1985, 312(23): 1465-1472. |
| [2] |
Krook JE, Moertel CG. Effective surgical adjuvant therapy for high-risk rectal carcinoma[J]. New Engl J Med, 1991, 324(11): 709-715. DOI:10.1056/NEJM199103143241101 |
| [3] |
Sauer R, Becker H, Hohenberger W. Preoperative versus postoperative CRT for rectal cancer[J]. N Engl J Med, 2004, 351(17): 1731-1740. DOI:10.1056/NEJMoa040694 |
| [4] |
Sauer R, Liersch T, Merkel S, et al. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase Ⅲ trial after a median follow-up of 11 years[J]. J Clin Oncol, 2012, 30(16): 1926-1933. DOI:10.1200/JCO.2011.40.1836 |
| [5] |
Gérard JP, Conroy T, Bonnetain F, et al. Preoperative radiotherapy with or without concurrent fluorouracil and leucovorin in T3-4 rectal cancers: results of FFCD 9203[J]. J Clin Oncol, 2006, 24(28): 4620-4625. DOI:10.1200/JCO.2006.06.7629 |
| [6] |
Deng Y, Chi P, Lan P, et al. Modified FOLFOX6 with or without radiation versus fluorouracil and leucovorin with radiation in neoadjuvant treatment of locally advanced rectal cancer: initial results of the Chinese FOWARC multicenter, open-label, randomized three-arm phase Ⅲ trial[J]. J Clin Oncol, 2016, 34(27): 3300-3307. DOI:10.1200/JCO.2016.66.6198 |
| [7] |
Wan J, Liu K, Li K, et al. Can dosimetric parameters predict acute hematologic toxicity in rectal cancer patients treated with intensity-modulated pelvic radiotherapy?[J]. Radiat Oncol, 2015, 10(1): 1-7. DOI:10.1186/s13014-015-0454-0 |
| [8] |
Zhu J, Liu A, Sun X, et al. Multicenter, randomized, phase Ⅲ trial of neoadjuvant chemoradiation with capecitabine and irinotecan guided by UGT1A1 status in patients with locally advanced rectal cancer[J]. J Clin Oncol, 2020, 38(36): 4231. DOI:10.1200/JCO.20.01932 |
| [9] |
Yang TJ, Oh JH, Apte A, et al. Clinical and dosimetric predictors of acute hematologic toxicity in rectal cancer patients undergoing chemoradiotherapy[J]. Radiother Oncol, 2014, 113(1): 29-34. DOI:10.1016/j.radonc.2014.09.002 |
| [10] |
Wang JY, Tian Y, Tang Y, et al. A prospective phase Ⅱ study of magnetic resonance imaging guided hematopoietical bone marrow-sparing intensity-modulated radiotherapy with concurrent chemotherapy for rectal cancer[J]. Radiol Med, 2016, 121(4): 308-314. DOI:10.1007/s11547-015-0605-2 |
| [11] |
Huang W, Dang J, Li Y, et al. Effect of pelvic bone marrow sparing intensity modulated radiation therapy on acute hematologic toxicity in rectal cancer patients undergoing chemo-radiotherapy[J]. Front Oncol, 2021, 11: 646211. DOI:10.3389/fonc.2021.646211 |
| [12] |
Albuquerque K, Giangreco D, Morrison C, et al. Radiation-related predictors of hematologic toxicity after concurrent chemoradiation for cervical cancer and implications for bone marrow-sparing pelvic IMRT[J]. Int J Radiat Oncol Biol Phys, 2011, 79(4): 1043-1047. DOI:10.1016/j.ijrobp.2009.12.025 |
| [13] |
Cheng JC, Bazan JG, Wu JK, et al. Lumbosacral spine and marrow cavity modeling of acute hematologic toxicity in patients treated with intensity modulated radiation therapy for squamous cell carcinoma of the anal canal[J]. Pract Radiat Oncol, 2014, 4(3): 198-206. DOI:10.1016/j.prro.2013.07.011 |
| [14] |
Mell LK, Kochanski JD, Roeske JC, et al. Dosimetric predictors of acute hematologic toxicity in cervical cancer patients treated with concurrent cisplatin and intensity-modulated pelvic radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2006, 66(5): 1356-1365. DOI:10.1016/j.ijrobp.2006.03.018 |
| [15] |
Mell LK, Schomas DA, Salama JK, et al. Association between bone marrow dosimetric parameters and acute hematologic toxicity in anal cancer patients treated with concurrent chemotherapy and intensity-modulated radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2008, 70(5): 1431-1437. DOI:10.1016/j.ijrobp.2007.08.074 |
| [16] |
Kuntz L, Noel G. Pelvic irradiation nd hematopoietic toxicity: A review of the literature[J]. Cancer Radiother, 2021, 25(1): 77-91. DOI:10.1016/j.canrad.2020.05.018 |
| [17] |
Cercek A, Roxburgh CS, Strombom P, et al. Adoption of total neoadjuvant therapy for locally advanced rectal cancer[J]. JAMA Oncol, 2018, 4(6): e180071. DOI:10.1001/jamaoncol.2018.0071 |
| [18] |
Giunta EF, Bregni G, Pretta A, et al. Total neoadjuvant therapy for rectal cancer: Making sense of the results from the RAPIDO and PRODIGE 23 trials[J]. Cancer Treat Rev, 2021, 96: 102177. DOI:10.1016/j.ctrv.2021.102177 |
| [19] |
Wang X, Yu Y, Meng W, et al. Total neoadjuvant treatment (CAPOX plus radiotherapy) for patients with locally advanced rectal cancer with high risk factors: A phase 2 trial[J]. Radiother Oncol, 2018, 129(2): 300-305. DOI:10.1016/j.radonc.2018.08.027 |
| [20] |
Yu CY, Yang ZY, Li GL, et al. Correlations between radiation dose in bone marrow and hematological toxicity in patients with cervical cancer: a comparison of 3DCRT, IMRT, and RapidARC[J]. Int J Gynecol Cancer, 2016, 26(4): 770-776. DOI:10.1097/IGC.0000000000000660 |
| [21] |
Kumar T, Schernberg A, Busato F, et al. Correlation between pelvic bone marrow radiation dose and acute hematological toxicity in cervical cancer patients treated with concurrent chemoradiation[J]. Cancer Manag Res, 2019, 11: 6285. DOI:10.2147/CMAR.S195989 |
| [22] |
Russell WJ, Yoshinaga H, Antoku S, et al. Active bone marrow distribution in the adult[J]. Br J Radiol, 1966, 39(466): 735-738. DOI:10.1259/0007-1285-39-466-735 |
 2023, Vol. 43
2023, Vol. 43


