2. 郑州大学附属肿瘤医院 河南省PET-CT中心, 郑州 450008
2. PET/CT Center of Henan Province, Affiliated Cancer Hospital of Zhengzhou University, Henan Cancer Hospital, Zhengzhou 450008, China
肺癌是全球死亡率最高的恶性肿瘤,非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总数的85%[1-2]。在临床工作中,仅有少数NSCLC患者在早期就诊,大多数患者一经确诊即为局部晚期或转移性疾病,因此5年生存率低至4%~17%[3-4]。近年来,免疫检查点抑制剂(immune checkpoint inhibitor,ICI)开启了肿瘤治疗新时代,但在不区分NSCLC人群的情况下,ICI治疗的客观缓解率仅为19.4%[5],甚至可能会使4%~29%的患者经历疾病超进展的有害现象,其特征是肿瘤扩展迅速增加,临床结果较差[6-7]。目前,程序性死亡配体1(programmed death-ligand 1, PD-L1)表达是接受ICI治疗的NSCLC患者应用最广泛的预测性生物标志物。然而,尽管多项研究表明,PD-L1高表达(>50%)可以预测ICI治疗的反应性[8-9],但目前已经观察到ICI治疗的临床益处可能与PD-L1表达无关[10]。因此,预测ICI疗效的有效生物标志物仍在探索。氟-18-氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)正电子发射计算机断层扫描(positron emission computed tomography/computed tomography,PET/CT)是一种功能性分子成像方式,常用于评估癌症患者疾病分期及治疗反应。PET/CT代谢参数可以通过反映肿瘤生物学行为更加客观地判断肿瘤负荷,对指导治疗及预测预后更具优势[11]。多项研究显示,在接受化疗[12]、放疗[13]、靶向治疗[14]、ICI治疗[15]或不区分治疗方式[16]的NSCLC患者中,肿瘤代谢体积(metabolic tumor volume,MTV)或糖酵解总量(total lesion glycolysis,TLG)被认为是比最大标准摄取值(maximum standard uptake value,SUVmax)更有意义的预后因素。本研究侧重于探讨PET/CT代谢参数在接受一线ICI治疗联合化疗的晚期NSCLC患者中的预后关系。
资料与方法1. 临床资料:回顾分析2019年1月至2021年9月在郑州大学附属肿瘤医院病理明确的44例的非小细胞肺癌患者。根据美国癌症联合委员会(AJCC)第8版,所有入组患者的临床分期为Ⅳ期[17]。所有患者均行一线ICI治疗联合化疗,治疗前12周内接受基线18F-FDG PET/CT检查,治疗前28 d内接受血液学检查。
2. 排除标准:合并其他肿瘤者;接受基线PET/CT后与首次ICI治疗间隔时间>12周者;随访资料不完整者。
3. 治疗方案:一线ICI治疗联合化疗。化疗方案为铂类联合紫杉醇、多西他赛或培美曲塞,ICI治疗药物包括替雷利珠单抗、卡瑞利珠单抗、帕博利珠单抗及信迪利单抗。上述方案每3周为1个周期,化疗行4~6周期,ICI治疗直至出现疾病进展或产生不可耐受的不良反应。
4. 扫描显像方法:应用Minitracer回旋加速器和Tracer Lab FX-FDG合成器(美国GE公司)合成18F-FDG,放化纯度≥95%,注射剂量为3.7 MBq/kg。禁食≥4 h,血糖控制在11 mmol/L以下,静卧60 min后,用Discovery ST PET/CT(美国GE公司)行CT扫描(管电压120 kV、管电流140 mAs、层厚3.75 mm、螺距1.25),再以三维模式行PET图像采集,3 min/床位。应用CT数据衰减校正PET图像,内迭代法重建图像,数据传至Xeleris工作站,处理后获得多平面图像和融合图像。
5. 图像分析:由2位主治医师以上职称的核医学科医师共同阅片判定。在MEDEX工作站上进行分析,以SUVmax的42%阈值自动勾画感兴趣区(region of interest,ROI)[15],于轴位手工调整,确定肿瘤的最佳边界,软件自动生成ROI的SUVmax、SUVmean、MTV、TLG等。肿瘤总代谢体积(total metabolic tumor volume,TMTV)即为将所有高代谢病灶的MTV相加而成。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,利用ROC曲线上的坐标点选取约登指数,约登指数=灵敏度-(1-特异度),获得TMTV、TLG及SUVmax的最佳临界点(cut-off value)。
6. 随访及疗效评价:采用查阅患者住院病历及电话联系进行随访。随访终止日期为2022年2月12日。参照实体瘤疗效评价标准(response evaluation criteria in solid tumor,RESIST)[18]进行疗效评价。根据病灶缩减的百分比将临床疗效分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease,PD)。客观有效率(objective response rate,ORR)为CR+PR患者占全组患者的百分率,疾病控制率(disease control rate,DCR)为CR+PR+SD患者占全组患者的百分率。总生存(overall survival,OS)计算从首次治疗开始至任何原因导致死亡为止的时间。无进展生存(progression-free survival,PFS)计算从首次治疗开始至肿瘤首次进展或死亡时间。
7. 统计学处理:采用SPSS 24.0软件对数据进行统计学分析。使用Kaplan-Meier法评估生存情况,Log-rank法及Cox回归确定与预后相关的因素。单因素分析有统计学意义(P<0.05)的因素被纳入多因素Cox回归分析。P<0.05为差异有统计学意义。
结果1. 临床资料:共入组44例晚期NSCLC患者,中位随访时间为17.1个月。全组患者的中位年龄为63岁(43~76岁)。39例(88.6%)患者无基因突变,5例(11.4%)患者未行基因检测。转移灶数量中位数为2个(1~11个),20例(45.5%)患者有肺转移,16例(36.4%)患者有骨转移,11例(25.0%)患者有肾上腺转移,8例(18.2%)患者有脑转移,3例(6.8%)患者有肝转移,见表 1。根据实体瘤疗效评价标准(RESIST)的最佳总体反应,本研究44例患者中,0例CR,20例(45.5%)PR,9例(20.5%)SD,15例(34.1%)PD,ORR为45.5%(20/44),DCR为65.9%(29/44),见图 1。
|
|
表 1 44例晚期非小细胞肺癌患者一般临床资料及无进展生存期(PFS)和总生存期(OS)单因素分析 Table 1 General clinical data of 44 patients with advanced NSCLC and the univariate analysis of progression-free survival (PFS) and overall survival (OS) |
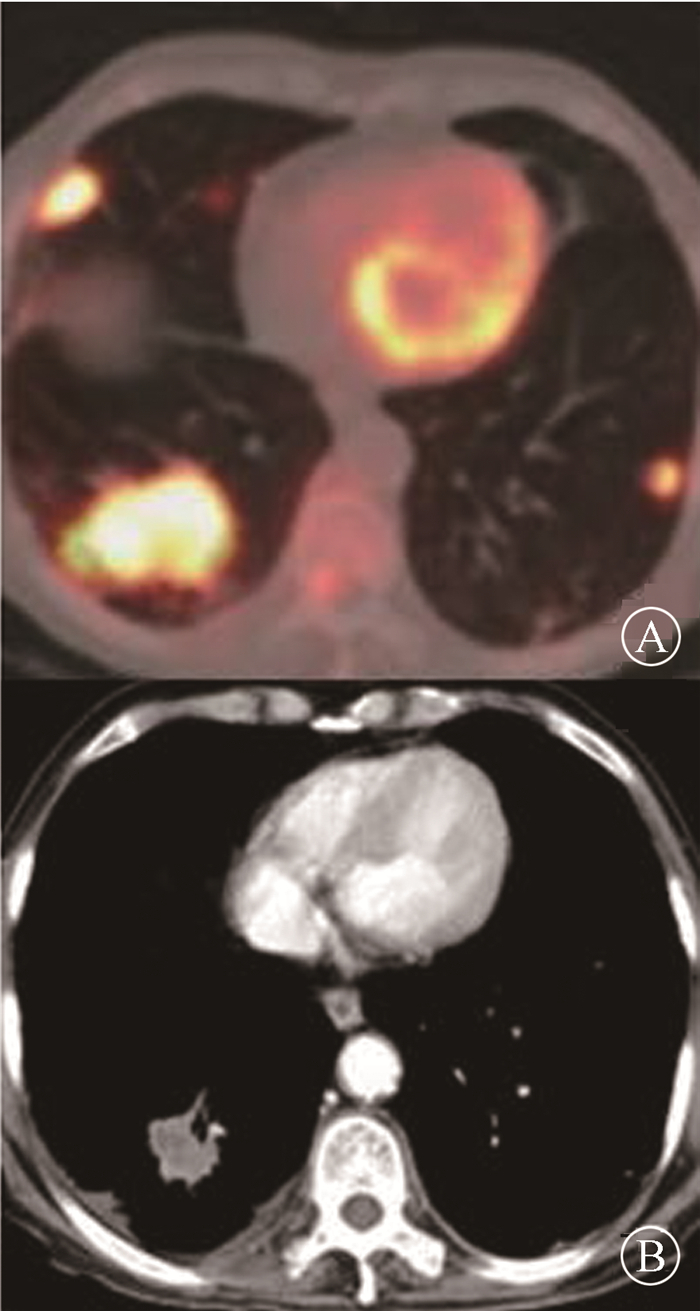
|
A.患者治疗前PET/CT图像,TMTV=169.3 cm3,TLG=1 496.7,SUVmax=15.2;B.患者经过2个周期一线免疫治疗联合化疗后的CT图像,疗效评价为PR 图 1 1例典型晚期非小细胞肺癌患者影像学资料 A. Baseline PET/CT images before treatment, TMTV=169.3 cm3, TLG=1 496.7, SUVmax=15.2; B. CT slice after 2 cycles of first-line immunotherapy combined with chemotherapy, and the response was evaluated as PR Figure 1 Imaging of a typical advanced NSCLC patient |
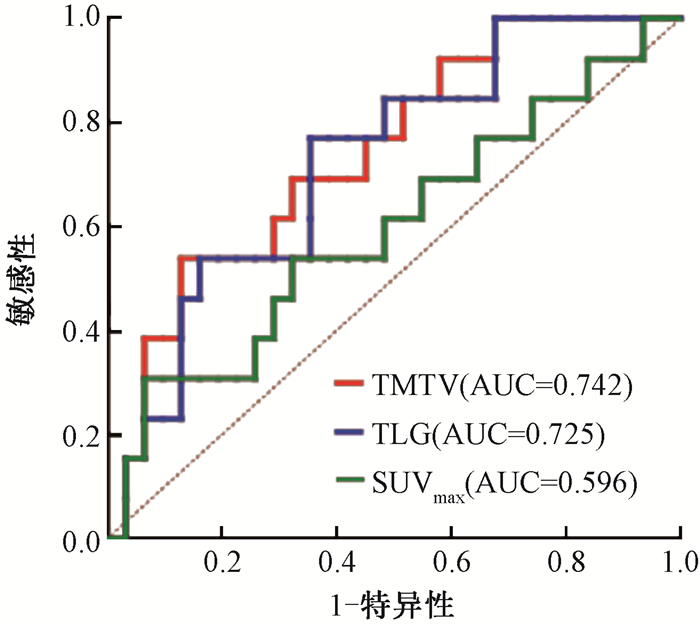
2. 代谢参数:本研究纳入的TMTV平均值为76.7 cm3、TLG平均值为639.6、SUVmax平均值为13.85。绘制ROC曲线,获得TMTV最佳临界点为119.5 cm3(曲线下面积AUC为0.742,P=0.012,灵敏度0.538,特异度0.871)。TLG最佳临界点为424.3(AUC为0.725,P=0.020,灵敏度0.769,特异度0.645)。由于SUVmax的AUC较小(AUC=0.596,P=0.322),ROC曲线无法获得最佳临界值,因此以SUVmax平均值作为临界值,见图 2。根据代谢参数临界值将患者分为高代谢参数组及低代谢参数组。
|
注:TMTV.总肿瘤代谢体积;TLG.糖酵解总量;SUVmax.最大标准摄取值 图 2 不同代谢参数预测44例晚期非小细胞肺癌一线免疫治疗联合化疗疗效的ROC曲线 Figure 2 ROC curves of different metabolic parameters for predicting the efficacy of first-line immunotherapy combined with chemotherapy in 44 advanced NSCLC patients |
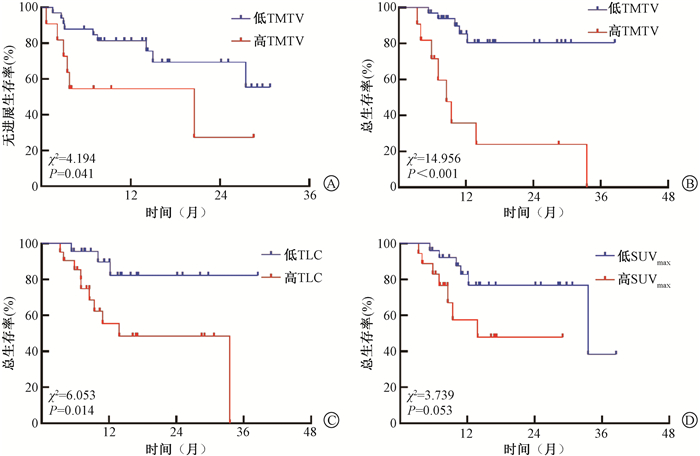
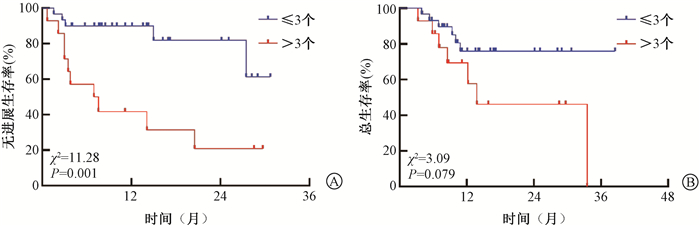
3. 生存分析:对患者年龄、性别、吸烟史、病理类型、生存质量评分(ECOG)、PD-L1表达状态、转移灶数量、TMTV、TLG、SUVmax分别进行Kaplan-Meier分析,结果显示,影响OS的因素包括TMTV及TLG (χ2=14.96、6.05,P<0.05),见表 1,图 3。SUVmax虽然与OS无明显相关性(P> 0.05),但与低SUVmax组相比,高SUVmax可观察到死亡率升高的趋势,见图 3,表 2。影响PFS的因素为基线转移灶数量(χ2=11.28,P < 0.05),见图 4。
|
注:TMTV.总肿瘤代谢体积;TLG.糖酵解总量;SUVmax.最大标准摄取值 图 3 44例晚期非小细胞肺癌患者TMTV(A、B)、TLG(C)和SUVmax(D)与一线免疫治疗联合化疗生存曲线亚组比较 Figure 3 Association of TMTV (A, B), TLG (C) and SUVmax (D) with survival curves in 44 advanced NSCLC patients with first-line immunotherapy combined with chemotherapy |
|
|
表 2 不同代谢参数分组无进展生存率及总生存率 Table 2 Progression-free survival and overall survival of different groups of metabolic parameters |
|
图 4 44例晚期非小细胞肺癌患者基线转移灶数量的无进展生存(A)与总生存(B)曲线比较 Figure 4 Association of number of metastatic sites with progression-free survival (A) and overall survival (B) in 44 advanced NSCLC patients |
对单因素分析有意义的因素进行Cox回归法多因素分析,结果显示基线转移灶数量是PFS的独立预后因素(P=0.011),见表 3;TMTV分组是OS的独立预后因素(P=0.038),见表 4。
|
|
表 3 44例晚期非小细胞肺癌患者无进展生存期多因素分析 Table 3 Multivariate analysis of progression-free survival in 44 advanced NSCLC patients |
|
|
表 4 44例晚期非小细胞肺癌患者总生存期多因素分析 Table 4 Multivariate analysis of overall survival in 44 advanced NSCLC patients |
讨论
肺癌是全球最常见的恶性肿瘤,死亡率高,预后差。基于KEYNOTE-189[19]和KEYNOTE-407[20]研究,针对无驱动基因的晚期NSCLC患者,ICI治疗联合双药化疗获批一线适应证且无需考虑PD-L1水平。但肺癌患者异质性较高,在不区分治疗人群的情况下,ICI治疗的客观缓解率仅为19.4%[5],因此筛选出ICI治疗的有效人群有助于实现精准治疗,在临床工作中具有一定意义。
越来越多的证据表明,高肿瘤负荷对于抗肿瘤免疫作用有负面影响,18F-FDG PET/CT可作为评估机体肿瘤负荷的手段之一[11],其不仅可以反映患者解剖结构的变化,还可通过病灶的葡萄糖代谢信息判断其性质,对癌症患者的诊断与分期具有更高的特异性和准确性[21-22]。近年来,PET/CT参数在NSCLC患者的预后评价中广泛应用。Kwak等[23]的回顾性研究证明,基线SUVmax值高于6与行立体定向治疗(stereotactic ablative radiotherapy,SABR)的不适合手术的早期肺癌患者较差的预后存在明显相关性。但SUVmax仅反映肿瘤中最高的代谢活性,治疗前后的SUVmax值进行对比可评估治疗效果,并不反映患者的整体肿瘤负荷[24]。然而,TMTV及TLG结合肿瘤病灶体积提供两方面信息以反映机体肿瘤负荷,具有更好的预后评估价值。Yıldırım等[25]研究了110例接受PET/CT检查后行放化疗的局部晚期及晚期(ⅢA~Ⅳ期)NSCLC患者,多因素Cox分析显示,TLG是局部晚期及晚期NSCLC患者总生存期的独立预后因素。一项Meta分析表明,不区分治疗手段和分期的情况下,TMTV及TLG比SUVmax更能预测NSCLC的治疗效果[26]。然而,本研究结果显示,TLG虽然与患者OS明显相关,但并不是OS的独立预后因素。与TLG相比,TMTV对接受一线ICI治疗联合化疗的晚期NSCLC患者预后似乎更具相关性。本研究通过对大量病例资料进行筛选,严格入排标准,最终纳入44例行基线PET/CT检查且接受一线ICI治疗的晚期NSCLC患者,通过ROC曲线获取的TMTV最佳临界值为119.5 cm3,此临界值不同于以往研究,如Seban等[15, 27]报道的75及84 cm3,取中位数作为TMTV临界值,而本研究以OS作为状态变量,采用ROC曲线得到其最佳临界值,而后根据最佳临界值将患者分组。本研究多因素分析结果显示,高TMTV组较低TMTV组存在明显生存获益。一项回顾性研究对109例在不同情况下接受单药ICI治疗的NSCLC患者的资料分析表明,TMTV分组与OS差异有统计学意义[15]。Dall′Olio等[28]将晚期NSCLC患者分为PD-L1≥50%且接受一线ICI治疗组和靶向治疗组,结果显示,在ICI治疗组中,TMTV是晚期NSCLC患者的独立预后因素。高TMTV组患者中位OS仅为4.7个月,低TMTV组患者中位OS尚未观察到。而在靶向治疗组中,TMTV分组与OS差异无统计学意义。一项多中心回顾性研究报道了2017-2019年63例PD-L1≥50%且接受一线ICI治疗的晚期NSCLC患者,按照患者TMTV分组及dNLR水平对患者进行评分,将患者分为优、良、差3组,其中位OS分别为17.9、13.8、6.6个月,中位PFS分别为15.1、5.2、1.9个月。此研究结果显示,差组与较差的生存及免疫反应存在明显相关性[27]。本研究结果提示,TMTV分组可能对筛选ICI治疗有效人群具有一定的意义。
转移灶数量也可体现患者体内的肿瘤负荷,本研究将基线转移灶数量≤3的患者与>3的患者进行比较,多因素分析结果显示,基线转移灶数量为PFS的独立预后因素。类似地,在42例存在颅外转移的晚期NSCLC患者中,有1处转移的患者生存明显优于多处转移[29]。He等[30]讨论了627例晚期NSCLC患者,其中有1个远处转移器官且病灶数≤3的患者预后显著优于有1个远处转移器官且病灶数>3或有多个远处转移器官者。
本研究的不足是这是一项单中心回顾性研究,入组患者数较少且亚组患者数量不均衡,因此得出的结论需要大样本多中心前瞻性研究进一步证实。
综上所述,本研究通过对44例接受一线ICI治疗联合化疗的晚期NSCLC患者的基线PET/CT的分析发现,TMTV及基线转移灶数量可考虑在临床工作中评估患者预后,但仍需前瞻性研究进一步验证。
利益冲突 无
作者贡献声明 王韵涵负责设计研究方案、研究实施及论文撰写;孙亚楠负责论文修改;李鹏、杨建伟负责PET/CT阅片及参数测量工作;王晓辉、郑晓丽、罗辉、叶柯参与论文修改;张朕钦负责数据的收集工作;葛红负责论文总体修改与最终审校
| [1] |
Herbst RS, Morgensztern D, Boshoff C. The biology and management of non-small cell lung cancer[J]. Nature, 2018, 553(7689): 446-454. DOI:10.1038/nature25183 |
| [2] |
Siegel RL, Miller KD, Fuchs HE. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [3] |
Huang Z, Su W, Lu T, et al. First-line immune-checkpoint inhibitors in non-small cell lung cancer: current landscape and future progress[J]. Front Pharmacol, 2020, 11: 578091. DOI:10.3389/fphar.2020.578091 |
| [4] |
Carbone DP, Reck M, Paz-Ares L, et al. First-line nivolumab in stage Ⅳ or recurrent non-small-cell lung cancer[J]. N Engl J Med, 2017, 376(25): 2415-2426. DOI:10.1056/NEJMoa1613493 |
| [5] |
Garon EB, Rizvi NA, Hui R, et al. Pembrolizumab for the treatment of non-small-cell lung cancer[J]. N Engl J Med, 2015, 372(21): 2018-2028. DOI:10.1056/NEJMoa1501824 |
| [6] |
Kim CG, Kim CH, Pyo KH, et al. Hyperprogressive disease during PD-1/PD-L1 blockade in patients with non-small-cell lung cancer[J]. Ann Oncol, 2019, 30(7): 1104-1113. DOI:10.1093/annonc/mdz123 |
| [7] |
Castello A, Rossi S, Mazziotti E, et al. Hyper-progressive disease in patients with non-small cell lung cancer treated with checkpoint inhibitors: the role of 18F-FDG PET/CT[J]. J Nucl Med, 2020, 61(6): 821-826. DOI:10.2967/jnumed.119.237768 |
| [8] |
Janning M, Kobus F, Babayan A, et al. Determination of PD-L1 expression in circulating tumor cells of NSCLC patients and correlation with response to PD-1/PD-L1 inhibitors[J]. Cancers (Basel), 2019, 11(6): 835. DOI:10.3390/cancers11060835 |
| [9] |
Abdel-Rahman O. Correlation between PD-L1 expression and outcome of NSCLC patients treated with anti-PD-1/PD-L1 agents: a meta-analysis[J]. Crit Rev Oncol Hematol, 2016, 101: 75-85. DOI:10.1016/j.critrevonc.2016.03.007 |
| [10] |
Rizvi NA, Hellmann MD, Snyder A, et al. Cancer immunology. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer[J]. Science, 2015, 348(6230): 124-128. DOI:10.1126/science.aaa1348 |
| [11] |
Dall'Olio FG, Marabelle A, Caramella C, et al. Tumour burden and efficacy of immune-checkpoint inhibitors[J]. Nat Rev Clin Oncol, 2021, 19(2): 75-90. DOI:10.1038/s41571-021-00564-3 |
| [12] |
Sharma A, Mohan A, Bhalla AS, et al. Role of various metabolic parameters derived from baseline 18F-FDG PET/CT as prognostic markers in non-small cell lung cancer patients undergoing platinum-based chemotherapy[J]. Clin Nucl Med, 2018, 43(1): e8-e17. DOI:10.1097/RLU.0000000000001886 |
| [13] |
Chin AL, Kumar KA, Guo HH, et al. Prognostic value of pretreatment FDG-PET parameters in high-dose image-guided radiotherapy for oligometastatic non-small-cell lung cancer[J]. Clin Lung Cancer, 2018, 19(5): e581-e588. DOI:10.1016/j.cllc.2018.04.003 |
| [14] |
Winther-Larsen A, Fledelius J, Sorensen BS, et al. Metabolic tumor burden as marker of outcome in advanced EGFR wild-type NSCLC patients treated with erlotinib[J]. Lung Cancer, 2016, 94: 81-87. DOI:10.1016/j.lungcan.2016.01.024 |
| [15] |
Seban RD, Mezquita L, Berenbaum A, et al. Baseline metabolic tumor burden on FDG PET/CT scans predicts outcome in advanced NSCLC patients treated with immune checkpoint inhibitors[J]. Eur J Nucl Med Mol Imaging, 2020, 47(5): 1147-1157. DOI:10.1007/s00259-019-04615-x |
| [16] |
Zhang H, Wroblewski K, Appelbaum D, et al. Independent prognostic value of whole-body metabolic tumor burden from FDG-PET in non-small cell lung cancer[J]. Int J Comput Assist Radiol Surg, 2013, 8(2): 181-191. DOI:10.1007/s11548-012-0749-7 |
| [17] |
Lababede O, Meziane MA. The eighth edition of TNM staging of lung cancer: reference chart and diagrams[J]. Oncologist, 2018, 23(7): 844-848. DOI:10.1634/theoncologist.2017-0659 |
| [18] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1. 1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [19] |
Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer[J]. New Engl J Med, 2018, 378(22): 2078-2092. DOI:10.1056/NEJMoa1801005 |
| [20] |
Paz-Ares L, Luft A, Vicente D, et al. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer[J]. N Engl J Med, 2018, 379(21): 2040-2051. DOI:10.1056/NEJMoa1810865 |
| [21] |
Lebech AM, Gaardsting A, Loft A, et al. Whole-body 18F-FDG PET/CT is superior to CT as first-line diagnostic imaging in patients referred with serious nonspecific symptoms or signs of cancer: a randomized prospective study of 200 patients[J]. J Nucl Med, 2017, 58(7): 1058-1064. DOI:10.2967/jnumed.116.175380 |
| [22] |
Rohren EM, Lowe VJ. Update in PET imaging of nonsmall cell lung cancer[J]. Semin Nucl Med, 2004, 34(2): 134-153. DOI:10.1053/j.semnuclmed.2003.12.004 |
| [23] |
Kwak YK, Park HH, Choi KH, et al. SUVmax predicts disease progression after stereotactic ablative radiotherapy in stage I non-small cell lung cancer[J]. Cancer Res Treat, 2020, 52(1): 85-97. DOI:10.4143/crt.2019.007 |
| [24] |
Lee JW, Lee SM, Yun M, et al. Prognostic value of volumetric parameters on staging and posttreatment FDG PET/CT in patients with stage Ⅳ non-small cell lung cancer[J]. Clin Nucl Med, 2016, 41(5): 347-353. DOI:10.1097/RLU.0000000000001126 |
| [25] |
Yıldırım F, Yurdakul AS, Özkaya S, et al. Total lesion glycolysis by 18F-FDG PET/CT is independent prognostic factor in patients with advanced non-small cell lung cancer[J]. Clin Respir J, 2017, 11(5): 602-611. DOI:10.1111/crj.12391 |
| [26] |
Im HJ, Pak K, Cheon GJ, et al. Prognostic value of volumetric parameters of (18)F-FDG PET in non-small-cell lung cancer: a meta-analysis[J]. Eur J Nucl Med Mol Imaging, 2015, 42(2): 241-251. DOI:10.1007/s00259-014-2903-7 |
| [27] |
Seban RD, Assie JB, Giroux-Leprieur E, et al. Association of the metabolic score using baseline FDG-PET/CT and dNLR with immunotherapy outcomes in advanced nsclc patients treated with first-line pembrolizumab[J]. Cancers (Basel), 2020, 12(8): 2234. DOI:10.3390/cancers12082234 |
| [28] |
Dall'Olio FG, Calabrò D, Conci N, et al. Baseline total metabolic tumour volume on 2-deoxy-2-[18F] fluoro-d-glucose positron emission tomography-computed tomography as a promising biomarker in patients with advanced non-small cell lung cancer treated with first-line pembrolizumab[J]. Eur J Cancer, 2021, 150: 99-107. DOI:10.1016/j.ejca.2021.03.020 |
| [29] |
Michael PM, Rodney H, Richard F, et al. FDG-PET-detected extracranial metastasis in patients with non-small cell lung cancer undergoing staging for surgery or radical radiotherapy[J]. Acta Oncol, 2003, 42(1): 48-54. DOI:10.1080/0891060310002230 |
| [30] |
He YY, Zhang XC, Yang JJ, et al. Prognostic significance of genotype and number of metastatic sites in advanced non-small-cell lung cancer[J]. Clin Lung Cancer, 2014, 15(6): 441-447. DOI:10.1016/j.cllc.2014.06.006 |
 2023, Vol. 43
2023, Vol. 43


