2. 清华大学医学院生物医学工程系, 北京 100084;
3. 福建医科大学附属协和医院放疗科, 福州 350001;
4. 清华大学工程物理系, 北京 100084
2. Department of Biomedical Engineering, School of Medicine, Tsinghua University, Beijing 100084, China;
3. Department of Radiation Oncology, Fujian Medical University Union Hospital, Fuzhou 350001, China;
4. Department of Engineering Physics, Tsinghua University, Beijing 100084, China
立体定向放射治疗已成为治疗肝癌的一种有效方法[1],以射波刀为代表的立体定向放射治疗(stereotactic body radiation therapy,SBRT)具有提高肿瘤局部控制率,降低周围正常组织器官照射剂量的优势。射线的准确投照很大程度上取决于患者每日摆位的准确性,以及对呼吸运动的管理。射波刀独有的同步呼吸跟踪技术可以在患者自由呼吸的状态下让机械手臂跟随肿瘤运动,以补偿呼吸引起的治疗不确定性[2]。其原理是将金标标记的内部靶区运动与体表标记点反应的外部运动相互关联建立呼吸模型实现对肿瘤的追踪照射。高精度的模型既需要外部规律的呼吸信号也需要内部稳定的金标位置结构。
针对采用同步呼吸追踪的肝癌SBRT治疗,肝脏金标植入的方式主要包括经动脉穿刺和经皮穿刺,前者操作复杂且耗时长,而后者在操作上更简单、患者耐受性更好而被广泛使用[3]。而植入体内的金标常因呼吸运动、肝内血液流动等原因沿针道或血管发生移位[4-5]。一些学者将标记物表面或体部结构改为线性、哑铃形等结构以改善移位问题,但仍有一部分金标会发生远处移位,移位到远处的金标可能造成诸多不良反应[6]。此外,目前鲜有对金标植入后再取出的报道,主要原因在于缺少相关设备和技术不够成熟难以实施。因此,本研究通过设计动物实验,经皮肝穿刺植入一种弹簧线圈金标和外置套管,利用带细线的弹簧线圈降低可能发生针道的移位和远处移位,同时套管提供取出通道,初步评价该金标的稳定性及植入方法的可行性、有效性和安全性。
材料与方法1. 动物与实验设备:实验动物使用成年新西兰家兔10只(福州市润怡实验动物服务部提供),6月龄,体重2.6~3.0 kg,雌雄不限,动物许可证编号为SCXK(沪)20220006。实验动物术前禁食12 h,禁水6 h,静脉注射乌拉坦(5 ml/kg)。研究方案通过福建医科大学动物伦理委员会批准,伦理编号:FJMU IACUC 2021-0378。穿刺金标(常州朗合医疗,FM001-D6/D8),分为体部和弹簧部,体部为0.8 mm × 0.3 mm的纯金圆柱体,表面刻有螺纹,体部末端连有弹簧圈,弹簧圈直径约4 mm,其尾部系有柔性细线,细线为外科缝合手术线可用于体内。穿刺针大小为18 G,套管使用介入导管鞘(上海康德莱,KDL-YX-016-01)。
2. 参照金标植入:家兔麻醉后固定于治疗床备皮,腹部充分暴露覆盖医用定位纸,根据定位纸铅点标记选择符合植入的层面及位置。CT扫描后将18 G穿刺针穿刺至目标位置并重复CT确认,位置正确即可退出针芯,将事先放有金标的预置器连接穿刺针入口推动针芯将金标推至目标位置,共植入3颗金标,以第1颗和第2颗作为追踪金标,其配准的结果作为研究的参照值,第3颗作为备用金标。10 d后CT扫描金标位置无远处移位开始植入套管金标(第4颗)。
3.套管金标植入:植入的套管金标与之前植入的第1颗组合,作为追踪金标,其配准结果作为研究观察值。植入点选择步骤同参照金标,穿刺针植入目标位置后退出针芯,再将导丝穿过穿刺针送入目标位置。固定导丝后移除穿刺针,再沿导丝经皮放置直径2 mm的套管。随后将预置器与套管尾部相连,用推杆将弹簧圈金标通过套管推入肝实质,最后退出推杆并在体外固定套管及外置细线以防脱落。
4. 照射实施:模拟定位使用大孔径螺旋CT(荷兰飞利浦公司,Brilliance CT Big Bore),扫描参数,管电压100 kV,管电流50 mA,层厚1 mm,扫描范围包括整个肝脏。使用射波刀计划系统在金标附近勾画虚拟GTV,形状为半径为1 cm的圆球,照射次数为单次照射,虚拟靶区处方剂量为8 Gy/次。实施照射:直线加速器X射线能量为6 MV,准直器为5、7.5 mm的Iris准直器,剂量率为900 MU/min。照射前分别对参照组(第1颗和第2颗)和套管组(第1颗和第4颗)进行配准,采用Synchrony同步呼吸追踪联合金标追踪方式进行追踪照射,照射中机械臂根据模型预测虚拟靶区的位置实施追踪补偿。
5. 数据提取与分析:从后台文件中提取治疗中配准误差,配准的值用来分析套管金标的稳定性。金标移位会对配准精度产生影响,较大的移位可能导致无法配准。评估修正后3个方向的差异,修正后的值在3 mm内即可接受射波刀追踪。
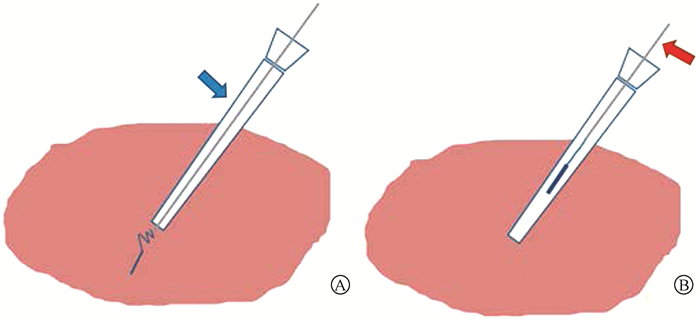
6. 金标回收:完成射波刀施照后,牵拉外置细线将金标沿套管取出,牵拉过程中金标尾部弹簧由扩展状态变为竖直状态,见图 1。取出金标后进行胸腹部CT扫描,检查是否出现气胸、出血等并发症,并观察取出部位渗血和感染情况。
|
A. 经套管(蓝色箭头)放置金标;B. 牵拉细线(红色箭头)回收金标 图 1 经皮经肝植入回收金标流程 A. The fiducial marker is pushed into the liver parenchyma through the sheath (blue arrow); B. The fiducial marker is removed from the liver parenchyma (red arrow) Figure 1 Procedure of percutaneous transhepatic implantation and removal of fiducial marker |
7. 拉力测试:使用数显推拉力计测试将金标从离体猪肝脏中取出的拉力,将金标尾部外置的柔性细线与拉力计前端相连,缓慢拉动分别记录弹簧圈金标和无弹簧圈金标在垂直方向所需最大的力,以此量化弹簧金标所需稳定的值。
8. 统计学处理:采用SPSS 25.0软件进行统计学分析。定量数据采用x±s表示,各组配准结果采用非参数检验比较差异。P < 0.05为差异有统计学意义。
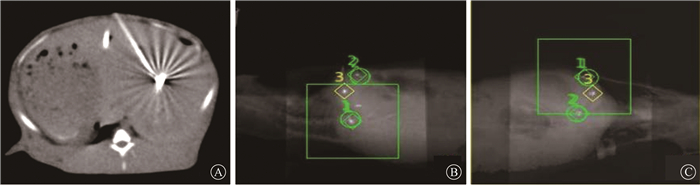
结果1. 成功率:所有含套管金标均顺利置入目标位置,植入过程顺利,植入成功率100%(10/10),从植入到治疗未见金标远处移位,治疗过程中未见套管发生脱落,CT图像和射波刀配准图像,见图 2。
|
注:DRR. 数字重建放射影像 图 2 金标CT图像及配准图像 A. CT横断面; B. 45°时DRR与实时图像的配准图像;C.135°时DRR与实时图像的配准图像 Figure 2 The CT images and registration images with fiducial markers A. Transverse section of CT; B. DRR (digitally reconstructed radiographs) are matched to orthogonal radiograph images (45°) within tracking range(green box); C. DRR are matched to orthogonal radiograph images (135°) within tracking range (green box) |
2. 配准精度:分别对参照组和套管组配准,3个方向的配准平移误差列于表 1。套管组在头脚(supero-inferior)方向平移偏差和前后(antero-posterior)方向平移偏差高于参照组(Z=-11.77、-4.57,P<0.05),套管组在左右(left-right)方向的平移偏差低于参照组(Z=-2.52,P<0.05)。
|
|
表 1 两组配准误差在头脚、左右、前后方向对比分析(mm, x±s) Table 1 The registration errors in the SI, LR and AP directions for the reference group and the casing group (mm, x±s) |
3.安全性评价:所有含套管金标均顺利取出,取出成功率100%(10/10)。放入套管后行胸腹部CT检查无气胸和明显肝脏出血等情况发生。实验操作全程家兔生命体征稳定,氧饱和度、心率、呼吸无显著异常。射波刀照射完毕后取出金标穿刺部位无明显出血和组织带出,复查胸腹部CT无气胸和明显肝脏出血等情况发生,24 h后家兔正常饮食饮水。
4. 拉力测试:垂直方向上弹簧圈金标与无弹簧圈金标取出的力分别为(2.23±0.85)N、(0.81± 0.13) N,差异有统计学意义(Z =-2.80, P<0.05)。与无弹簧圈金标相比,垂直方向上弹簧圈金标从肝内移除需要更大的力,无弹簧金标取出更加容易。
讨论本研究在具有自主呼吸运动的家兔肝内评估了一种肝脏金标植入取出新方法的可行性,以期用于射波刀金标追踪治疗。目前, 经皮穿刺植入金标简单、简便、快速,成为金标植入的主要方式。金标在穿刺针内被针芯推入肝实质即可完成植入,该技术成功率高达92.2%~96.4%[3, 7]。然而,植入肝内的金标常沿穿刺针道滑动发生移位,据报道移位率有6.9%~25%[8-9],这大大降低了金标的利用效率。重复植入会带来了诸多不便,最主要在于多次穿刺增加患者的并发症风险,理想的放置位置也可能受到限制。植入到血管附近的金标会通过肝静脉移位至下腔静脉、髂静脉、右心房等远处器官血管,可能造成血管栓塞导致器官功能丧失、损害等严重并发症[10-11]。因此,增加金标的稳定性预防可能发生的远处转移是必要的。
金标尾部弹簧圈与外置细线旨在减少金标移位提高利用率。弹簧圈直径约4 mm,直径略大于穿刺针道的直径避免了沿针道发生滑动的问题。弹簧圈末端与细线相连并在体外固定以限制远处移位,套管金标在肝内均成功植入指定部位并成功追踪。套管组与参照组在头脚(SI)方向、左右(LR)方向和前后(AP)3个方向的平移配准误差上差异有统计学意义(P<0.05)。实验结果显示,两组配准误差在左右最小,这与人体中报道的运动趋势一致[12-13],头脚方向最大是因为家兔心率较快影响的腹部运动并加大了套管在头脚方向的摆动,提示在治疗时外置套管需要加强固定。此外,金标位置变化受到不同肝段和金标间距离的影响,套管金标植入距离越接近参照金标时,其间距变化越小,而距离远时更容易受到不同肝段的不同步运动的影响,当金标植入体内一周后,由于与周围组织成纤维细胞发生反应自身迁移随着时间延长逐渐减小,肝脏运动受到周围膈肌、胃肠道以及本身韧带影响而不同,移位则主要由组织器官形变引起[14-16]。为减少运动对套管的影响配准时对金标配准并仔细比较了周围骨性结构的位置,避免可能引起的错误识别。
金标植入方式类似于Seldinger技术,植入到目标位置后弹簧尾部细线通过套管在体表固定,实验结果显示金标未发生远处移产生弃标,显著优于之前所报道的金标移位率[8-9]。实验所用套管孔径与常规18G穿刺针孔径一致,与其他外置导管或引流管相比,外露部位更短孔径更小创伤更小。为减少放置套管时对组织的损伤本操作中需注意以下问题:①放入导丝前应充分估计导丝进入长度,避免导丝进入过长损伤肝内血管胆道系统。②导丝需选用硬质导丝,插入套管时可根据手部阻力判断导管位置是否合适,导丝撤出前先固定好导管位置避免带出。③该方法不适合用于靠近肋骨或肋软骨附近的肝叶,肋软骨会形成阻挡增加套管植入难度和不必要的损伤。
本研究测试了有无弹簧圈金标从离体肝脏取出所需的拉力,以量化弹簧圈抵抗移位的阻力。弹簧圈由镍钛合金制成,塑形好且柔软,扩张后与穿刺针道紧密接触,增加了金标沿针道方向移动的阻力,相比无弹簧圈的金标取出时需用更大的力,表明弹簧圈具有增加稳定性的效果。当金标被牵拉回到套管时弹簧压缩回成竖直状态以便取出,在金标植入家兔肝脏的取出操作中观察到这种力度并未造成明显并发症发生。金标取出未见组织附着,CT胸腹扫描结果显示未见明显气胸和出血,24 h后家兔恢复活动开始正常进食饮水。随着金标在肝内放置随时间延长,周围组织与金标连接更加紧密将增加金标取出的难度,本实验在当天完成植入和取出且由于家兔体型小套管植入深度 < 5 cm,因此取出成功率高。需要注意的是,对于CT引导下可能植入到血管的金标取出时应采用超声观察金标与血管的关系,对于不适合取出的金标采取保留的方法避免取出的过程损伤血管。
目前,植入和取出技术具有广泛的应用范围,包括活检、药物治疗、组织微环境监测等[17-18]。已有研究者研发了药物体内释放的微器件,Bhagavatula等[19-20]基于两种生物相容性的材质研发了体内固装置:膨胀式镍钛网和膨胀式水凝胶颗粒。该装置植入组织后可逐渐膨胀,通过增加与组织的接触面积而增加稳定性,装置内放置的标记物既可以用做图像引导的标志,也可以控制药物释放作用于肿瘤,全程以微创的方式植入取出。此外,外置导线可以实现微器件通信或体内运动监测,实时传输至体外显示肿瘤运动信息,可能会降低目前体内外建立呼吸模型时易受呼吸幅度影响的不足。安全、微创的情况下进行精确的植入和取出需要特定设备的支持,各种技术的集成需要多学科合作,对于转换临床应用还需要更深入的研究。后续实验将利用肝内血管胆道三维实时重建技术评估血管胆道与套管的关系,更好地辅助金标植入。
综上所述,套管和细线为螺旋弹簧金标在肝内提供了稳定性,套管组金标无远处移位,该方法可解决金标在体内的移位问题,为提高植入效率提供新方案。金标回收需考虑呼吸运动、组织生长等复杂影响,因此回收应用还需临床前实验进一步验证。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 邓显智、陈静负责设计研究方案、研究实施及论文撰写;林漳华、李诺兮、董芳芬、何善廷负责协助实验与收集数据;徐本华、马家骏负责技术指导;李小波、张建平提出研究思路,指导论文修改
| [1] |
Milder M, Magallon-Baro A, den Toom W, et al. Technical feasibility of online adaptive stereotactic treatments in the abdomen on a robotic radiosurgery system[J]. Phys Imag Radiat Oncol, 2022, 23: 103-108. DOI:10.1016/j.phro.2022.07.005 |
| [2] |
Akino Y, Sumida I, Shiomi H, et al. Evaluation of the accuracy of the Cyberknife synchrony? Respiratory tracking system using a plastic scintillator[J]. Med Phys, 2018, 45(8): 3506-3515. DOI:10.1002/mp.13028 |
| [3] |
Morita R, Abo D, Sakuhara Y, et al. Percutaneous insertion of hepatic fiducial true-spherical markers for real-time adaptive radiotherapy[J]. Minim Invasive Ther Allied Technol, 2020, 29(6): 334-343. DOI:10.1080/13645706.2019.1663217 |
| [4] |
徐飞, 郭福新, 彭冉, 等. 射波刀立体定向放疗中金标利用率统计与弃用原因分析[J]. 中华放射肿瘤学杂志, 2018, 27(3): 295-298. Xu F, Guo FX, Peng R, et al. Utilization rate of gold fiducial markers and reasons for abandonment in Cyberknife stereotactic body radiation therapy[J]. Chin J Radiat Oncol, 2018, 27(3): 295-298. DOI:10.3760/cma.j.issn.1004-4221.2018.03.013 |
| [5] |
黎国全, 胡斌, 朱斌, 等. 射波刀金标追踪治疗中脊柱辅助摆位的临床应用价值[J]. 中华放射医学与防护杂志, 2019, 39(6): 439-443. Li GQ, Hu B, Zhu B, et al. The auxiliary setup value of fiducial marker tracking with spine during Cyberknife radiosurgery[J]. Chin J Radiol Med Prot, 2019, 39(6): 439-443. DOI:10.3760/cma.j.issn.0254-5098.2019.06.007 |
| [6] |
Asah D, Raju S, Ghosh S, et al. Nonthrombotic pulmonary embolism from inorganic particulate matter and foreign bodies[J]. Chest, 2018, 153(5): 1249-1265. DOI:10.1016/j.chest.2018.02.013 |
| [7] |
Kord M, Kluge A, Kufeld M, et al. Risks and benefits of fiducial marker placement in tumor lesions for robotic radiosurgery: technical outcomes of 357 implantations[J]. Cancers (Basel), 2021, 13(19): 4838-4852. DOI:10.3390/cancers13194838 |
| [8] |
Scher N, Bollet M, Bouilhol G, et al. Safety and efficacy of fiducial marker implantation for robotic stereotactic body radiation therapy with fiducial tracking[J]. Radiat Oncol, 2019, 14(1): 167-175. DOI:10.1186/s13014-019-1373-2 |
| [9] |
Dutta D, Kataki KJ, George S, et al. Prospective evaluation of fiducial marker placement quality and toxicity in liver Cyberknife stereotactic body radiotherapy[J]. Radiat Oncol J, 2020, 38(4): 253-261. DOI:10.3857/roj.2020.00472 |
| [10] |
Khullar K, Dhawan ST, Nosher J, et al. Fiducial marker migration following computed tomography-guided placement in the liver: a case report[J]. AME Case Rep, 2021, 5: 15-21. DOI:10.21037/acr-20-153 |
| [11] |
Amjad R, Soliman Y, Pereira M, et al. Migration of Calypso beacon transponders for hepatic stereotactic body radiotherapy: a report of two cases[J]. AME Case Rep, 2022, 6: 25. DOI:10.21037/acr-22-6 |
| [12] |
Nakayama M, Uehara K, Nishimura H, et al. Retrospective assessment of a single fiducial marker tracking regimen with robotic stereotactic body radiation therapy for liver tumours[J]. Rep Pract Oncol Radiother, 2019, 24(4): 383-391. DOI:10.1016/j.rpor.2019.06.001 |
| [13] |
Zeng L, Wang X, Zhou J, et al. Analysis of the amplitude changes and baseline shifts of respiratory motion using intra-fractional CBCT in liver stereotactic body radiation therapy[J]. Phys Med, 2022, 93: 52-58. DOI:10.1016/j.ejmp.2021.12.007 |
| [14] |
Lo KM, Wu VW, Li Y, et al. Factors affecting target motion in stereotactic body radiotherapy of liver cancer using Cyberknife[J]. J Med Imaging Radiat Oncol, 2020, 64(3): 408-413. DOI:10.1111/1754-9485.13020 |
| [15] |
Sharma M, Nano TF, Akkati M, et al. A systematic review and meta-analysis of liver tumor position variability during SBRT using various motion management and IGRT strategies[J]. Radiother Oncol, 2022, 166: 195-202. DOI:10.1016/j.radonc.2021.11.022 |
| [16] |
Stick LB, Vogelius IR, Risum S, et al. Intrafractional fiducial marker position variations in stereotactic liver radiotherapy during voluntary deep inspiration breath-hold[J]. Br J Radiol, 2020, 93(1116): 0859-0866. DOI:10.1259/bjr.20200859 |
| [17] |
Liu G, Valvo V, Ahn SW, et al. A two-photon microimaging-microdevice system for four-dimensional imaging of local drug delivery in tissues[J]. Int J Mol Sci, 2021, 22(21): 11752-11765. DOI:10.3390/ijms222111752 |
| [18] |
Dominas C, Bhagavatula S, Stover E, et al. The translational and regulatory development of an implantable microdevice for multiple drug sensitivity measurements in cancer patients[J]. IEEE Trans Biomed Eng, 2022, 69(1): 412-421. DOI:10.1109/TBME.2021.3096126 |
| [19] |
Bhagavatula SK, Upadhyaya K, Miller BJ, et al. An interventional image-guided microdevice implantation and retrieval method for in-vivo drug response assessment[J]. Med Phys, 2019, 46(11): 5134-5143. DOI:10.1002/mp.13803 |
| [20] |
Bhagavatula SK, Thompson D, Dominas C, et al. Self-expanding anchors for stabilizing percutaneously implanted microdevices in biological tissues[J]. Micromachines (Basel), 2021, 12(4): 0404-0415. DOI:10.3390/mi12040404 |
 2023, Vol. 43
2023, Vol. 43


