2. 清华大学工程物理系, 北京 518000;
3. 山东省肿瘤医院放射物理技术科, 济南 250117;
4. 广州中医药大学第一附属医院放疗科, 广州 510405
2. Department of Engineering Physics, Tsinghua University, Beijing 518000, China;
3. Department of Radiation Physics, Shandong Cancer Hospital, Jinan 250117, China;
4. Department of Radiation Oncology, First Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangzhou 510405, China
CT模拟定位机是现代肿瘤放射治疗中的常规定位设备,用于提供放射治疗所需的三维解剖影像和电子密度信息。在计划系统中建立CT-电子密度转换曲线,校准组织不均匀性,以保证剂量计算的准确性[1-2]。乳腺癌根治性术后放疗其放疗体位要求患者患侧手臂外展以保证腋窝及颈部充分暴露,常用的50 cm扫描视野(FOV)的CT重建图像无法包全所有轮廓信息。通过数据插值或外推技术重建可将常规FOV获得的投影数据扩展得到更大的eFOV重建CT图像,eFOV重建部分会产生因投影数据截断所造成的伪影,改变CT值和扭曲真实扫描射野以外区域的组织结构轮廓[3-4]。现在广泛使用的自动勾画系统对组织结构分割精度与CT图像质量直接相关[5-6]。本研究通过同一原始扫描数据,重建不同FOV图像,研究不同FOV重建图像对乳腺癌根治术后放疗患者危及器官自动勾画和剂量计算精度的影响。
资料与方法1.病例:简单随机抽样入组2020年1月至2022年6月于广东省第二人民医院放疗科接受改良根治术后放射治疗的乳腺癌患者30例,年龄35~65岁,中位年龄50岁。所有患者均已签署知情同意书。
2.仪器设备:GE大孔径模拟CT定位机(美国通用公司),Gammex电子密度模体(美国Gammex公司),体积为5 cm × 5 cm × 5 cm的标准模体,Eclipse放疗计划系统(美国瓦里安公司),AccuContour自动勾画系统(厦门Manteia公司)。
3.不同FOV重建图像的CT值获取及CT-电子密度转换曲线建立:将Gammex电子密度模体分别放置在CT等中心和eFOV区域,扫描模式选择常规乳腺癌定位扫描模式(扫描管电压120 kV,电流200 mA,层厚3 mm);对中心位置及eFOV位置扫描模体的原始CT图像分别进行FOV为50、60、70和80 cm重建(分别标记为FOV50、eFOV60、eFOV70、eFOV80)。在4个重建的图像上分别读取每个插件的CT值,每个插件在不同层面内采集3次CT值,取平均值,然后再将内外两层相同密度插件的读数再求平均数比较,建立CT-电子密度转换曲线,并比较不同电子密度曲线间的差异。
4.比较不同FOV重建CT图像中标准体积模体的体积差异:将体积为5 cm × 5 cm × 5 cm的标准模体分别在等中心处和eFOV处选用常规乳腺定位扫描条件进行扫描,扫描后对等中心处模体扫描图像进行FOV为50、60、70和80 cm重建(分别记为FOV50、eFOV60、eFOV70和eFOV80);对eFOV处模体的扫描图像进行FOV为60、70和80 cm重建(分别标记为eFOV′ 60、eFOV′ 70和eFOV′ 80),所有重建图像均传至瓦里安Eclipse计划系统进行模体轮廓勾画,比较体积差异。
5.模拟定位:患者采用热塑膜联合发泡胶固定,采用仰卧位,双手上举放于头部上方,头放正中转向健侧,患侧手臂尽量放平外展充分暴露腋窝和颈部淋巴区域,模拟定位CT扫描范围从第三颈椎上缘至第二腰椎下缘,依次重建FOV50、eFOV60、eFOV70和eFOV80的CT图像,并传至AccuContour自动勾画系统。
6.靶区及危及器官勾画:在自动勾画系统中运用乳腺癌模板进行危及器官(包括食管、气管、甲状腺、左肺、右肺、健侧乳腺、脊髓、皮肤)自动勾画,由1名副主任医师根据国际辐射单位及测量委员会(ICRU)第50号报告在Eclipse计划系统中对FOV50的重建图像进行靶区及危及器官的修改并用作比较勾画标准。
7.靶区及危及器官勾画差异的评估指标:
(1) 戴斯相似系数(dice similarity coefficient, DSC):表示两个结构重叠区域所占的比例,取值0~1。越接近1表示两个结构越相似[7],DSC=2(A∩B)/(|A|+|B|)。
(2) 豪斯多夫距离(Hausdorff distance, HD):表示预测体积和参考体积之间最近点的最大距离。其值越小说明两个结构集合差异越小[8],HD(A, B)=max[h(A, B),h(B, A)]。
(3) 相对体积比(relative volume difference, RVD):表示自动勾画与手动勾画在轮廓体积上的差异。越接近于0,表明两者体积上差异越小。其中,Vref为手动勾画的体积,Vauto为自动勾画的体积[9],RVD=|Vauto- Vref| / Vref×100%。
8.计划设计及剂量计算:物理师在FOV50图像上设计9野调强计划,靶区处方剂量为50 Gy。所有计划处方剂量均满足95%以上的靶区覆盖率,心脏平均量<7 Gy,双肺V20<30%,V30<20%,健侧乳腺平均量<3 Gy,脊髓最大量<30 Gy。将计划和勾画移植到eFOV60、eFOV70和eFOV80图像上,选择其相应的电子密度转换曲线重新进行剂量计算。使用DVH图和绝对值分析同一计划在不同FOV重建图像上剂量学差异。
9.统计学处理:数据用x±s表示,应用SPSS 22.0软件对不同FOV重建CT图像中危及器官DSC、HD和RVD以及剂量学差异进行单因素方差分析。P<0.05为差异具有统计学意义。
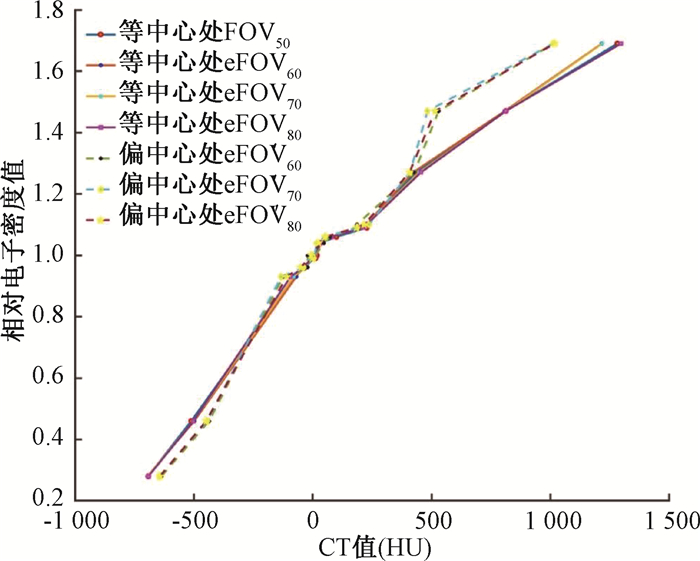
结果1.不同FOV重建CT图像的CT值及CT-电子密度转换曲线的差异:等中心处不同FOV重建图像的CT值最大差异为81 HU,偏中心处不同FOV重建图像的CT值最大差异为46 HU,相应CT-电子密度转换曲线基本一致。等中心位置和偏中心位置重建后水等效密度在0.28~1.27区间物质的CT值差异较小(最大差异为60 HU),水等效密度>1.27时差异显著(最大为303 HU),如图 1所示。
|
注:FOV50、eFOV60、eFOV70、eFOV80. 等中心处扫描,扫描射野依次为50、60、70、80 cm获得的图像;eFOV′60、eFOV′70、eFOV′80. 偏中心处扫描,扫描射野依次为60、70、80 cm获得的图像 图 1 等中心处和偏中心处不同FOV图像建立的电子密度转换曲线 Figure 1 CT values-electron density conversion curves derived from CT images reconstructed using different FOV sizes when the phantom was placed at the isocenter and off-center positions |
2.在不同FOV重建CT图像中标准体积模体的体积差异:等中心处扫描,FOV50 CT图像自动勾画的体积为124.3 cm3,随着FOV增大,重建图像自动勾画的体积与实际体积差异逐渐增大,最大差异为6 cm3(4.8%)。当模体在eFOV区域扫描时,随着FOV增大,自动勾画体积逐渐增大,eFOV′ 70时与实际物体的体积差异最小,但eFOV70和eFOV′ 80重建图像边界已经发生显著畸变。
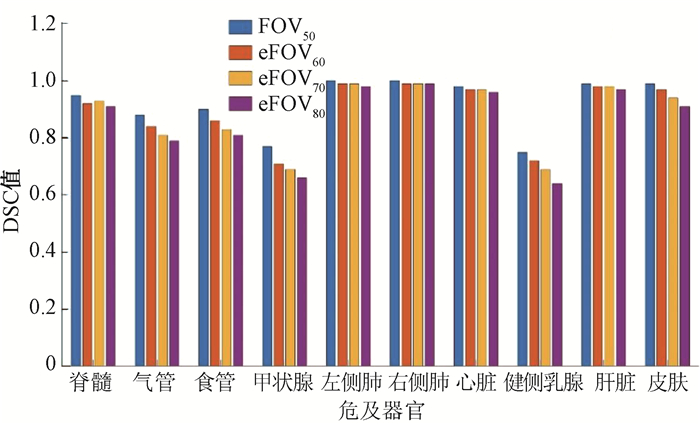
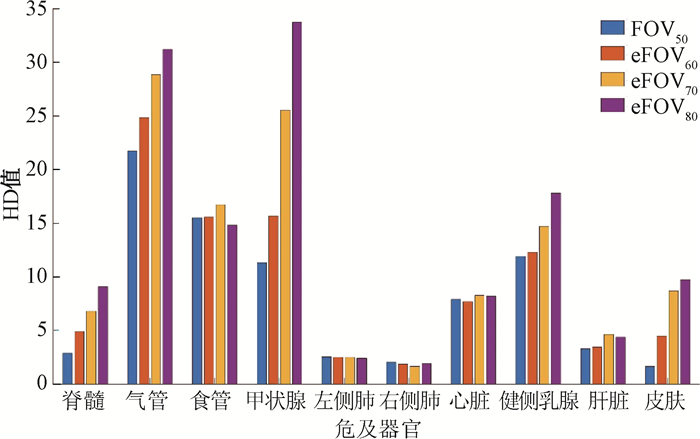
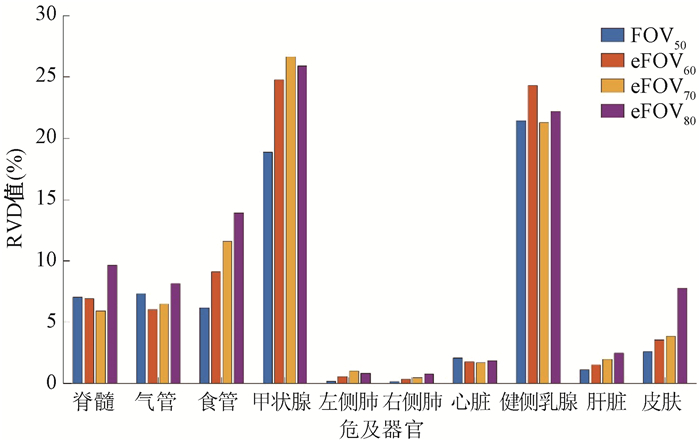
3.危及器官自动勾画差异:气管、食管、甲状腺、健侧乳腺和皮肤的DSC值均随FOV增大而降低,其中甲状腺最明显,在AccuContour勾画系统中DSC值降低了14.3%,且差异具有统计学意义(t=8.23,P<0.05),如图 2所示。脊髓、气管、甲状腺、健侧乳腺和皮肤的HD值随着FOV尺寸增大而增大,差异具有统计学意义(t=-28.43~ 6.65,P<0.05),其中皮肤变化最大,在AccuContour自动勾画系统中,皮肤的HD值从FOV50的1.6变化到eFOV80的9.74,差异达到508.8%,如图 3所示。皮肤的RVD值随FOV增大而增大,在AccuContour自动勾画系统中RVD值增加了2倍,差异具有统计学意义(t=-20.54,P<0.05),如图 4所示。
|
注:DSC.戴斯相似系数;FOV50、eFOV60、eFOV70、eFOV80. 等中心处扫描,扫描射野依次为50、60、70、80 cm获得的图像 图 2 AccuContour自动勾画系统中危及器官的DSC值比较结果 Figure 2 Comparison of DSC values of organs at risk present in the AccuContour automatic segmentation system |
|
注:HD.豪斯多夫距离;FOV50、eFOV60、eFOV70、eFOV80. 等中心处扫描,扫描射野依次为50、60、70、80 cm获得的图像 图 3 AccuContour自动勾画系统中危及器官的HD值比较结果 Figure 3 Comparison of HD values of organs at risk present in the AccuContour automatic segmentation system |
|
注: RVD.相对体积比;FOV50、eFOV60、eFOV70、eFOV80. 等中心处扫描,扫描射野依次为50、60、70、80 cm获得的图像 图 4 AccuContour自动勾画系统中危及器官的RVD值比较结果 Figure 4 Comparison of RVD values of organs at risk present in the AccuContour automatic segmentation system |
4.不同FOV重建图像的剂量学差异
(1) 靶区及危及器官剂量学比较:所有FOV重建CT图像中锁骨上淋巴结(PTV-LN)的处方剂量覆盖率均满足95%的要求,且不同FOV计划中PTV-LN V95、最大剂量及平均剂量差异无统计学意义(P>0.05)。胸壁区域靶区(PTV-CW)在FOV50和eFOV60的图像计划中处方剂量覆盖率均满足95%的要求,但在eFOV70和eFOV80的图像计划中无法满足靶区覆盖率的要求;FOV50图像计划中PTV-CW覆盖率要高于eFOV60、eFOV70、eFOV80计划,最大差异为4.06%,差异具有统计学意义(t=6.22~12.93,P<0.05, 表 1)。所有危及器官剂量学指标在不同FOV重建CT图像中基本相当(P>0.05,表 2)。
|
|
表 1 不同FOV重建图像靶区剂量学比较 Table 1 Dosimetric comparison of target volumes in CT images reconstructed using different FOV sizes |
|
|
表 2 不同FOV重建图像危及器官剂量分布比较(Gy, x±s) Table 2 Dosimetric comparison of organs at risk in CT images reconstructed using different FOV sizes(Gy, x±s) |
(2) 靶区剂量分布绝对值差异分析:两个计划点对点比较,结果越接近0表示两个计划剂量分布一致性越高。不同FOV图像计划PTV-LN同一体素绝对值剂量分布差异较小,所有入组患者平均差异如图 5所示,可见差异范围主要集中在-3~3 Gy区间内,占90.5%;而PTV-CW同一体素绝对值剂量分布差异随着FOV增大而增大,FOV50和FOV60比较差异在-2~2 Gy区间内占95%,其中[-1, 1]区间占92%;而FOV50和eFOV70差异范围在-2~2 Gy区间内占93%,其中[-1, 1]占88%,低量体素数量较多,FOV50和eFOV80差异范围在-3~3 Gy区间内占94.6%,其中[-2, 2]占87%,[-1, 1]占83%,且差异主要集中在左侧,即随着FOV的增大,低量的体素进一步增加,所有入组患者PTV-CW平均差异如图 5所示。
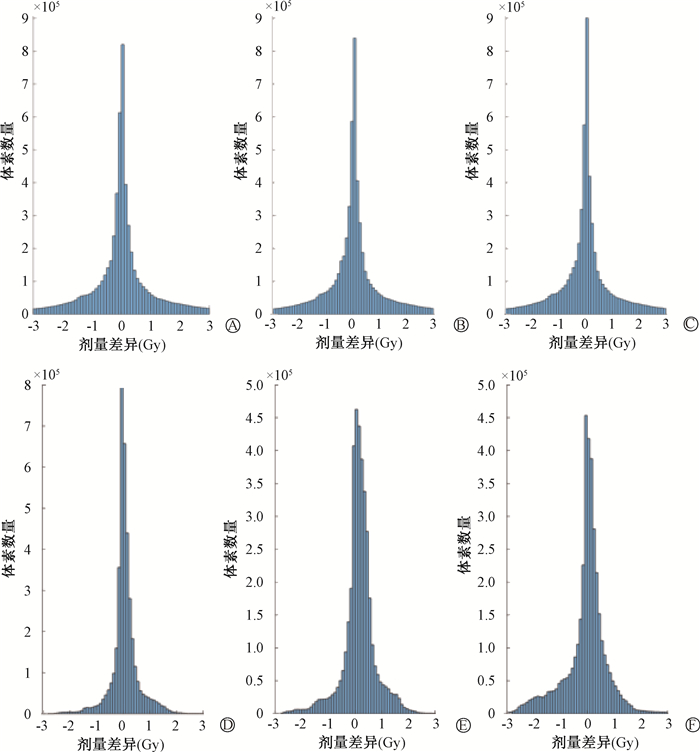
|
注:A、B、C. 锁骨上淋巴结区域剂量分布差异;D、E、F. 胸壁区域剂量分布差异 A、D. FOV50和eFOV60的差异;B、E. FOV50和eFOV70的差异;C、F. FOV50和eFOV80的差异 图 5 不同FOV重建图像靶区剂量绝对值分布差异 A, D. Differences between FOV50 and eFOV60 images; B, E. Differences between FOV50 and eFOV70 images; C, F. Differences between FOV50 and eFOV80 images Figure 5 Differences in absolute dose distributions of target volumes in CT images reconstructed using different FOV sizes |
讨论
GE大孔径模拟定位CT可以提供50 cm真实扫描射野(sFOV)和50~80 cm范围的扩展扫描射野(eFOV),而在eFOV的重建过程中,图像伪影会改变人体轮廓和CT值[10]。CT值与放疗计划剂量计算密切相关,CT值-电子密度转换曲线是实施放疗计划剂量计算的基础[11-12]。Beeksma等[10]研究得出电子密度曲线在高密度物质周围有差别,而本研究发现电子密度模体在sFOV内扫描建立电子密度转换曲线与在eFOV范围内扫描建立到的电子密度曲线在水等效密度在0.28~1.27区间的CT值差异较小,而在水等效密度>1.27时出现有较大差异(最大为303 HU,在剂量计算时,1 Gy约相差0.04 Gy),因此在基于eFOV重建图像进行剂量计算时应选用在eFOV处扫描电子密度模体建立得到的电子密度曲线,从而提高放疗计划剂量准确性。
Huang等[13]研究表明,eFOV重建算法目的在于重新创建患者的原始几何图形,但这些重建技术可能会导致伪影,扭曲图像强度和患者外部轮廓,从而产生不准确的治疗束衰减计算。而本研究通过对已知体积标准模体在sFOV及eFOV区域扫描到的图像进行不同FOV图像重建及轮廓自动识别勾画,发现FOV50重建的CT图像自动勾画获取的体积最接近模体实际体积,随FOV增大,重建图像自动勾画获取的体积与模体实际体积差异逐渐增大,而在eFOV区域扫描到的模体在重建图像上出现轮廓畸变,因此在靶区及危及器官勾画时应以FOV50的重建图像为准。
彭应林等[14]研究表明,自动勾画的精度比有经验的医生低,但比初级医生高。目前尚未有不同FOV重建图像对自动勾画精度的影响研究的报道,为了选择最优的定位图像完成自动勾画,本研究对真实的患者定位CT图像进行不同FOV的重建,通过对勾画结果进行DSC、HD和RVD值的统计分析,得出基于常规FOV50重建得的CT图像危及器官的自动勾画精度最高。
乳腺癌局部复发率为10%~20%,其中胸壁复发最为常见,为60%~94%[15-16],而术后辅助放疗可显著提高生存率,剂量计算精度非常重要。赵峰[17]表明基于不同FOV的CT重建图像进行剂量计算,靶区和危及器官的最大剂量、最小剂量和危及器官的平均剂量差异均没有统计学意义,但Bae等[4]提出,eFOV图像伪影改变了成像对象CT值和身体轮廓,这有可能导致放疗计划剂量计算不准确,放射治疗团队应了解这些图像伪影及其对治疗计划靶剂量计算的影响。而本研究发现虽然基于不同FOV重建图像进行剂量计算对危及器官及靶区平均剂量的影响差异没有统计学意义,但对靶区的覆盖度,尤其是胸壁靶区到的覆盖度有较大影响,使用常规FOV重建图像进行剂量计算时,有约4%高估胸壁靶区覆盖度,导致实际剂量不足,且欠量区域主要集中在靶区的外侧缘,这考虑是常规FOV重建图像中定位体板、固定模边条及患者轮廓信息缺失,剂量计算时没有考虑到这些缺失物质对射线的衰减,导致TPS计算出来的剂量比实际剂量高,与Wu等[1]提出的放射剂量的影响仅限于CT图像外推一侧的结论基本一致。因此,为了保证改良根治术后乳腺癌患者放射治疗计划计算的精度,在FOV50图像上完成危及器官勾画后将所有勾画移植到eFOV80 CT图像上,同时需要修改结构body,保证患者轮廓的完整性,选择eFOV80的图像进行剂量计算,减少由于射野穿行路径中结构缺失而导致部分靶区区域剂量高估。
综上所述,由于改良根治术后乳腺癌患者放疗体位及固定方式的特殊要求,定位扫描时需要同时重建常规FOV50和eFOV80的CT图像。其中危及器官的自动勾画使用常规FOV50 CT重建图像以提高勾画精度。在剂量计算时,要使用在eFOV区域扫描电子密度模体建立得到的CT值-电子密度转换曲线,保证治疗计划剂量计算的准确性。因此,推荐在危及器官自动勾画时选择FOV50CT图像,在剂量计算时选择eFOV80CT图像。
利益冲突 所有作者宣称没有任何利益冲突,未接受任何不正当的职务和财务利益
作者贡献声明 叶柳清负责撰写论文;王石、吴朝霞、洪文松、巩贯忠指导论文构思;吴艾茜、连锦兴、李桢、邓力协助数据收集及整理;文婷指导论文修改
| [1] |
Wu V, Podgorsak MB, Tran TA, et al. Dosimetric impact of image artifact from a wide-bore CT scanner in radiotherapy treatment planning[J]. Med Phys, 2011, 38(7): 4451-4463. DOI:10.1118/1.3604150 |
| [2] |
孔繁图, 陈露茜, 金锦辉, 等. CT扫描电压与CT值-相对电子密度值转换曲线不匹配对放疗计划剂量的影响[J]. 中国医学物理学杂志, 2021, 38(3): 312-316. Kong FT, Chen LX, Jin JH, et al. Effects of mismatch between CT scanning voltage and CT-RED conversion curve on radiotherapy dose[J]. Chin J Med Phys, 2021, 38(3): 312-316. DOI:10.3969/j.issn.1005-202X.2021.03.008 |
| [3] |
Das IJ, Cheng CW, Cao M, et al. Computed tomography imaging parameters for inhomogeneity correction in radiation treatment planning[J]. J Med Phys, 2016, 41(1): 3-11. DOI:10.4103/0971-6203.177277 |
| [4] |
Bae YK, Lee JW, Hong S. Effects of image distortion and Hounsfield unit variations on radiation treatment plans: An extended field-of-view reconstruction in a large bore CT scanner[J]. Sci Rep, 2020, 10(1): 473. DOI:10.1038/s41598-020-57422-y |
| [5] |
Raudaschl PF, Zaffino P, Sharp GC, et al. Evaluation of segmentation methods on head and neck CT: Auto-segmentation challenge 2015[J]. Med Phys, 2017, 44(5): 2020-2036. DOI:10.1002/mp.12197 |
| [6] |
Stapleford LJ, Lawson JD, Perkins C, et al. Evaluation of automatic atlas-based lymph node segmentation for head-and-neck cancer[J]. Int J Radiat Oncol Biol Phys, 2010, 77(3): 959-966. DOI:10.1016/j.ijrobp.2009.09.023 |
| [7] |
Huger S, Graff P, Harter V, et al. Evaluation of the Block Matching deformable registration algorithm in the field of head-and-neck adaptive radiotherapy[J]. Phys Med, 2014, 30(3): 301-308. DOI:10.1016/j.ejmp.2013.09.001 |
| [8] |
张艺宝, 吴昊, 李莎, 等. 临床前验证与几何对比分析基于图谱库的危及器官自动勾画[J]. 中国医学物理学杂志, 2015, 32(6): 761-767. Zhang YB, Wu H, Li S, et al. Pre-clinical verification and geometric comparative analysis of atlas-based automatic delineation for organs at risk[J]. Chin J Med Phys, 2015, 32(6): 761-767. DOI:10.3969/j.issn.1005-202X.2015.06.001 |
| [9] |
Zou KH, Warfield SK, Bharatha A, et al. Statistical validation of image segmentation quality based on a spatial overlap index[J]. Acad Radiol, 2004, 11(2): 178-189. DOI:10.1016/s1076-6332(03)00671-8 |
| [10] |
Beeksma B, Truant D, Holloway L, et al. An assessment of image distortion and CT number accuracy within a wide-bore CT extended field of view[J]. Australas Phys Eng Sci Med, 2015, 38(2): 255-261. DOI:10.1007/s13246-015-0353-6 |
| [11] |
朱凤盈, 马彦凝, 罗锦胜, 等. CT-电子密度转换曲线误差对IMRT剂量计算结果的影响[J]. 中国医学物理学杂志, 2020, 37(7): 816-821. Zhu FY, Ma YN, Luo JS, et al. Effect of the error of CT-electron density conversion curve on IMRT dose calculation[J]. Chin J Med Phys, 2020, 37(7): 816-821. DOI:10.3969/j.issn.1005-202X.2020.07.004 |
| [12] |
Flatten V, Friedrich A, Engenhart-Cabillic R, et al. A phantom based evaluation of the dose prediction and effects in treatment plans, when calculating on a direct density CT reconstruction[J]. J Appl Clin Med Phys, 2020, 21(3): 52-61. DOI:10.1002/acm2.12824 |
| [13] |
Huang V, Kamarn J, D'Arcy R, et al. SU-G-IeP2-02: A proposed solution to accurate delineation of external body contour within CT extended field of view (eFOV) and the evaluation of dosimetric impact from image distortion in EFOV[J]. Med Phys, 2016, 43(6 Part 26): 3655-3656. DOI:10.1118/1.4957007 |
| [14] |
彭应林, 孙文钊, 程皖琴, 等. 鼻咽癌调强计划靶区和危及器官不同勾画方式下个体化差异观察[J]. 中华放射肿瘤学杂志, 2019, 28(10): 762-766. Peng YL, Sun WZ, Cheng WQ, et al. Interobserver variations in the delineation of planning target volume and with organs at risk different contouring methods in intensity-modulated radiation therapy for nasopharyngeal carcinoma[J]. Chin J Radiat Oncol, 2019, 28(10): 762-766. DOI:10.3760/cma.j.issn.1004-4221.2019.10.010 |
| [15] |
Halverson KJ, Perez CA, Kuske RR, et al. Survival following locoregional recurrence of breast cancer: univariate and multivariate analysis[J]. Int J Radiat Oncol Biol Phys, 1992, 23(2): 285-291. DOI:10.1016/0360-3016(92)90743-2 |
| [16] |
Borner M, Bacchi M, Goldhirsch A, et al. First isolated locoregional recurrence following mastectomy for breast cancer: results of a phase Ⅲ multicenter study comparing systemic treatment with observation after excision and radiation. Swiss Group for Clinical Cancer Research[J]. J Clin Oncol, 1994, 12(10): 2071-2077. DOI:10.1200/JCO.1994.12.10.2071 |
| [17] |
赵峰, 陆中杰, 姚国荣, 等. 深吸气屏气技术在左侧乳腺癌保乳术后放疗中的应用[J]. 中华放射医学与防护杂志, 2017, 37(11): 821-825. Zhao F, Lu ZJ, Yao GR, et al. Application of deep inspiration breath hold in postoperative radiotherapy for left-side breast cancer[J]. Chin J Radiol Med Prot, 2017, 37(11): 821-825. DOI:10.3760/cma.j.issn.0254-5098.2017.11.004 |
 2023, Vol. 43
2023, Vol. 43


