头颈部鳞癌(HNSCC)由于其病变部位隐蔽,而且缺乏特异性指标,早期难以发现,约2/3的患者就诊时为中晚期,治疗以手术及术后放疗为主[1]。虽然目前已经证明人乳头瘤病毒(HPV)阳性、P53基因、表皮生长因子受体(EGFR)、血管内皮生长因子(VEGF)等基因与HNSCC的预后相关,并进行相关的干预治疗,但这部分患者仍然有40%~50%的复发和转移[2]。因此,如何降低局部晚期HNSCC的局部复发和远处转移率,是一项非常严峻的挑战。近期有不少研究发现NKT细胞亚群影响肿瘤的治疗效果,其显著特征是NK细胞和T细胞生物标志物在细胞表面共表达,在恶性肿瘤中同样具有免疫特性[3-4]。到目前为止,鲜有研究NKT细胞对头颈部鳞癌放疗患者的预后影响。肿瘤异常蛋白(TAP)即为各种恶性肿瘤发生发展过程中在肿瘤细胞表面产生的糖蛋白的总称[5]。它是细胞癌变后基因表达的特异性物质,可以促使正常组织发生恶变,使其侵袭能力、血管生成能力以及转移倾向增加,最终导致癌症的发生发展[6]。国内外已有研究证明TAP可用于食管癌[7]、非小细胞肺癌[8]、宫颈癌[9]等多种肿瘤的早期辅助诊断及疗效评估,而TAP在HNSCC中有>80%的阳性率[10-11]。其临床意义尚需进一步研究。
本研究回顾性分析河南省肿瘤医院收治的101例Ⅲ~ⅣB期头颈部鳞癌患者,探讨NKT细胞和TAP在Ⅲ~ⅣB期HNSCC不同预后中的临床价值。
资料与方法1.临床资料: 选取2019年1月至2021年12月期间在河南省肿瘤医院接受治疗(包括放疗、手术、术后同期放化疗)的病理学诊断为鳞癌的初治HNSCC患者。纳入标准:按照美国癌症联合委员会(American Joint Committee on Cancer, AJCC)第8版分期标准,诊断为Ⅲ~ⅣB期,且卡氏评分≥75分。排除标准:同时合并有其他恶性肿瘤者;未按临床诊疗标准完成治疗者或病例资料不完善者;患有自身免疫性疾病及免疫缺陷疾病,或近期使用免疫抑制剂者。共101例纳入研究,其中口腔癌54例,喉癌42例,下咽癌5例(表 1)。
|
|
表 1 101例Ⅲ~ⅣB期头颈部鳞癌患者的临床特征 Table 1 Clinical characteristics of 101 patients with stage Ⅲ-ⅣB head and neck squamous cell carcinoma |
2.NKT细胞及TAP采集分析及结果评价:患者清晨空腹静脉血送检,将抽取的2 ml静脉血装在含有EDTA-K2的试管中,然后在3 h内进行处理。使用流式细胞仪检测,将NKT细胞亚群(CD3+CD16+CD56+)评价结果:0~6.5%为正常表达,6.5%~12%为中表达,≥12%为高表达。TAP检测为凝集法,在载玻片上推制薄厚均匀的血片,静置待干后加入TAP检测试剂,在高倍镜下观察并计算TAP凝聚面积。TAP凝聚面积评价结果:0~121 μm2为阴性,121~ 225 μm2为弱阳性,≥225 μm2为强阳性。
3.治疗:患者均接受了放射治疗,常规分割模式放疗1.8~2.2 Gy/次,放疗剂量:GTV/GTVnd:66~70 Gy, 高危区CTV:60 Gy, 低危区CTV:50~54 Gy。其中,66例患者放疗前进行手术,25例行同步放化疗,化疗方案是单药顺铂(70 mg/m2,每21天为1个周期)15例,顺铂+氟尿嘧啶(顺铂70 mg/m2,氟尿嘧啶750 mg/m2,每21天为1个周期)7例,同期西妥昔单抗(250 mg/m2) 治疗3例,平均化疗周期3个(2~4个)。
4.随访:通过门诊、住院、电话等方式进行,在治疗后前2年每3~4个月一次,第3~5年每6个月一次,在5年之后每年一次。每次随访包括专科体检及影像学检查(头颈部MRI/CT、胸部CT、腹部B超)。随访截止日期为2023年2月28日,中位随访时间为30(15~54)个月。主要观察指标:局部区域无复发生存(local-regional recurrence-free survival,LRRFS)、无远处转移生存(distant metastasis-free survival,DMFS)、无进展生存(progression-free survival,PFS)、总生存(overall survival,OS)。其中,PFS指自临床病例确诊日至肿瘤出现进展或因肿瘤死亡的时间。不良反应评价采用不良事件常用术语评定标准4.0版。
5.统计学处理:采用SPSS 26.0软件进行分析。χ2或Fisher′s精确概率法进行组间比较,Kaplan-Meier法进行生存分析,Cox模型进行多因素预后分析, Pearson相关性分析比较NKT细胞与TAP的相关性。P<0.05为差异有统计学意义。
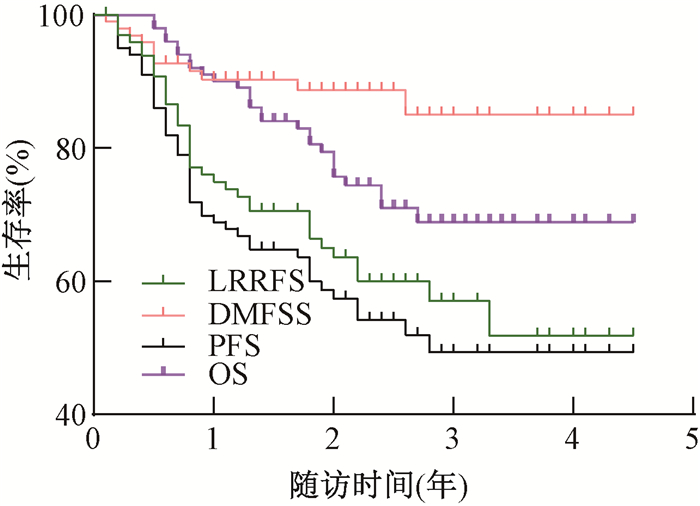
结果1.总体疗效:至随访结束,局部复发37例(36.6%),远处转移11例(10.9%),局部复发伴远处转移3例(3.0%),死亡27例(26.7%)。中位生存时间为25个月(6~54个月),1年LRRFS、DMFS、PFS、OS率分别为76.2%、91.1%、69.3%、90.1%,2年LRRFS、DMFS、PFS、OS率分别为67.3%、90.1%、59.4%、77.2%,3年LRRFS、DMFS、PFS、OS率分别为64.4%、89.1%、55.4%、73.3%。总生存曲线见图 1。
|
注:LRRFS. 局部区域无复发生存;DMFS. 无远处转移生存;PFS. 无进展生存;OS. 总生存 图 1 101例Ⅲ~ⅣB期头颈部鳞癌患者放疗的生存曲线 Figure 1 Survival curves of 101 patients with stage Ⅲ-ⅣB head and neck squamous cell carcinoma treated with radiotherapy |
2.各因素在不同生存分层中的结果:结果列于表 2。单因素分析结果显示,年龄、是否手术、N分期、TNM分期、NKT细胞比例及TAP是3年OS率的影响因素(χ2=4.55、5.90、13.86、4.99、7.75、11.16,P<0.05);性别、N分期、TNM分期及TAP是3年PFS率的影响因素(χ2=4.34、21.86、8.49、18.11,P<0.05);性别、N分期、TNM分期及TAP是3年LRRFS率的影响因素(χ2=6.32、19.89、4.63、18.00,P<0.05)。
|
|
表 2 主要因素在Ⅲ~ⅣB期HNSCC不同生存中的结果 Table 2 Results of major factors in different survival rates of stage Ⅲ-ⅣB HNSCC |
3.Cox多因素预后分析:结果列于表 3。由表 3可知,年龄、TAP、NKT细胞为3年OS率独立预后影响因素(HR=2.35、2.27、2.02,P=0.048、0.041、0.002),性别、N分期及TAP是3年PFS率和3年LRRFS率的独立预后影响因素(HR=2.29、1.80、2.32,P=0.024、0.021、0.010;HR=3.00、2.27、2.56,P=0.006、0.007、0.010)。
|
|
表 3 101例Ⅲ~ⅣB期HNSCC多因素Cox回归分析 Table 3 Multivariate Cox regression analysis for 101 patients with stage Ⅲ-ⅣB HNSCC |
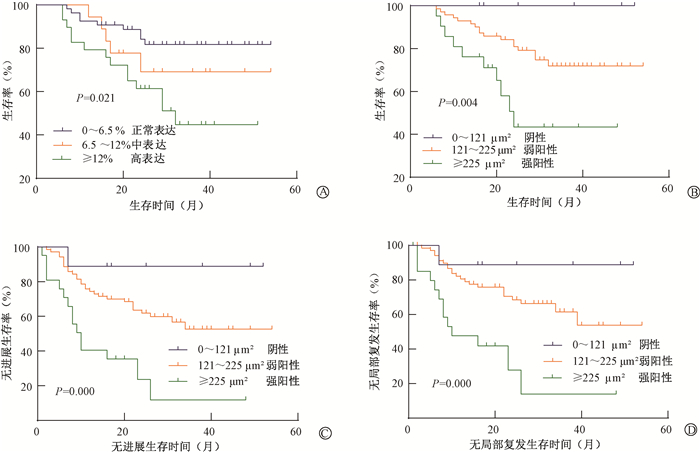
4.放疗前不同NKT细胞所占比例及TAP对预后影响的生存分析:结果示于图 2,表明NKT细胞水平越高,患者生存越差,在0~6.5%水平时患者生存最佳。TAP水平越高,患者总生存、无进展生存及局部复发生存越差。
|
注:OS.总生存;PFS.无进展生存;LRRFS.无局部复发生存 图 2 101例头颈部鳞癌患者放疗前NKT细胞比例与OS的关系(A);TAP凝聚面积分别与OS(B)、PFS(C)、LRRFS(D)的关系 Figure 2 The relationship between NKT cell proportion and OS before radiotherapy(A), and the relationship between TAP cohesion area and(B), PFS(C), LRRFS(D)before radiotherapy |
5.进一步亚组分析:将32例患者放疗前后NKT细胞变化及50例患者放疗前后TAP变化分别分为放疗后升高组和放疗后降低组,用Kaplan-Meier法分析对生存的影响,并采用Log-rank法单因素分析。结果显示,放疗后NKT细胞升高组,3年的OS、PFS均高于降低组(χ2=4.49,P=0.034;χ2=9.20,P=0.002);放疗后TAP凝聚面积升高组,3年PFS率明显低于降低组,而OS两组差异无统计学意义(表 4)。
|
|
表 4 头颈部鳞癌患者单因素分析结果 Table 4 Univariate analysis results of patients with head and neck squamous cell carcinoma. |
6.NKT细胞与TAP凝聚面积的相关性:将放疗前NKT细胞所占比例与TAP凝聚面积进行Pearson关联性分析,结果显示,NKT细胞与TAP呈正相关(r=0.26,P=0.009)。
讨论头颈部鳞癌是常见的恶性肿瘤之一,尽管近年来采取了积极的治疗方案,包括手术、化疗和放疗的综合方案,但5年总生存率(OS)仍仅为40%~50%,在过去几十年中几乎没有改善[12]。HNSCC因其部位特殊,60%患者就诊时已为局部晚期,并且其会给患者带来疼痛、容貌毁损、功能障碍、心理伤害等后果。其最重要的风险因素是吸烟、酗酒和持续感染HPV[13],但即使在相同条件及临床分期情况下,患者的总生存率和复发转移的风险仍存在异质性。因此,筛选出有预后不良及容易发生复发转移的高危患者的分子生物学指标,是目前研究的热点。
NKT细胞是一群表面既有T细胞受体(TCR)又有NK细胞受体的特殊T细胞亚群,目前研究普遍认为Ⅰ型NKT或不变NKT(iNKT)细胞介导抗肿瘤作用有效,而Ⅱ型NKT细胞具有抑制肿瘤免疫的调节功能[14],两者相互作用共同参与肿瘤免疫。本研究结果显示,放疗前NKT细胞水平低组较高组有较好的OS,发现处于0~6.5%之间3年OS率最高(81.9%),且纳入多种因素分析是独立预后影响因素(P=0.002)。有学者发现,NKT细胞与抗肿瘤潜力相反,NKT细胞数量较高患者OS和无病生存期(DFS)更差[4, 15]。本研究与之结果相似,说明本研究中Ⅱ型NKT细胞可能是占据主导水平。但是一项前瞻性研究发现,在HNSCC中循环iNKT细胞水平高,患者3年OS、疾病特异性生存率(DSS)、局部控制率(LRC)较长,在校正了混杂因素后,其仍是独立预后参数[16]。本研究结果与其不一致,说明NKT细胞在肿瘤中的作用值得进一步探讨和研究。
糖基化是组织蛋白质成熟以及发挥生物学作用的重要步骤,糖基化反应是在糖基酶的催化下产生的一系列的聚糖,有证据表明TAP与Ki-67、TP53和CDH1基因突变有关,通过改变糖基酶使糖基化产生不完全或激活新的糖基化[5]。国内外很多研究发现,TAP可以作为癌症的早期诊断和预后评估的一种新的肿瘤标志物。Cheng等[7]发现与体检正常者相比,食管鳞状细胞癌患者TAP表达明显更高,且在手术后显著下调,多变量生存分析显示,TAP的高表达与OS较差相关。有研究发现,在接受根治性肝切除术的肝细胞癌(HCC)患者中,术前TAP较低组的无复发生存率(RFS)显著高于TAP高组(P<0.05)[17]。本研究结果与其类似,放疗前TAP凝聚面积越低患者OS、PFS及LRRFS越长(P<0.05),且处于0~121 μm2时3年OS、PFS及LRRFS率最高,分别是100%、88.9%和88.9%,且纳入一般因素后仍是独立预后影响因素。
先前少有研究探索放疗前后NKT细胞及TAP变化与预后的关系。本研究显示,放疗后NKT细胞升高组3年OS、PFS率较高,TAP降低组3年PFS率较高。这表明放疗不仅具有局部破坏细胞DNA达到杀伤肿瘤的作用,而且会引发全身应激、炎症及免疫反应。有学者通过对外周血细胞中放疗反应基因的表达检测,发现在HNSCC中放疗诱导的全身效应增强了免疫抑制表型,并且这些表型在放疗完成后至少持续1个月[18]。有研究显示,TAP水平下降≥25%的患者PFS和OS较好[19]。本研究结果与这一结论相似。通过了解放疗对机体免疫系统及TAP的影响,可以优化治疗方案,并可作为预测患者预后分层的一种简便方式。
本研究发现放疗前NKT细胞处于正常组(0~6.5%)及TAP处于阴性(0~121 μm2)时,预后最好,随着NKT细胞及TAP的升高,患者预后逐渐变差。因此,本研究将放疗前NKT细胞与TAP相关联,得出NKT细胞与TAP呈正相关。说明NKT细胞与TAP相结合或许有助于提高预测患者生存期的准确性,但目前为止鲜有相关性研究探讨两者的关系,有待进一步研究证实。
总之,机体外周血NKT细胞及TAP检测是简单方便、快捷廉价的常规检查。本研究中头颈部鳞癌的放疗前NKT细胞水平与TAP凝聚面积及其变化可以预测患者预后生存状况,放疗前NKT细胞及TAP较高、放疗后NKT细胞降低及TAP升高患者预后越差。定期复查淋巴细胞及TAP水平,可有助于临床诊疗时发现预后不佳、高风险患者,及时调整治疗方案并对其免疫系统做出干预措施。
本研究的局限性为单中心回顾性病例分析,对放疗前后外周血TAP及NKT细胞检测,病例数较少,没有考虑同步放化疗、靶向治疗等相关因素的影响。将来考虑开展多中心外周血TAP及NKT样细胞对临床价值影响的前瞻性研究,明确NKT细胞和TAP的变化在Ⅲ~ⅣB期头颈部鳞癌中的临床意义。
利益冲突 无
作者贡献声明 贺家琪负责数据收集、论文撰写及统计分析;孙学明、黄蓉及卢晓旭负责设计实验及论文修改;董俊雅负责收集数据;吴慧指导论文撰写及修改
| [1] |
Chow L. Head and neck cancer[J]. N Engl J Med, 2020, 382(1): 60-72. DOI:10.1056/NEJMra1715715 |
| [2] |
许婷婷, 胡超苏, 李宝生. 抗EGFR单抗治疗局部晚期头颈部鳞状细胞癌临床共识(2023年版)[J]. 中国癌症杂志, 2023, 33(1): 81-94. Xu TT, Hu CS, Li BS. Clinical consensus on the treatment of locally advanced squamous cell carcinoma of the head and neck with antiEGFR monoclonal antibody (2023 edition)[J]. China Oncol, 2023, 33(1): 81-94. DOI:10.19401/j.cnki.1007-3639.2023.01.010 |
| [3] |
Liao YM, Hung TH, Tung JK, et al. Low expression of IL-15 and NKT in tumor microenvironment predicts poor outcome of MYCN-non-amplified neuroblastoma[J]. J Pers Med, 2021, 11(2): 122. DOI:10.3390/jpm11020122 |
| [4] |
Vela-Ojeda J, Perez-Retiguin F, Olivas-Bejarano AC, et al. Clinical relevance of NKT cells and soluble MIC-A in Hodgkin lymphoma[J]. Leuk Lymphoma, 2021, 62(4): 801-809. DOI:10.1080/10428194.2020.1852473 |
| [5] |
Gu C, Xie L, Li B, et al. Quantification of tumor abnormal proteins in the diagnosis and postoperative prognostic evaluation of gastric cancer[J]. Clin Med Insights Oncol, 2022, 16: 11795549221104440. DOI:10.1177/11795549221104440 |
| [6] |
Wei T, Liu Q, He F, et al. The role of N-acetylglucosaminyltransferases V in the malignancy of human hepatocellular carcinoma[J]. Exp Mol Pathol, 2012, 93(1): 8-17. DOI:10.1016/j.yexmp.2012.01.011 |
| [7] |
Cheng Y, Fang Q, Chen Y, et al. High expression of tumor abnormal protein preoperatively predicts poor prognosis of patients with esophageal squamous cell Carcinoma[J]. Front Surg, 2021, 8: 609719. DOI:10.3389/fsurg.2021.609719 |
| [8] |
Cheng Y, Chen Y, Zang G, et al. Increased expression of TAP is predictive of poor prognosis in patients with non-small cell lung cancer[J]. Cancer Manag Res, 2020, 12: 1941-1946. DOI:10.2147/CMAR.S239593 |
| [9] |
覃小敏, 邢辉, 李琳, 等. 血清TAP、bFGF及CDCA5在老年宫颈癌患者中表达水平及其与预后的关系[J]. 中国老年学杂志, 2022, 42(12): 2893-2896. Qin XM, Xing H, Li L, et al. Serum TAP, bFGF and CDCA5 expression levels in elderly cervical cancer patients and their relationship with prognosis[J]. Chin J Gerontol, 2022, 42(12): 2893-2896. DOI:10.3969/j.issn.1005-9202.2022.12.012 |
| [10] |
李艳杰. 肿瘤异常蛋白(TAP)检测在人喉癌诊断中的临床价值研究[D]. 郑州: 郑州大学, 2021. Li YJ. Study on the clinical diagnostic value of tumor abnormal protein (TAP) detection in human laryngeal carcinoma [D]. Zhengzhou: Zhengzhou University, 2021. |
| [11] |
张帅源. 口腔鳞状细胞癌外周血肿瘤异常蛋白(TAP)与循环肿瘤细胞(CTCs)的检测及其临床意义[D]. 郑州: 郑州大学, 2021. Zhang SY. Detection of peripheral blood circulating tumor abnormal protein (TAP) and circulating tumor cells (CTCs) in oral squamous cell carcinoma and its clinical significance [D]. Zhengzhou: Zhengzhou University, 2021. |
| [12] |
Marur S, Forastiere AA. Head and neck cancer: changing epidemiology, diagnosis, and treatment[J]. Mayo Clin Proc, 2008, 83(4): 489-501. DOI:10.4065/83.4.489 |
| [13] |
Leemans CR, Snijders P, Brakenhoff RH. The molecular landscape of head and neck cancer[J]. Nat Rev Cancer, 2018, 18(5): 269-282. DOI:10.1038/nrc.2018.11 |
| [14] |
Terabe M, Berzofsky JA. The role of NKT cells in tumor immunity[J]. Adv Cancer Res, 2008, 101: 277-348. DOI:10.1016/S0065-230X(08)00408-9 |
| [15] |
Jamal E, Azmy E, Ayed M, et al. Clinical impact of percentage of natural killer cells and natural killer-like T cell population in acute myeloid leukemia[J]. J Hematol, 2020, 9(3): 62-70. DOI:10.14740/jh655 |
| [16] |
Molling JW, Langius JA, Langendijk JA, et al. Low levels of circulating invariant natural killer T cells predict poor clinical outcome in patients with head and neck squamous cell carcinoma[J]. J Clin Oncol, 2007, 25(7): 862-868. DOI:10.1200/JCO.2006.08.5787 |
| [17] |
Cai H, Li W, Zhang Y, et al. Preoperative tumor abnormal protein is a promising biomarker for predicting hepatocellular carcinoma oncological outcome following curative resection[J]. J Cancer Res Ther, 2022, 18(7): 2021-2026. DOI:10.4103/jcrt.jcrt_58_22 |
| [18] |
Balázs K, Kis E, Badie C, et al. Radiotherapy-induced changes in the systemic immune and inflammation parameters of head and neck cancer patients[J]. Cancers (Basel), 2019, 11(9): 1324. DOI:10.3390/cancers11091324 |
| [19] |
Wu FT, Wu W, Li XT, et al. Tumor abnormal protein level predicts disease response and progression of diffuse large B-cell lymphoma in the rituximab era[J]. Clin Lab, 2019, 65(12). DOI:10.7754/Clin.Lab.2019.190631 |
 2023, Vol. 43
2023, Vol. 43


