放疗是肝细胞癌(hepatocellular carcinoma cell, HCC)主要的治疗方法之一。电离辐射可诱导细胞发生铁死亡[1],铁死亡是一种铁依赖性的有别于其他细胞程序性死亡的方式[2],其本质是谷胱甘肽的耗竭,谷胱甘肽过氧化物酶(GPX4)活性下降,脂质氧化物不能通过GPX4催化的谷胱甘肽还原酶反应代谢,二价的铁离子氧化脂质产生活性氧,从而促使铁死亡的发生。lncRNA(long noncoding RNAs)是一类长度超过200个核苷酸且缺乏蛋白质编码能力的lncRNA,可通过不同机制参与肿瘤的发生发展[3-6]。
前期通过对接受立体定向放疗(SBRT)治疗的HCC患者进行随访和血样采集[7],经过转录组分析,首次发现反义lncRNA PRMT5-AS1在SBRT治疗后显著增加,表明PRMT5-AS1可能是放疗后HCC的预后生物标志物。此外还发现电离辐射可诱导MHCC-97H和HepG2细胞发生铁死亡[8]。本研究旨在探讨lncRNA PRMT5-AS1在HCC放射抵抗中的效应机制。
材料与方法1.主要试剂与仪器:SLC7A11抗体购自美国Cell Signaling公司;GAPDH抗体购自美国Proteintech公司;二抗为山羊抗兔IgG(H+L)-HRP结合物和羊抗鼠抗体(H+L)-HRP偶联物,购自加拿大Bio-Rad公司;CCK-8试剂盒购自日本Dojindo公司;荧光素酶检测试剂盒购自美国BioVision公司;TRIzol、SYBR PreMix Ex Taq Ⅱ、PrimeScriptTMRTMaster Mix均购自日本TaKaRa公司;免疫印迹化学发光(ECL)溶液购自美国Thermo Fisher Science公司。细胞培养箱购自日本Yamato Scientific公司;流式细胞仪(ACEA NovoCyte)购自杭州艾森生物有限公司;Western blot电泳仪购自加拿大Bio-RAD公司;化学发光成像系统购自上海勤翔科学仪器有限公司;全波长酶标仪购自美国Molecular Devices公司;双荧光素酶报告基因分析系统购自美国Promega公司;QuantStudio实时PCR仪购自美国Thermo Fisher Science公司。
2.细胞培养、受照条件及分组:人肝癌细胞系MHCC-97H、Huh7、HepG2、正常肝细胞LO2和人胚胎肾细胞HEK293T均购自中国科学院细胞库。细胞在Eagle′s混合液中培养,添加10%胎牛血清和1%青霉素/链霉素在37℃、5%CO2的加湿培养箱中培养。使用X射线辐照仪(X-RAD 320IX,Precision X-ray,美国),设置10 cm×10 cm照射野,源靶距50 cm,以3 Gy/min的剂量率将细胞暴露于10 Gy电离辐射。MHCC-97H细胞:过表达对照Vector组、过表达PRMT5-AS1组、Vector+IR组、过表达PRMT5-AS1+IR组(组1~4);HepG2细胞:敲低对照siNC组、敲低PRMT5-AS1组、siNC+IR组、敲低PRMT5-AS1+IR组(组5~8)。
3.CCK-8法检测细胞活力:用CCK-8试剂盒测定细胞存活率。将细胞接种于96孔板中(2×103/孔),24 h后使用铁死亡激活剂Erastin药物处理(MHCC-97H加入20 μmol/L,HepG2 40 μmol/L),于培养箱中孵育24 h。每孔加入CCK-8,孵育3 h,用全波长酶标仪在450 nm波长处记录吸光度(A)值。计算细胞增殖率的公式为:细胞活力(%)=(A实验组-A空白)/(A对照组-A空白)×100%。MHCC-97H:Vector组、PRMT5-AS1组、Vector+Erastin组、PRMT5-AS1+Erastin组;HepG2:siNC组、siPRMT5-AS1组、siNC+Erastin组、siPRMT5-AS1+Erastin组。
4.流式细胞术:用流式细胞术观察台盼蓝溶液染色的细胞死亡情况。细胞接种于6孔板(8 ×104/孔),10 Gy X射线照射。72 h收集细胞,在4℃,1 500 r/min离心5 min,离心半径为15 cm。细胞用1 ml磷酸盐缓冲液(PBS)洗涤2次,最后加入20 μl PBS吹匀,台盼蓝染色3 min,流式细胞仪抽取20 μl,停止条件:1×104细胞数,检测细胞死亡。
5.脂质过氧化水平检测:取2 × 105个细胞铺板,48 h后检测脂质过氧化水平,用2.5%胰酶消化2~3 min,1 ml PBS洗涤2次,4℃ 1 500 r/min,离心5 min,离心半径15 cm。加入含5 μmol/l BODIPY581/591C11的PBS混合液1 ml,37℃避光孵育30 min。后1 ml PBS洗涤2次,4℃ 1 500 r/min,离心5 min,离心半径15cm。然后在0.2 ml的PBS中重悬细胞,进行流式细胞仪分析,每组至少分析2 × 104个细胞。MHCC-97H:Vector组、PRMT5-AS1组、Vector+IR组、PRMT5-AS1+IR组;HepG2:siNC组、siPRMT5-AS1组、siNC+IR组、siPRMT5-AS1+IR组。
6.细胞转染:将细胞接种于所需培养皿中,使贴壁细胞密度达到30%~50%,利用Lipofectamine 2000转染试剂,配制转染工作液,A液:10 μl Lipofectamine 2000和250 μl基础培养基,B液:10 μl siNC/siPRMT5-AS1和250 μl基础培养基,配置A、B液后分别静置5 min,将B液逐滴加到A液中,混匀后在室温下静置15 min,将混合液逐滴加入至培养皿中,混合均匀后置于37℃、5% CO2细胞培养箱中继续培养,6 h后加入10%血清,12~18 h更换完全培养基,转染48 ~72 h后收细胞进行转染效果鉴定以及后续实验。
7.双荧光素酶报告基因检测:将带有let-7c-5p结合位点的SLC7A11 3’UTR和lncRNA PRMT5-AS1基因片段插入到pMIR载体中。将重组载体PMIR-PRMT5-AS1、PMIR-PRMT5-AS1-MUT、PMIR-SLC7A11 3’UTR和PMIR-SLC7A11 3’UTR-MUT分别与let-7c-5p和mimic NC共转染HEK293 T细胞,48 h后收集细胞并裂解。使用荧光素酶检测试剂盒检测相对光单位(RLU),并以Renilla荧光素酶活性为内参照。使用双荧光素酶报告基因分析系统进行荧光素酶报告基因检测。相对荧光素酶活性用萤火虫荧光素酶的RLU值与雷尼拉荧光素酶的RLU值之比表示。
8.实时荧光定量PCR(qRT-PCR):引物如表 1所示,利用2-ΔΔCt计算相对表达水平。用TRIzol提取细胞总RNA,PrimeScriptTMRTMaster Mix进行反转录。使用SYBR PreMix Ex Taq Ⅱ在QuantStudio实时PCR仪上进行qRT-PCR。热循环条件如下:95℃ 30 s,95℃ 5 s,60℃ 30 s,分别循环40次。
|
|
表 1 RT-PCR引物序列 Table 1 RT-PCR primer sequence |
9.蛋白印迹分析:使用刮刀收集细胞后,根据细胞沉淀量加入RIPA缓冲液4℃裂解30 min。总蛋白经12%十二烷基硫酸钠-PAGE胶(SDS-PAGE)分离后转移到聚偏二氟乙烯(PVDF)膜上。在室温下用6%脱脂牛奶在Tris-buffer生理盐水-吐温(TBST)中封闭1 h后,在4℃下与一抗孵育过夜(1∶5 000),TBST洗涤5 min × 3次,然后在室温下与二抗孵育1 h(1 ∶10 000)。
10.统计学处理:采用SPSS 22.0软件进行统计分析。数据符合正态分布且方差齐,实验结果以 x±s表示。两组间比较采用独立样本t检验,单因素方差分析和BonferroniPost法进行多组间比较,采用Kaplan-Meier法绘制生存曲线。P<0.05为差异具有统计学意义。
结果1.PRMT5-AS1在HCC中高表达并抑制电离辐射诱导的细胞死亡:检测3种HCC细胞MHCC-97H、Huh7、HepG2和正常肝细胞LO2中PRMT5-AS1的基础表达,分别为2.16、5.71、7.03和1.00,表明相比于正常肝细胞,HCC细胞中PRMT5-AS1基因的表达显著上调。
为了确定PRMT5-AS1是否参与电离辐射诱导的细胞死亡,在MHCC-97H细胞中构建PRMT5-AS1的过表达模型,过表达效率为47.85,在HepG2细胞中构建敲低模型,敲低效率为0.51。流式细胞术发现MHCC-97H细胞中,组1~4的死亡率分别为4.81%、3.11%、27.57%和18.30%,表明与对照组相比过表达PRMT5-AS1能够显著降低电离辐射引起的细胞死亡(t=14.94,P<0.05)。在HepG2中组5~8的死亡率分别为6.58%、12.76%、17.26%和28.26%,表明敲低PRMT5-AS1则引起相反的结果(t=13.63,P<0.05)。提示PRMT5-AS1能够抑制电离辐射诱导的HCC细胞死亡情况。
2.PRMT5-AS1通过SLC7A11抑制电离辐射诱导的HCC细胞铁死亡:为确定PRMT5-AS1是否参与调控肝癌细胞发生铁死亡,通过流式细胞术检测细胞内的脂质ROS,发现过表达PRMT5-AS1能够明显抑制由电离辐射所造成的细胞内脂质ROS水平的增加(t=12.80,P<0.05,表 2),而敲低PRMT5-AS1可以显著增加脂质ROS(t=5.93,P<0.05,表 3)。CCK-8实验表明高表达的PRMT5-AS1能够显著增强细胞活性(t=4.85,P<0.05,表 2),而敲低PRMT5-AS1则促进了Erastin抑制细胞活性的作用(t=11.01,P<0.05,表 3)。上述结果表明,在电离辐射诱导HCC细胞发生铁死亡的过程中,lncRNA PRMT5-AS1可能是通过胱氨酸/谷氨酸转运受体(system Xc-)发挥调控作用。
|
|
表 2 MHCC-97H细胞的脂质过氧化、细胞活力、mRNA表达量(x±s) Table 2 The lipid ROS, cell viability fraction and relative mRNA expression of MHCC-97H (x±s) |
|
|
表 3 HepG2细胞的脂质过氧化、细胞活力和mRNA表达量(x±s) Table 3 The lipid ROS, cell viability fraction and relative mRNA expression of HepG2 (x±s) |
进一步检测两种PRMT5-AS1不同表达水平的细胞模型受照后SLC7A11蛋白和mRNA的表达情况。结果表明,过表达PRMT5-AS1能够明显提高SLC7A11的蛋白和mRNA水平(t=26.24,P<0.05,图 1,表 2);而敲低PRMT5-AS1之后则相反,SLC7A11的蛋白和mRNA均有较大程度降低(t=4.86,P<0.05,图 1,表 3)。综合上述结果可发现,PRMT5-AS1通过上调SLC7A11抑制电离辐射诱导的铁死亡过程。
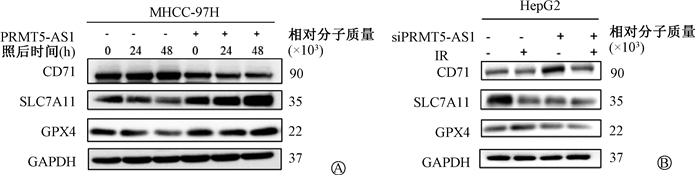
|
图 1 PRMT5-AS1通过SLC7A11抑制电离辐射诱导的HCC细胞铁死亡A. MHCC-97H;B. HepG2 Figure 1 PRMT5-AS1 inhibits IR induced ferroptosis in HCC through SLC7A11 A. MHCC-97H;B. HepG2 |
3.PRMT5-AS1与let-7c-5p作为竞争性内源RNA(ceRNA)调控SLC7A11:对TCGA数据库中所有的microRNA和线上数据库DIANA(http://ualcan.path.uab.edu/) 中预测的能与PRMT5-AS1结合的microRNA取交集,发现3个microRNA:let-7a-5p、let-7c-5p、let-7 d-5p能同时符合上述两个条件,而仅有let-7c-5p的差异具有统计学意义(t=9.31,P<0.05,图 2)。通过荧光定量PCR证实,过表达PRMT5-AS1后let-7c-5p的相对表达为0.64,而敲低PRMT5-AS1后相对表达为2.89,表明PRMT5-AS1与let-7c-5p之间是负相关的(t=5.16、12.57,P<0.05)。因此,上述PRMT5-AS1与let-7c-5p这种相关性表明两者之间很有可能存在ceRNA的作用机制。
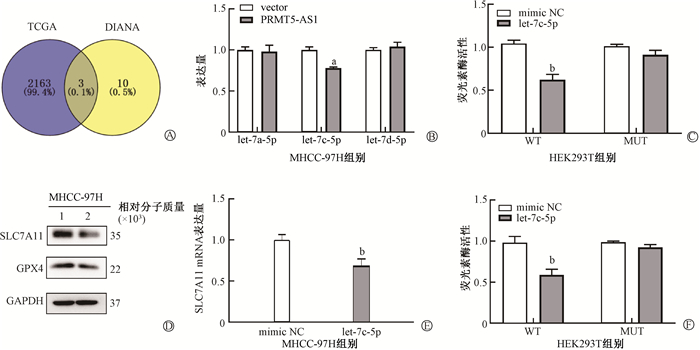
|
注:a与vector比较,t=9.31,P<0.05;b与mimic NC比较,t=9.74、5.11、6.67,P<0.05。1.mimic NC; 2.let-7c-5p 图 2 PRMT5-AS1与let-7c-5p作为ceRNA调控SLC7A11 A. TCGA和DIANA数据库维恩图;B. qRT-PCR检测相对表达量;C. 荧光素酶报告基因实验;D. Western blot检测基因表达;E. qRT-PCR检测SLC7A11相对表达量;F. 荧光素酶报告基因实验 Figure 2 PRMT5-AS1 and let-7c-5p act as ceRNAs to regulate SLC7A11 A. TCGA and DIANA database Venn diagram; B. qRT PCR detection of relative expression level; C. Luciferase report gene experiment; D. Western blot was used to detect gene expression; E. qRT PCR detection of relative expression level of SLC7A11; F. Luciferase report gene experiment |
进一步在RNA22网站查询到PRMT5-AS1与let-7c-5p有结合位点,对其进行突变,利用荧光素酶报告基因实验验证其是否结合,结果显示,过表达let-7c-5p后减少了PMIR-GLO-PRMT5-AS1-WT质粒的荧光素酶活性(t=9.74,P<0.05,图 2),而PMIR-GLO-PRMT5-AS1-MUT质粒的荧光素酶活性变化无明显差异(P>0.05,图 2)。以上结果表明,PRMT5-AS1可以与let-7c-5p形成ceRNA网络,对下游靶基因进行调控。通过Western blot和荧光定量PCR也证实let-7c-5p与SLC7A11之间可能存在调控关系(t=5.11,P<0.05,图 2)。同样的,在RNA22网站查询到SLC7A11与let-7c-5p存在结合位点,并对其进行突变后,通过荧光素酶报告基因实验证明let-7c-5p与SLC7A11的3’UTR区域能够结合(t=6.67,P<0.05,图 2)。以上结果证实,PRMT5-AS1通过与let-7c-5p形成ceRNA网络靶向调节SLC7A11,从而调节铁死亡。
4.lncRNA PRMT5-AS1/let-7c-5p/SLC7A11轴调控由电离辐射诱导的细胞死亡:进一步探讨lncRNA PRMT5-AS1/let-7c-5p/SLC7A11轴对HCC细胞的影响。研究发现,let-7c-5p能够逆转过表达PRMT5-AS1对SLC7A11蛋白表达(图 3)和脂质ROS(t=4.84、3.01,P<0.05)以及细胞死亡情况的调控作用(t=17.93、4.11,P<0.05,表 4)。而敲低SLC7A11能够逆转PRMT5-AS1引起的脂质ROS(t=10.35、21.35,P<0.05)和细胞死亡减少的抑制情况(t=14.94、7.15,P<0.05,表 4)。
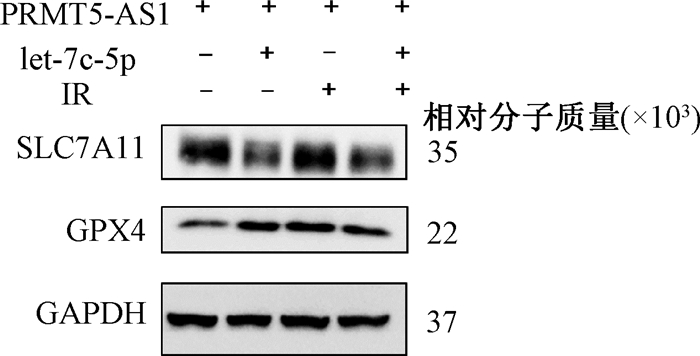
|
图 3 Western Blot检测let-7c-5p对PRMT5-AS1调控铁死亡相关蛋白表达的影响 Figure 3 Western Blot analysis of the effect of let-7c-5p on the expression of ferroptosis related protein regulated by PRMT5-AS1 |
|
|
表 4 MHCC-97H细胞不同组别脂质过氧化率及细胞死亡率(%,x±s) Table 4 The lipid ROS and cell death of different MHCC-97H cells (%, x±s) |
综上所述,PRMT5-AS1可以作为ceRNA吸附let-7c-5p,从而使胞质中游离的microRNAs降解,继而减少了对SLC7A11的降解,从而抑制细胞内脂质ROS而减少铁死亡的发生(图 4)。
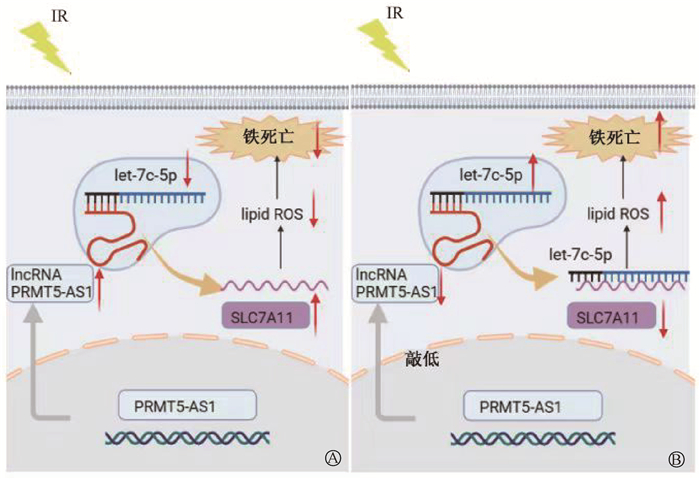
|
注:黑色箭头为促进表达;红箭头为抑制产生 图 4 PRMT5-AS1在电离辐射诱导HCC细胞铁死亡中作用的机制图A. 肝癌细胞;B. 敲低PRMT5-AS1的肝癌细胞 Figure 4 Mechanistic diagram reflecting the role of PRMT5-AS1 in IR-induced ferroptosis in HCC A. Hepatocellular carcinoma cell; B. PRMT5-AS1 knockdown in hepatocellular carcinoma cells |
讨论
HCC是一种常见的恶性肿瘤疾病,临床上多采用手术、放射治疗和化疗相结合的治疗方法[9]。随着个性化医疗的出现,近年来开发出了多种分子靶向药物[10]。然而,目前放疗仍存在一定局限性,如辐射抗性等。因此,发现新的生物标志物作为抗肿瘤放射治疗的靶点至关重要。
蛋白质精氨酸甲基转移酶(protein arginine methyltransferase, PRMT)家族的蛋白质通过甲基化精氨酸残基作为翻译后修饰物。蛋白精氨酸甲基转移酶5(PRMT5)是负责靶蛋白上精氨酸残基对称二甲基化的主要酶,它在多种过程中发挥功能性作用,包括转录调控和细胞周期调控[11]。lncRNA PRMT5-AS1是PRMT5的反义lncRNA,与PRMT5在3’UTR区域有重叠部分。lncRNA根据细胞内的亚细胞定位情况,可有多种调控方式[12-14]。根据PRMT5-AS1的序列,在lncLocator (http://www.csbio.sjtu.edu.cn/) [15]预测PRMT5-AS1的亚细胞定位,发现PRMT5-AS1在胞质、胞核中均有表达,胞质评分为0.78,胞核评分为0.18,表明PRMT5-AS1主要分布于细胞质中。本研究主要探究了PRMT5-AS1在电离辐射诱导的HCC细胞死亡中发挥的作用。
PRMT5-AS1能够抑制电离辐射诱导的HCC细胞发生铁死亡。通过线上数据库以及RT-PCR实验发现PRMT5-AS1在HCC组织中高表达,推测PRMT5-AS1可能作为放射治疗的潜在靶点。通过台盼蓝流式细胞术和CCK-8实验发现,高表达的PRMT5-AS1能够增强细胞活力,减少由电离辐射造成的细胞死亡。流式细胞术检测PRMT5-AS1对细胞内脂质ROS的影响,结果显示,PRMT5-AS1可以抑制电离辐射所造成的脂质ROS的增加,表明PRMT5-AS1通过降低脂质ROS进而抑制铁死亡的水平。Erastin能通过抑制非依赖性的胱氨酸/谷氨酸逆向转运体XC-系统的活性,诱导多种细胞发生铁死亡。此外,改变PRMT5-AS1的表达量时,转运蛋白CD71的蛋白表达水平也发生了一些变化,其中可能提示PRMT5-AS1通过影响CD71的表达情况调控铁死亡的发生,这值得进一步的探讨。本研究发现PRMT5-AS1可通过调控SLC7A11调节XC-系统影响铁死亡,且PRMT5-AS1也可能通过调控CD71的表达影响铁死亡的水平,这可作为下一步对PRMT5-AS1机制探究的一个重要因子。综上,PRMT5-AS1参与了电离辐射诱导的HCC细胞铁死亡。
在肿瘤进展过程中,lncRNAs可与蛋白质和microRNAs同步结合[16]。因此,推测PRMT5-AS1可能通过与microRNAs结合,从而作为ceRNAs的靶向调控互补mRNA。通过荧光素酶报告实验,发现PRMT5-AS1可以海绵吸附let-7c-5p,其靶点是SLC7A11 mRNA,并且PRMT5-AS1与let-7c-5p之间的串扰参与了HCC的辐射抵抗机制。目前仅有少数文献报道let-7c-5p参与细胞死亡的调控机制,有研究表明,let-7c-5p能够参与调控细胞发生凋亡[17],而let-7c-5p与铁死亡之间的关系少见报道。本研究发现let-7c-5p能够靶向抑制了SLC7A11的活性。此外,lncRNA的调控机制复杂,本研究仅探讨了PRMT5-AS1作为ceRNA发挥作用的调控通路,在Starbase数据库中预测lncRNA-RBP,发现PRMT5-AS1可以与一些RBP相结合,通过调控RBP的RNA稳定性或转录水平的调控发挥系列效应。
综上所述,本研究发现lncRNA PRMT5-AS1竞争性地与let-7c-5p结合并释放SLC7A11,从而降低肝癌细胞中的脂质ROS水平,抑制铁死亡的发生。这些发现表明lncRNA PRMT5-AS1是肿瘤进展的关键分子,可能成为肝癌治疗的潜在靶点,为未来的癌症治疗策略提供了有前景的方向。
利益冲突 无
作者贡献声明 叶天霞负责实验设计、实验操作、数据整理、论文撰写;应逸萌负责协助部分实验操作和数据分析;马淑梅、刘晓冬指导实验设计和论文撰写
| [1] |
Jiao Y, Cao F, Liu H. Radiation-induced cell death and its mechanisms[J]. Health Phys, 2022, 123(5): 376-386. DOI:10.1097/HP.0000000000001601 |
| [2] |
Tang D, Kang R, Berghe TV, et al. The molecular machinery of regulated cell death[J]. Cell Res, 2019, 29(5): 347-364. DOI:10.1038/s41422-019-0164-5 |
| [3] |
Wang Z, Wang X, Rong Z, et al. Lncrna linc01134 contributes to radioresistance in hepatocellular carcinoma by regulating dna damage response via mapk signaling pathway[J]. Front Pharmacol, 2021, 12: 791889. DOI:10.3389/fphar.2021.791889 |
| [4] |
Min J, Jin D, Zhang F, et al. DLG1-AS1 is activated by MYC and drives the proliferation and migration of hepatocellular carcinoma cells through miR-497-5p/SSRP1 axis[J]. Cancer Cell Int, 2021, 21(1): 16. DOI:10.1186/s12935-020-01667-0 |
| [5] |
Liu LX, Liu B, Yu J, et al. SP1-induced upregulation of lncRNA CTBP1-AS2 accelerates the hepatocellular carcinoma tumorigenesis through targeting CEP55 via sponging miR-195-5p[J]. Biochem Biophys Res Commun, 2020, 533(4): 779-785. DOI:10.1016/j.bbrc.2020.09.080 |
| [6] |
Yang X, Qu S, Wang L, et al. PTBP3 splicing factor promotes hepatocellular carcinoma by destroying the splicing balance of NEAT1 and pre-miR-612[J]. Oncogene, 2018, 37(50): 6399-6413. DOI:10.1038/s41388-018-0416-8 |
| [7] |
Wen C, Tian Z, Li L, et al. Srsf3 and hnrnph1 regulate radiation-induced alternative splicing of protein arginine methyltransferase 5 in hepatocellular carcinoma[J]. Int J Mol Sci, 2022, 23(23). DOI:10.3390/ijms232314832 |
| [8] |
Feng H, Liu Y, Gan Y, et al. Adipor1 regulates ionizing radiation-induced ferroptosis in hcc cells through nrf2/xct pathway[J]. Oxid Med Cell Longev, 2022, 2022: 8091464. DOI:10.1155/2022/8091464 |
| [9] |
Yang C, Zhang H, Zhang L, et al. Evolving therapeutic landscape of advanced hepatocellular carcinoma[J]. Nat Rev Gastroenterol Hepatol, 2023, 20(4): 203-222. DOI:10.1038/s41575-022-00704-9 |
| [10] |
El-Hanboshy SM, Helmy MW, Abd-Alhaseeb MM. Catalpol synergistically potentiates the anti-tumour effects of regorafenib against hepatocellular carcinoma via dual inhibition of PI3K/Akt/mTOR/NF-κB and VEGF/VEGFR2 signaling pathways[J]. Mol Biol Rep, 2021, 48(11): 7233-7242. DOI:10.1007/s11033-021-06715-0 |
| [11] |
Bajbouj K, Ramakrishnan RK, Saber-Ayad M, et al. Prmt5 selective inhibitor enhances therapeutic efficacy of cisplatin in lung cancer cells[J]. Int J Mol Sci, 2021, 22(11): 6131. DOI:10.3390/ijms22116131 |
| [12] |
Tong Y, Wang M, Dai Y, et al. Lncrna hoxa-as3 sponges mir-29c to facilitate cell proliferation, metastasis, and emt process and activate the mek/erk signaling pathway in hepatocellular carcinoma[J]. Hum Gene Ther Clin Dev, 2019, 30(3): 129-141. DOI:10.1089/humc.2018.266 |
| [13] |
Ma H, Yuan L, Li W, et al. The lncRNA H19/miR-193a-3p axis modifies the radio-resistance and chemotherapeutic tolerance of hepatocellular carcinoma cells by targeting PSEN1[J]. J Cell Biochem, 2018, 119(10): 8325-8335. DOI:10.1089/humc.2018.266 |
| [14] |
Falahati Z, Mohseni-Dargah M, Mirfakhraie R. Emerging roles of long non-coding RNAs in uterine leiomyoma pathogenesis: A review[J]. Reprod Sci, 2022, 29(4): 1086-1101. DOI:10.1007/s43032-021-00571-w |
| [15] |
Cao Z, Pan X, Yang Y, et al. The lncLocator: a subcellular localization predictor for long non-coding RNAs based on a stacked ensemble classifier[J]. Bioinformatics, 2018, 34(13): 2185-2194. DOI:10.1093/bioinformatics/bty085 |
| [16] |
Boon RA, Jaé N, Holdt L, et al. Long noncoding rnas: From clinical genetics to therapeutic targets?[J]. J Am Coll Cardiol, 2016, 67(10): 1214-1226. DOI:10.1016/j.jacc.2015.12.051 |
| [17] |
Huang L, Lou K, Wang K, et al. Let-7c-5p represses cisplatin resistance of lung adenocarcinoma cells by targeting CDC25A[J]. Appl Biochem Biotechnol, 2023, 195(3): 1644-1655. DOI:10.1007/s12010-022-04219-6 |
 2023, Vol. 43
2023, Vol. 43


