2. 上海中医药大学附属曙光医院放疗科, 上海 201203
2. Department of Radiation Oncology, Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
2020年全球癌症统计数据显示,女性乳腺癌已经超过肺癌成为全球最常见的恶性肿瘤,其发病率和死亡率均位居前列[1]。乳腺癌患者死亡的主要原因是疾病发生远处转移[2]。放射治疗杀伤肿瘤的主要机制是辐射引起肿瘤细胞DNA单链断裂(single-strand breaks,SSB)或双链断裂(double-strand breaks,DSB),肿瘤细胞DNA损伤的修复是辐射抵抗的关键因素[3]。聚腺苷二磷酸核糖聚合酶(PARP)是DNA损伤修复过程的关键酶。PARP抑制剂通过对PARP酶的抑制和捕获,导致DNA难以成功修复,引发基因组不稳定和细胞死亡,进而发挥抗肿瘤效应[4]。由此推测,PARP抑制剂通过抑制PARP酶活性阻断辐射引起的肿瘤细胞DNA损伤修复,从而改善辐射抵抗,增加肿瘤细胞的放射敏感性。本研究旨在观察新型PARP抑制剂尼拉帕利及帕米帕利对乳腺癌细胞MCF-7及MDA-MB-436放射敏感性的影响,并对其机制进行探讨。
材料与方法1.主要试剂与仪器:RPMI 1640培养基、DMEM培养基、含0.25% EDTA的胰酶、青霉素-链霉素双抗(美国GIBCO公司);胎牛血清(杭州四季青公司);尼拉帕利(上海再鼎公司);帕米帕利(上海百济神州公司);CCK-8试剂盒、多聚甲醛、结晶紫染色液、Annexin V-FITC细胞凋亡试剂盒、细胞周期检测试剂盒(南京凯基生物公司);聚合酶链反应(PCR)试剂盒(上海新贝生物公司);X射线辐照装置为德国西门子医用直线加速器, 吸收剂量率100 cGy/min,源靶距为100 cm;流式细胞仪(美国BD公司)。
2.细胞株来源:乳腺癌细胞系MDA-MB-436(BRCAm)购于武汉武赛诺公司;乳腺癌细胞系MCF-7(非BRCAm) 购于南京凯基生物公司。
3.细胞培养:将乳腺癌细胞系MDA-MB-436接种于含20%胎牛血清、1%青霉素-链霉素双抗的DMEM培养基中;将乳腺癌细胞系MCF-7接种于含10%胎牛血清、1%青霉素-链霉素双抗的RPMI 1640培养基中,置于5%CO2、37℃的培养箱中培养。细胞贴壁生长,2~3 d传代1次,选取指数生长期细胞用于实验。
4.CCK-8法检测不同浓度尼拉帕利/帕米帕利对细胞增殖的影响:取指数生长期细胞,胰酶消化后制成单细胞悬液,以每孔3 000~5 000个接种于96孔细胞培养板中,待细胞贴壁后,各处理组更换为100 μl尼拉帕利/帕米帕利终浓度1、2.5、5、10、25、50 μmol/L的培养基,空白对照组和细胞对照组更换为100 μl完全培养基,于5% CO2、37℃的培养箱中培养24、48、72 h后,每孔加入10 μl CCK-8溶液,继续培养2 h,用酶标仪测定450 nm处的吸光度(A)值。细胞增殖抑制率(%)=1-(实验组A值-空白对照组A值)/(细胞对照组A值-空白对照组A值)×100%。
5.克隆形成实验检测尼拉帕利/帕米帕利对细胞放射敏感性的影响:实验分为空白对照组、尼拉帕利/帕米帕利(MCF-7:5 μmol/L,MDA-MB-436:1 μmol/L)、单纯照射组(2、4、6 Gy)、尼拉帕利/帕米帕利联合照射组(条件同前)。取指数生长期细胞,胰酶消化后制成单细胞悬液,以每孔500/800、800/1 000、1 500/1 500、2 000/2 500个细胞接种于培养皿中,细胞贴壁后,对照组换液,MCF-7各处理组分别加入5 μmol/L含尼拉帕利/帕米帕利培养基2 ml,MDA-MB-436各处理组分别加入1 μmol/L含尼拉帕利/帕米帕利培养基2 ml,培养1h后进行X射线照射。照射后继续培养48 h,所有组更换为不含药物的培养基,再继续培养12~14d后磷酸盐缓冲液(PBS)洗涤,4%多聚甲醛固定,结晶紫染色,以显微镜下计数50个以上的细胞计算集落形成率(PE),在Graphpad Prism 9.0软件上应用单击多靶模型拟合生存曲线,并计算D0(平均致死剂量)、Dq(准阈剂量)、SF2(经2 Gy照射后的细胞存活分数)、D0的放射增敏比(SERD0)、Dq的放射增敏比(SERDq)。SERD0=对照组D0/实验组D0,SERDq=对照组Dq/实验组Dq。
6. 流式细胞仪检测细胞凋亡:实验分组同前,细胞培养、药物及X射线(4 Gy)处理同克隆形成实验。继续培养48 h后用胰酶消化各组细胞,制成密度为1×106/L的细胞悬液, 按Annexin V-FITC细胞凋亡检测试剂盒说明书操作,用流式细胞仪检测,用Flowjo软件对样品的细胞凋亡率进行计算。
7.流式细胞仪检测细胞周期分布:实验分组、细胞培养及处理同上,继续培养48 h后用胰酶消化各组细胞,制成密度为2×105/L的细胞悬液,PBS洗涤,75%乙醇固定,4℃保存过夜。次日PBS洗涤并离心3 min,离心半径20 cm,1 000 r/min,以去除残留乙醇,加入碘化丙啶(PI)荧光染料混匀,室温、避光条件下孵育30 min后上机检测,用Flowjo软件对样品细胞周期进行计算。
8.免疫荧光法检测MCF-7细胞DNA损伤修复情况:实验分为空白对照组、尼拉帕利组、单纯照射组、尼拉帕利联合照射组。细胞培养、药物及X射线处理同前,取指数生长期密度为2×105/L的细胞悬液接种于共聚焦培养皿中,待细胞贴壁后换成尼拉帕利药液,培养1 h后进行X射线照射,接着按不同时间点(照射后2 h/24 h)进行下列处理,PBS洗涤3遍,加入多聚甲醛室温固定20 min;PBS洗涤3遍,加入0.2% Triton X-100破膜10 min;PBS洗涤3遍,加入5%牛血清白蛋白室温封闭45 min;加入一抗于4℃孵育过夜,次日PBS洗涤3遍,避光条件下加入荧光二抗,37℃避光孵育1 h,PBS洗涤3遍后加入含抗荧光淬灭剂的4′,6-二脒基-2-苯基吲哚(DAPI)染色10 min,立即于共聚焦显微镜下观察、拍照。
9.实时荧光定量PCR测定MCF-7细胞中FANCG、Bax、Bcl-2 mRNA的表达:实验分组同前,细胞培养及处理同细胞凋亡实验,采用TRIzol法提取处理后各组细胞的RNA,RNA的浓度和纯度使用酶标仪检测, 按照PCR试剂盒说明书步骤反转录为cDNA,随后在PCR仪上进行扩增,得到CT值后利用2-△△Ct法计算相对表达量。
10.Western blot法检测MCF-7细胞FANCG、Bax、Bcl-2蛋白的表达:实验分组、细胞培养及处理同前,提取处理后各组细胞的蛋白,上样后进行电泳并转移至聚偏二氟乙烯(PVDF)膜,使用5%脱脂奶粉室温封闭1 h,加入一抗于4℃孵育过夜,磷酸盐吐温缓冲液(PBST)洗膜3次,加入稀释的二抗摇床上室温孵育1 h,PBST洗涤3遍,加入显影剂后在暗室中曝光显影。
11.统计学处理:独立实验重复3次。采用SPSS 26.0软件进行数据分析,所有数据经正态性检验符合正态分布,以x±s表示。两组间比较采用独立样本t检验,多个样本均数间比较采用单因素方差分析(One-way ANOVA)。P<0.05为差异有统计学意义。
结果1.尼拉帕利/帕米帕利对乳腺癌MCF-7及MDA-MB-436细胞增殖的抑制作用:CCK-8检测结果显示,不同浓度的尼拉帕利/帕米帕利作用于乳腺癌MCF-7及MDA-MB-436细胞24、48、72 h后,均可抑制细胞的生长,具有一定的时间-剂量依赖性。表 1,2为不同浓度尼拉帕利/帕米帕利处理24、48、72 h后两种细胞的增殖抑制率。后续实验均选取48 h作为药物处理时间,以IC10作为药物浓度选取标准(MCF-7:5 μmol/L;MDA-MB-436:1 μmol/L)。
|
|
表 1 不同浓度的尼拉帕利处理后不同时间的乳腺癌细胞增殖抑制率(%,x±s) Table 1 Proliferation inhibition rate of cells treated with different concentrations of niraparib with different time (%, x±s) |
|
|
表 2 不同浓度的帕米帕利处理后不同时间的乳腺癌细胞增殖抑制率(%,x±s) Table 2 Proliferation inhibition rate of cells treated with different concerntrations of pamiparib with different time (%, x±s) |
2.尼拉帕利/帕米帕利联合照射对乳腺癌MCF-7及MDA-MB-436细胞存活分数的影响:乳腺癌MCF-7及MDA-MB-436细胞的存活分数随着照射剂量的增加而下降。按照单击多靶模型拟合MCF-7及MDA-MB-436细胞的存活曲线(图 1),获得D0、Dq及SF2等放射生物学参数(表 3)。与单纯照射组相比,联合照射组的D0、Dq、SF2的值逐渐减小,差异均具有统计学意义(tMCF-7=6.06、9.82、3.64、3.38、4.35,P<0.05;t436=6.47、4.14、3.69、5.79、5.26、8.29,P<0.05);SERD0、SERDq值逐渐增大,差异均具有统计学意义(tMCF-7=9.44、9.10、30.86、13.62,P<0.05;t436=4.22、6.58、4.49,P<0.05)。
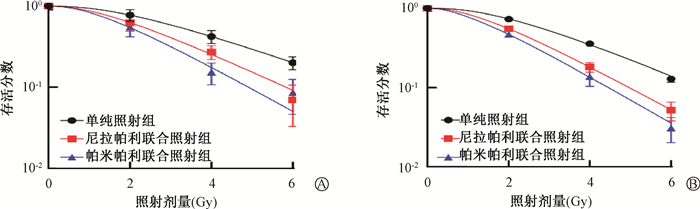
|
图 1 MCF-7 (A)和MDA-MB-436 (B)细胞存活分数曲线 Figure 1 The survival fraction curves of MCF-7 (A) and MDA-MB-436 (B) cells |
|
|
表 3 MCF-7及MDA-MB-436细胞的放射增敏参数及增敏比(x±s) Table 3 The radiosensitization parameters and sensitization ratio of MCF-7 and MDA-MB-436 cells(x±s) |
3.尼拉帕利/帕米帕利联合照射对乳腺癌MCF-7及MDA-MB-436细胞周期分布及凋亡的影响:流式细胞周期结果显示,与空白对照组相比,尼拉帕利/帕米帕利组、单纯照射组、尼拉帕利/帕米帕利联合照射组细胞G2/M期比例逐渐增加,差异均具有统计学意义(tMCF-7=16.02、7.84、10.95、41.66、44.08,P<0.05;t436=4.92、9.21、12.05、24.69、18.91,P<0.05),其中联合组细胞G2/M期比例最高;G0/G1期比例逐渐减少(tMCF-7=8.46、19.95、14.44、8.67、29.61,P<0.05;t436=8.19、13.45、26.39、29.12,P<0.05);流式细胞凋亡结果显示,与空白对照组相比,各组凋亡率均有所增加,其中联合组凋亡率增加最为显著(tMCF-7=4.35、4.30、20.90、11.17、11.71,P<0.05;t436=6.70、6.41、27.52、42.68、15.89,P<0.05,图 2,表 4)。
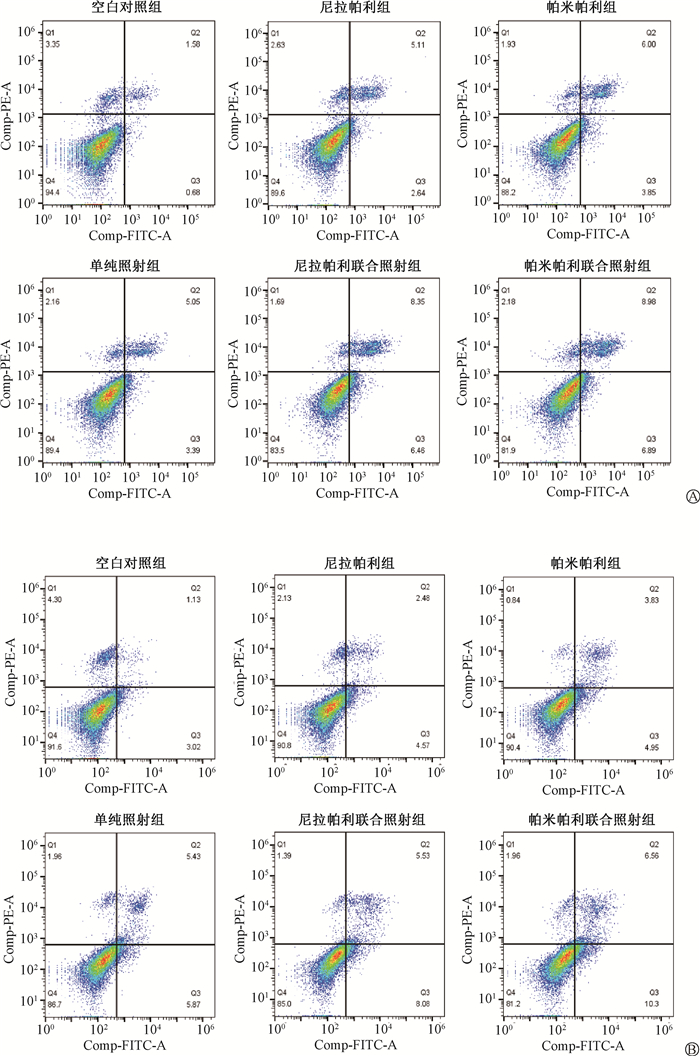
|
图 2 MCF-7(A)和MDA-MB-436(B)细胞各组流式细胞凋亡图 Figure 2 Flow apoptosis diagrams of MCF-7 (A) and MDA-MB-436 (B) cells in different groups |
|
|
表 4 MCF-7及MDA-MB-436细胞各组细胞周期分布比例及凋亡率(%,x±s) Table 4 The distribution ratio of cell cycle and apoptosis rate in different group(%, x±s) |
4.尼拉帕利联合照射对乳腺癌MCF-7细胞DNA损伤修复的影响:免疫荧光实验结果显示,空白对照组、尼拉帕利组、单纯照射组和尼拉帕利联合照射组照后2 h,细胞核内γ-H2AX焦点数量分别为30.71±0.40、40.38±2.44、46.62±1.74、64.32±1.50。其中,单纯照射组、尼拉帕利联合照射组与空白对照组相比,照射后2 h细胞核内γ-H2AX焦点数量显著增加,差异具有统计学意义(t=8.89、21.72,P<0.05);照射后24 h各组细胞核内γ-H2AX焦点数量分别为29.26±0.30、31.06±0.31、32.01±0.30、41.72±1.38。其中单纯照射组细胞核内γ-H2AX焦点数量基本恢复至照射前水平, 差异无统计学意义(P>0.05),但尼拉帕利联合照射组细胞核内γ-H2AX焦点数量仍大量存在,差异具有统计学意义(t=8.82,P<0.05), 见图 3。
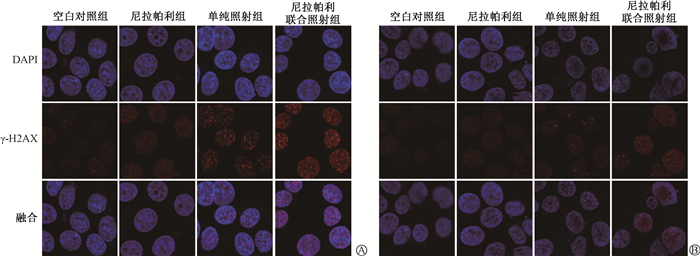
|
图 3 各组照射后2h(A)和24h(B) MCF-7细胞中γ-H2AX foci形成图 Figure 3 γ-H2AX foci formation in MCF-7 cells at 2h(A) and 24h(B) after irradiation in different groups |
5.尼拉帕利联合照射对乳腺癌MCF-7细胞FANCG、Bax、Bcl-2 mRNA及蛋白表达的影响:qPCR实验结果表明,与空白对照组相比,各处理组细胞FANCG、Bcl-2 mRNA表达显著下降,差异均具有统计学意义(tFANCG=7.08、11.91、14.07,P<0.05;tBcl-2=4.12、10.02、29.21,P<0.05);Bax mRNA表达显著升高,差异具有统计学意义(t=4.56、4.57、8.90,P<0.05);Western blot结果显示,相比空白对照组,各处理组细胞FANCG、Bcl-2蛋白表达下降,差异均具有统计学意义(tFANCG=3.91、5.40、7.09,P<0.05;tBcl-2=3.71、13.37、10.24,P<0.05),其中尼拉帕利联合照射组表达下降最显著;与空白对照组比较,尼拉帕利联合照射组细胞Bax蛋白表达升高,差异具有统计学意义(t=2.90,P<0.05,图 4)。
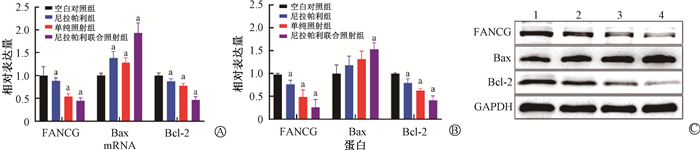
|
注:1.空白对照组;2.尼拉帕利组;3.单纯照射组;4.尼拉帕利联合照组。mRNA:a与空白对照组比较,tFANCG=7.08、11.91、14.07,P<0.05;tBax=4.56、4.57、8.90,P<0.05;tBcl-2=4.12、10.02、29.21,P<0.05;蛋白:a与空白对照组比较,tFANCG=3.91、5.40、7.09,P<0.05;tBax=2.90,P<0.05;tBcl-2=3.71、13.37、10.24,P<0.05 图 4 各组MCF-7细胞中FANCG、Bax、Bcl-2 mRNA(A)、蛋白(B)的表达水平及电泳图(C) Figure 4 The mRNA expression levels of FANCG, Bax, and Bcl-2 (A) and their protein expression levels (B) and protein bands of Western blot assay (C) of MCF-7 cells |
讨论
PARP与BRCA是DNA损伤修复的关键酶,启动并调控多种DNA损伤修复途径,在维持基因组完整性方面扮演着关键的角色[5-6]。因此,理论上PARP抑制剂可阻断辐射引起的肿瘤细胞DNA损伤修复,导致基因组不稳定和细胞死亡,从而增加肿瘤细胞的辐射敏感性。已有研究表明,PARP抑制剂通过抑制DNA的损伤修复,与放疗联合可以发挥协同作用[7]。本课题组的前期体外研究也发现,在肺腺癌、宫颈鳞癌及食管鳞癌的细胞实验中,PARP抑制剂可显著增加肿瘤细胞的辐射敏感性[8-9]。本研究主要聚焦新型PARP抑制剂尼拉帕利及帕米帕利对乳腺癌细胞的放射增敏作用,并对其机制进行初步探讨。
首先,CCK-8增殖实验表明尼拉帕利/帕米帕利对两种细胞系均具有杀伤抑制的作用,且随浓度及时间的增加而增加,具有明显的时间-剂量效应。同一种药物作用下,MDA-MB-436细胞(BRCA-1突变)比MCF-7细胞(非BRCA突变)抑制作用更强。可见,PARP蛋白的抑制联合BRCA突变产生的合成致死效应是造成这一实验结果的根本原因。不同种类药物作用下,帕米帕利和尼拉帕利两者抑制乳腺癌细胞生长的作用相似,其中帕米帕利相较尼拉帕利对BRCA突变细胞作用更强。可推测帕米帕利对PARP-1/2蛋白的抑制作用具有高度选择性,导致其联合BRCA突变产生的合成致死效应更强。进一步研究发现,乳腺癌细胞的存活分数可随照射剂量的增加呈指数性降低;与单纯照射组相比,联合组的放射生物学参数D0、Dq及SF2更小,放射增敏比SERD0更大;与MCF-7细胞相比,辐射作用下的MDA-MB-436细胞放射生物学参数D0、Dq及SF2更小。不同种类药物作用下,帕米帕利相较尼拉帕利对BRCA突变细胞更加敏感,联合射线杀伤抑制效应更强。由于D0与细胞辐射敏感性相关,Dq与细胞亚致死性损伤修复能力相关,上述结果表明,PARP抑制剂可能通过抑制乳腺癌细胞的亚致死性损伤修复能力达到放射增敏的作用,且BRCA突变细胞比非BRCA突变细胞辐射损伤更强。
PARP抑制剂及辐射导致细胞DNA损伤,进而引发一系列促进细胞存活的信号级联反应,即通过蛋白激酶级联放大信号以及激活下游效应物去促进细胞周期停滞、细胞凋亡以及DNA修复[10-11]。根据流式细胞仪分析得出的细胞周期及凋亡结果,可推测尼拉帕利/帕米帕利联合射线一方面诱导细胞从G1期向G2/M期转化,将细胞周期阻滞在G2/M期,另一方面则不断引发细胞凋亡。Zhang等[12]在非小细胞肺癌细胞系经尼拉帕利和射线处理后观察到了类似的结果。众所周知,细胞在G2/M期对辐射最为敏感,结合qPCR及Western blot结果可知,这可能是尼拉帕利通过下调细胞凋亡抑制基因及蛋白Bcl-2的表达,上调细胞凋亡相关基因及蛋白Bax的表达,改变细胞周期分布,将细胞周期阻滞在G2/M期,加速G2/M期细胞凋亡,最终起到放射增敏作用。其中,对于MDA-MB-436细胞而言,帕米帕利相较尼拉帕利联合射线诱导的G2/M期占比更大,细胞凋亡率更高。这也从另一方面验证了上述的结论,即帕米帕利对BRCA突变细胞更加敏感。
当电离辐射导致肿瘤细胞产生大量DSB时,组蛋白H2A变体H2AX迅速发生磷酸化。其中γ-H2AX处H2AX的磷酸化十分丰富,故γ-H2AX对DSB的产生具有明显的指示性,可用于检查DNA损伤及修复情况[13-14]。本研究免疫荧光结果所呈现的趋势与Michmerhuizen等[15]在炎性乳腺癌细胞系经奥拉帕利及射线处理后不同时间γ-H2AX焦点数量的变化趋势相似。该结果说明PARP抑制剂联合照射可延缓DNA损伤修复进程,尼拉帕利的存在更促进了联合组DSB的累积和延续。此外,本研究观察到与空白对照组相比,各处理组均下调了FANCG表达,其中尼拉帕利联合照射组下调FANCG表达最显著。Cui等[16]发现尼拉帕利联合照射在食管癌细胞系的移植瘤转录组测序数据中FANCG的表达差异有统计学意义,本研究结果与其体内/外Western blot实验观察到的结果相似。FANCG蛋白参与的信号通路,即FA-BRCA通路,在修复DNA链间交联中起核心作用。目前已鉴定出22个相关基因,其中多个基因与乳腺癌易感性相关,例如BRCA1/2[17-19]。FANCG作为FA途径的一员,通过同源重组修复途径参与DNA损伤修复[20-21]。故可推测PARP抑制剂可能通过FA-BRCA通路下调FANCG蛋白来抑制DNA损伤的同源重组修复途径,从而与辐射联合发挥抗肿瘤协同效应。
本研究为PARP抑制剂作为乳腺癌细胞放疗增敏剂提供了初步的理论依据,但仍需对其机制进行更深入的探索,同时完善动物实验,进一步明确PARP抑制剂的放疗增敏作用,从而为晚期、复发转移等难治性乳腺癌患者提供新的治疗策略。
利益冲突 全体作者无利益冲突,未因该研究接受任何不当的职务或财务利益
作者贡献声明 段秋华负责实验操作、数据分析和论文撰写;封悦、胡莉钧、汪建林指导实验操作;曾宏伟、孙菲指导数据统计;孟庆红、周梦耘协助实验操作;于静萍负责实验设计,提出修改意见
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
AlSendi M, O'Reilly D, Zeidan YH, et al. Oligometastatic breast cancer: are we there yet?[J]. Int J Cancer, 2021, 149(8): 1520-1528. DOI:10.1002/ijc.33693 |
| [3] |
Kim BM, Hong Y, Lee S, et al. Therapeutic implications for overcoming radiation resistance in cancer therapy[J]. Int J Mol Sci, 2015, 16(11): 26880-26913. DOI:10.3390/ijms161125991 |
| [4] |
赵福臻, 胡莉钧, 于静萍. 聚腺苷二磷酸核糖聚合酶抑制剂在肿瘤放射治疗中的应用研究进展[J]. 中华放射医学与防护杂志, 2021, 41(10): 796-800. Zhao FZ, Hu LJ, Yu JP. Progress in the application of poly ADP-ribose polymerase inhibitors in tumor radiotherapy[J]. Chin J Radiol Med Prot, 2021, 41(10): 796-800. DOI:10.3760/cma.j.issn.0254-5098.2021.10.013 |
| [5] |
Khodyreva SN, Prasad R, Ilina ES, et al. Apurinic/apyrimidinic (AP) site recognition by the 5'-dRP/AP lyase in poly(ADP-ribose) polymerase-1(PARP-1)[J]. Proc Natl Acad Sci USA, 2010, 107(51): 22090-22095. DOI:10.1073/pnas.1009182107 |
| [6] |
Slade D. PARP and PARG inhibitors in cancer treatment[J]. Genes Dev, 2020, 34(5-6): 360-394. DOI:10.1101/gad.334516.119 |
| [7] |
Jannetti SA, Zeglis BM, Zalutsky MR, et al. Poly (ADP-Ribose) polymerase (PARP) inhibitors and radiation therapy[J]. Front Pharmacol, 2020, 11: 170. DOI:10.3389/fphar.2020.00170 |
| [8] |
Feng Y, Pi S, Li Y, et al. Effects of the PARP inhibitor Niraparib on the radiosensitivity of human lung and cervical cancer cells[J]. Radiat Med Prot, 2023, 4(2): 93-97. DOI:10.1016/j.radmp.2023.05.002 |
| [9] |
赵福臻, 封悦, 马兆明, 等. 尼拉帕利对食管癌细胞辐射敏感性的影响及机制研究[J]. 中华放射肿瘤学杂志, 2023, 32(8): 718-724. Zhao FZ, Feng Y, Ma ZM, et al. Effects of niraparib on the radiosensitivity of human esophageal cancer cells and its mechanism[J]. Chin J Radiat Oncol, 2023, 32(8): 718-724. DOI:10.3760/cma.j.cn.113030-20221104-00373 |
| [10] |
Huang RX, Zhou PK. DNA damage response signaling pathways and targets for radiotherapy sensitization in cancer[J]. Signal Transduct Target Ther, 2020, 5(1): 60. DOI:10.1038/s41392-020-0150-x |
| [11] |
Hu Y, Guo M. Synthetic lethality strategies: Beyond BRCA1/2 mutations in pancreatic cancer[J]. Cancer Sci, 2020, 111(9): 3111-3121. DOI:10.1111/cas.14565 |
| [12] |
Zhang N, Gao Y, Zeng Z, et al. PARP inhibitor niraparib as a radiosensitizer promotes antitumor immunity of radiotherapy in EGFR-mutated non-small cell lung cancer[J]. Clin Transl Oncol, 2021, 23(9): 1827-1837. DOI:10.1007/s12094-021-02591-z |
| [13] |
Sharma A, Singh K, Almasan A. Histone H2AX phosphorylation: a marker for DNA damage[J]. Methods Mol Biol, 2012, 920: 613-626. DOI:10.1007/978-1-61779-998-3_40 |
| [14] |
Nagelkerke A, Span PN. Staining against phospho-H2AX (γ-H2AX) as a marker for DNA damage and genomic instability in cancer tissues and cells[J]. Adv Exp Med Biol, 2016, 899: 1-10. DOI:10.1007/978-3-319-26666-4_1 |
| [15] |
Michmerhuizen AR, Pesch AM, Moubadder L, et al. PARP1 inhibition radiosensitizes models of inflammatory breast cancer to ionizing radiation[J]. Mol Cancer Ther, 2019, 18(11): 2063-2073. DOI:10.1158/1535-7163.MCT-19-0520 |
| [16] |
Cui Y, Huang W, Du F, et al. Therapeutic benefits of niraparib tosylate as radio sensitizer in esophageal squamous cell carcinoma: an in vivo and in vitro preclinical study[J]. Clin Transl Oncol, 2022, 24(8): 1643-1656. DOI:10.1007/s12094-022-02818-7 |
| [17] |
Fang CB, Wu HT, Zhang ML, et al. Fanconi anemia pathway: mechanisms of breast cancer predisposition development and potential therapeutic targets[J]. Front Cell Dev Biol, 2020, 8: 160. DOI:10.3389/fcell.2020.00160 |
| [18] |
García-de-Teresa B, Rodríguez A, Frias S. Chromosome instability in fanconi anemia: from breaks to phenotypic consequences[J]. Genes (Basel), 2020, 11(12): 1528. DOI:10.3390/genes11121528 |
| [19] |
Wang W. Emergence of a DNA-damage response network consisting of Fanconi anaemia and BRCA proteins[J]. Nat Rev Genet, 2007, 8(10): 735-748. DOI:10.1038/nrg2159 |
| [20] |
Yamamoto K, Ishiai M, Matsushita N, et al. Fanconi anemia FANCG protein in mitigating radiation- and enzyme-induced DNA double-strand breaks by homologous recombination in vertebrate cells[J]. Mol Cell Biol, 2003, 23(15): 5421-5430. DOI:10.1128/MCB.23.15.5421-5430.2003 |
| [21] |
Zhu B, Yan K, Li L, et al. K63-linked ubiquitination of FANCG is required for its association with the Rap80-BRCA1 complex to modulate homologous recombination repair of DNA interstand crosslinks[J]. Oncogene, 2015, 34(22): 2867-2878. DOI:10.1038/onc.2014.229 |
 2023, Vol. 43
2023, Vol. 43


