定量CT(quantitative computed tomography, QCT)是目前临床上常用的骨密度(BMD)测量方法,被认为是骨质疏松诊断的参考标准之一[1]。与双能X射线骨密度仪(dual-energy X-ray absorptiometry, DXA)相比,QCT可以区分皮质骨和松质骨,并且比DXA具有更高的灵敏度[2]。然而,由于CT的高辐射剂量,QCT在临床骨质疏松筛查中的应用受到限制。因此,利用患者现有的常规CT扫描,而不需要额外检查的机会性CT在诊断骨质疏松方面成为一种有前途的方法。
减少辐射剂量一直是CT技术改进的方向,然而,尽管基于混合模型的自适应统计迭代重建(hybrid model-based adaptive statistical iterative reconstruction V, ASIR-V)可以显著降低图像噪声,但噪声纹理也同时丢失,特别是高级别的重建图像具有蜡质、塑性或不自然的外观,从而影响诊断,因此,高级别重建通常不被接受[3]。尽管基于完全模型迭代(full model-based IR, MBIR)可以提供更高的降噪效果,但由于其计算速度较慢,无法满足临床工作的要求[4]。而基于卷积神经网络模型的深度学习重建算法(deep image learning reconstruction,DLIR, TrueFidelity, 美国GE Healthcare公司),产生的原始数据与高剂量的滤波反投影(filtered back projection, FBP)图像对比,图像在降低图像噪声的同时不改变噪声纹理[5]。研究表明,DLIR可显著减低CT图像噪声,并能在保持图像纹理不变的情况下,提高对比度,进而改善图像质量[6-8],但有关其对骨密度测量的影响及其在骨质疏松筛查中应用的研究还很少。本研究探索DLIR对骨密度测量的影响,并与临床中常用的ASIR-V重建算法在低剂量扫描图像中进行质量对比,探究其在骨质疏松筛查中应用价值。
资料与方法1.病例资料:本研究经过郑州大学伦理委员会批准(审批号:2022-KY-0961-002),所有参与者在检查前均签署知情同意书。119例在2022年6月至2023年3月根据临床需要同时进行胸和上腹部联合低剂量扫描患者被纳入研究。其中,男68例,女51例,年龄41~84岁,平均(61.6±10.1)岁;体质量指数(BMI)17.22~32.01 kg/m2,平均(23.73 ± 3.32)kg/m2。年龄 < 40岁或接受过脊椎手术(植入或其他异物)的患者被排除。
2.扫描方法及骨密度测量:所有患者均接受了512层CT扫描仪(Revolution APEX CT, 美国GE Healthcare公司)扫描。使用非同步校准体模(Mindeways软件)每天进行一次非同步QCT质量控制校准。采用胸腹部联合低剂量扫描,低剂量CT扫描条件如下:管电压120 kVp,自动管电流40~500 mA,噪声指数(NI)=14,转速为0.5 s/圈,扫描范围从肺尖到L2椎体下缘。为了减少呼吸情况对图像采集的影响,在扫描开始前患者深吸气后屏住呼吸进行扫描。对扫描图像分别进行FBP、ASIR-V 50%和DLIR-L、DLIR-M和DLIR-H重建(L、M、H分别是深度学习重建算法低、中、高3个级别)。工作站QCT-Pro software(美国Midways Software公司)被用来进行BMD测量。将L1和L2椎体的BMD平均值作为诊断骨质疏松的最终BMD。将患者按照性别分为男性、女性两组;按照年龄将患者分为A1组(40岁≤年龄 < 60岁);A2组(年龄≥60岁);根据体质量指数将患者分为B1组(BMI < 24 kg/m2)和B2组(BMI≥24 kg/m2);根据2018版中国定量CT(QCT)骨质疏松诊断指南中诊断椎体骨质疏松症标准进行诊断[9]。
3.图像质量评估
(1) 客观评价:图像集被传输到AW4.7后处理工作站进行分析和测量。为了确保双盲评估,所有相关信息和扫描参数均被屏蔽。由一名具有8年诊断经验的放射科医师进行分析。感兴趣区(region of interests, ROI)手动绘制在降主动脉、背阔肌上、肝脏、脾脏和前腹壁脂肪内。对于不同的图像集,相同的ROI被放置在相同的截面上。对于每个ROI,记录平均CT值(HU)和标准偏差(standard deviation, SD)。前腹壁脂肪的标准偏差用来代表客观图像噪声[10],并分别计算降主动脉、肝脏、脾脏的信噪比(signal-to-noise ratio, SNR)和对比噪声比(contrast-to-noise ratio, CNR)。计算公式[10]如下:SNRROI=CTROI/ SDROI,CNRROI=(CTROI-CT背阔肌)/SD脂肪。
(2) 主观评价:两名分别具有15和11年胸、腹部诊断经验的诊断医师,在不知道重建设置的情况下被随机展示图像。两名医师分别对每组图像集进行评估,以二者的平均值作为最终评分。表 1展示了图像质量评估的标准细节。
|
|
表 1 图像质量评估的评分标准 Table 1 The scoring standard of image quality assessment |
4.统计学处理:采用SPSS 25.0软件进行分析。采用Levene法进行方差齐性检验,使用单因素重复测量方差分析(Geisser-Greenhouse校正,Bonferroni两两比较)比较不同重建算法下的BMD值及客观评价(SNR和图像噪声)指标。利用Friedman M非参数检验评估不同重建方式下CNR和主观评分。图像主观评分的诊断一致性采用加权Kappa检验。P < 0.05为差异有统计学意义。
结果1.不同重建方法下患者的BMD与骨质疏松的诊断:不同重建方法下不同分组的BMD值见表 2。在119例检查者中,27例被诊断为骨质疏松,46例被诊断为骨量减少,46例骨量正常。对于不同的亚组,不同重建方式下BMD之间的差异均无统计学意义(P>0.05),说明不同重建方式对BMD的测量没有影响。
|
|
表 2 不同重建方式下不同因素的骨密度值(mg/cm3,x±s) Table 2 Bone mineral density of different groups with different reconstruction methods(mg/cm3, x±s) |
2.图像质量客观评价:不同重建方法下降主动脉、肝脏和脾脏的SNR和图像噪声如图 1,CNR如表 3所示。与ASIR-V 50%图像比,DLIR-L在降主动脉、肝脏和脾脏的SNR分别增加了9.69%、25.81%和29.83%;DLIR-M分别增加了40.31%、59.50%和65.13%;而DLIR-H分别增加了103.88%、125.09%和136.13%。与ASIR-V 50%相比,DLIR的3个级别(L、M和H)图像噪声分别降低了13.18%、33.53%和55.98%。不同重建方法在降主动脉、肝脏和脾脏3个部位的CNR差异均有统计学意义(χ2=188.66、272.17、158.31,P<0.001),DLIR-H图像在3个部位的CNR均是最高的。
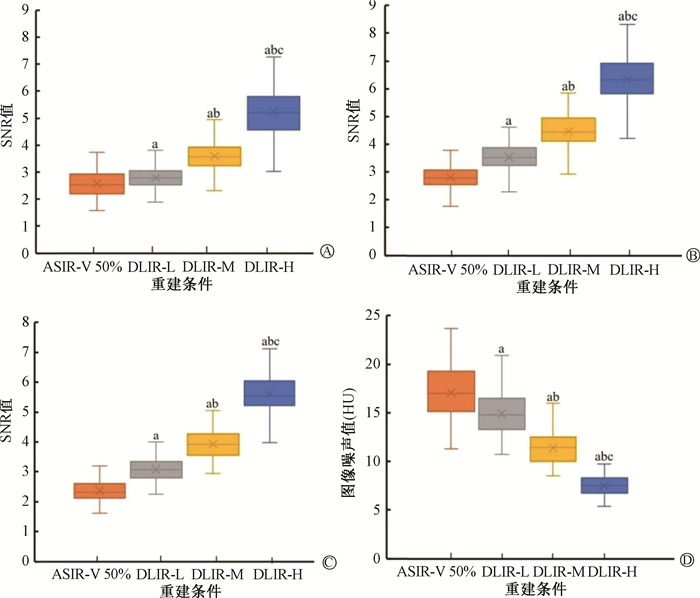
|
注:图中方框显示四分位数范围(IQR);SNR.信噪比;ASIR-V 50%.50%权重的自适应统计迭代重建-Veo;DLIR-L、DLIR-M、DLIR-H.低、中、高不同水平的深度学习重建算法。降主动脉、肝脏和脾脏的信噪比及图像噪声比较,F=2 528.77、4 211.66、5 808.73、2 032.51,P < 0.001;a与ASIR-V 50%图像比较,P < 0.05;b与DLIR-L图像比较,P < 0.05;c与DLIR-M图像比较,P < 0.05 图 1 不同部位的信噪声比及噪声 A.降主动脉中的信噪比;B.肝脏的信噪比;C.脾脏的信噪比;D.图像噪声 Figure 1 The SNR of different body parts and image noise A.SNR in the descending aorta; B.SNR in the liver; C.SNR in the spleen; D.Image noise |
|
|
表 3 不同重建方式下图像的对比噪声比及主观评分[M(P25, P25)] Table 3 Image CNR and subjective score with different reconstruction methods[M(P25, P25)] |
3.图像质量主观评分:主观分析的得分见表 3。与ASIR-V 50%相比,DLIR-M和DLIR-H在整体图像质量、主观噪声、纵隔结构和肾上腺的显示能力方面明显更好。两名医师在整体图像质量、主观噪声、肺部病变、纵隔结构和肾上腺的显示能力的诊断一致性良好(k=0.651、0.649、0.987、0.697、0.765)。在重建图像中,DLIR-H显示出肾上腺的显著性得分最高。不同重建方式的肺部病变显示差异无统计学意义(P>0.05)。
讨论本研究所测量的BMD数据为胸腹部低剂量扫描CT数据,患者不需要额外的设备、检查时间和辐射暴露。根据美国放射学会(ACR)公布的CT扫描获得骨密度的胸、腹部阈值,分别为120和80 mg/cm3[11],以确定骨量减少和骨质疏松。
本研究表明,相对于临床常用ASIR-V 50%迭代重建,DLIR-L的CNR及主观评分与ASIR-V 50%图像相当,而SNR更高,图像噪声更低;与ASIR-V 50%及DLIR-L相比,DLIR-M和DLIR-H在主观评分及客观图像质量方法均表现出更高的评分及客观图像质量,DLIR-H显示出比DLIR-M更高的肾上腺得分。本研究的结果表明,随着DLIR强度的增加,客观及主观噪声均更优,这与Kim等[12]的研究结果一致,可能与DLIR-H有着更强的降噪能力,且在低剂量扫描时阅片者普遍倾向于DLIR-H有关。另一项研究评估了低剂量DLIR图像的病变检查率和图像质量,将结果与日本佳能医疗系统的低剂量和标准剂量的迭代重建图像进行对比,发现这些图像和标准剂量的迭代图像之间的病变检出率相当[13],本研究中DLIR的肺部病变显示能力与ASIR-V 50%没有明显差异,结论与其一致。
本研究将骨质疏松筛查与低剂量CT扫描相结合,结果显示,40~60岁年龄组的BMD明显高于60岁以上年龄组,男性组高于女性组,这与Cheng等[14]对于中国人大数据的骨质疏松筛查中女性骨质疏松患病率高于男性的结果一致。本研究119例患者中,29例被诊断为骨质疏松,43例被诊断为骨质减少。超过60%的患者表现出骨质疏松或骨质减少,这是对骨质疏松症早期诊断的重要参考。由于LDCT已被用于老年人和高危人群的标准检查[15],这些扫描均可用于机会性骨质疏松症筛查,例如利用肺癌筛查低剂量胸部CT进行机会性骨质疏松筛查,将为临床提供一种潜在经济上可行的方法[16]。本研究的局限性在于所使用的深度学习重建算法是供应商特定的,不能用于其他扫描仪。
总之,在胸腹部联合低剂量扫描中,无论是主观评分还是客观评价,DLIR均优于ASIR-V 50%,同时,DLIR并不影响BMD测量。因此,将DLIR应用于低剂量CT扫描在得到优质的图像用于信息诊断的同时,还可以进行机会性骨质疏松症筛查。
利益冲突 本文作者声明不存在任何与本稿件相关的利益冲突
作者贡献声明 王明月负责数据采集、数据分析、数据解释和论文撰写;吴艳、周悦负责实验设计;董军强负责选题设计;高剑波负责论文修改
| [1] |
中华医学会放射学分会骨关节学组, 中国医师协会放射医师分会肌骨学组, 中华医学会骨科学分会骨质疏松学组, 等. 骨质疏松的影像学与骨密度诊断专家共识[J]. 中国骨质疏松杂志, 2020, 26(9): 1249-1256. Bone and Joint Group of Chinese Society of Radiology CMA, Association MRSoCMD, Osteoporosis Group of Chinese Orthopedic Association CMA, et al. Consensus on the diagnosis of osteoporosis by imaging and bone mineral density measurement[J]. Chin J Osteopor, 2020, 26(9): 1249-1256. DOI:10.3969/j.issn.1006-7108.2020.09.001 |
| [2] |
Pickhardt PJ, Bodeen G, Brett A, et al. Comparison of femoral neck BMD evaluation obtained using Lunar DXA and QCT with asynchronous calibration from CT colonography[J]. J Clin Densitom, 2015, 18(1): 5-12. DOI:10.1016/j.jocd.2014.03.002 |
| [3] |
Euler A, Solomon J, Marin D, et al. A third-generation adaptive statistical iterative reconstruction technique: phantom study of image noise, spatial resolution, lesion detectability, and dose reduction potential[J]. AJR Am J Roentgenol, 2018, 210(6): 1301-1308. DOI:10.2214/AJR.17.19102 |
| [4] |
Jensen CT, Telesmanich ME, Wagner-Bartak NA, et al. Evaluation of abdominal computed tomography image quality using a new version of vendor-specific model-based iterative reconstruction[J]. J Comput Assist Tomogr, 2017, 41(1): 67-74. DOI:10.1097/RCT.0000000000000472 |
| [5] |
Franck C, Zhang G, Deak P, et al. Preserving image texture while reducing radiation dose with a deep learning image reconstruction algorithm in chest CT: A phantom study[J]. Phys Med, 2021, 81: 86-93. DOI:10.1016/j.ejmp.2020.12.005 |
| [6] |
Delabie A, Bouzerar R, Pichois R, et al. Diagnostic performance and image quality of deep learning image reconstruction (DLIR) on unenhanced low-dose abdominal CT for urolithiasis[J]. Acta Radiol, 2022, 63(9): 1283-1292. DOI:10.1177/02841851211035896 |
| [7] |
Akagi M, Nakamura Y, Higaki T, et al. Deep learning reconstruction improves image quality of abdominal ultra-high-resolution CT[J]. Eur Radiol, 2019, 29(11): 6163-6171. DOI:10.1007/s00330-019-06170-3 |
| [8] |
Racine D, Becce F, Viry A, et al. Task-based characterization of a deep learning image reconstruction and comparison with filtered back-projection and a partial model-based iterative reconstruction in abdominal CT: a phantom study[J]. Phys Med, 2020, 76: 28-37. DOI:10.1016/j.ejmp.2020.06.004 |
| [9] |
《中国定量CT(QCT)骨质疏松症诊断指南》工作组, 程晓光, 王亮, 等. 中国定量CT(QCT)骨质疏松症诊断指南(2018)[J]. 中国骨质疏松杂志, 2019, 25(6): 733-737. Task Group of Guidelines for Quantitative Computed Tomography (QCT) of Osteoporosis in China, Cheng XG, Wang L, et al. The China guideline for the diagnosis criteria of osteoporosis with quantitative computed tomography (QCT)(2018)[J]. Chin J Osteopor, 2019, 25(6): 733-737. DOI:10.3969/j.issn.1006-7108.2019.06.001 |
| [10] |
吕培杰, 刘娜娜, 王落桐, 等. 深度学习重建算法优化能谱CT低单能量图像质量及检测肝脏低对比度小病灶能力[J]. 中国医学影像技术, 2023, 39(1): 104-108. Lv PJ, Liu NN, Wang LT, et al. Deep learning image reconstruction for optimizing image quality of low-energy spectral monochromatic CT and detecting liver small low-contrast lesions[J]. Chin J Med Imaging Technol, 2023, 39(1): 104-108. DOI:10.13929/j.issn.1003-3289.2023.01.024 |
| [11] |
Engelke K, Adams JE, Armbrecht G, et al. Clinical use of quantitative computed tomography and peripheral quantitative computed tomography in the management of osteoporosis in adults: the 2007 ISCD Official Positions[J]. J Clin Densitom, 2008, 11(1): 123-162. DOI:10.1016/j.jocd.2007.12.010 |
| [12] |
Kim JH, Yoon HJ, Lee E, et al. Validation of deep-learning image reconstruction for low-dose chest computed tomography scan: emphasis on image quality and noise[J]. Korean J Radiol, 2021, 22(1): 131-138. DOI:10.3348/kjr.2020.0116 |
| [13] |
Singh R, Digumarthy SR, Muse VV, et al. Image quality and lesion detection on deep learning reconstruction and iterative reconstruction of submillisievert chest and abdominal CT[J]. AJR Am J Roentgenol, 2020, 214(3): 566-573. DOI:10.2214/AJR.19.21809 |
| [14] |
Cheng X, Zhao K, Zha X, et al. Opportunistic screening using low-dose CT and the prevalence of osteoporosis in China: a nationwide, multicenter study[J]. J Bone Miner Res, 2021, 36(3): 427-435. DOI:10.1002/jbmr.4187 |
| [15] |
Fan L, Wang Y, Zhou Y, et al. Lung cancer screening with low-dose CT: baseline screening results in Shanghai[J]. Acad Radiol, 2019, 26(10): 1283-1291. DOI:10.1016/j.acra.2018.12.002 |
| [16] |
Wu Y, Guo Z, Fu X, et al. The study protocol for the China Health Big Data (China Biobank) project[J]. Quant Imaging Med Surg, 2019, 9(6): 1095-1102. DOI:10.21037/qims.2019.06.16 |
 2023, Vol. 43
2023, Vol. 43


