2. 香港大学生物科学学院,香港 999077;
3. 郑州大学化学学院,郑州 450001;
4. 维也纳大学化学学院,维也纳 1010
2. The University of Hong Kong, Hong Kong 999077, China;
3. Faculty of Chemistry, Zhengzhou University, Zhengzhou 450001, China;
4. Faculty of Chemistry, Vienna University, Vienna 1010, Austria
常规剂量率放疗在肿瘤治疗中发挥了巨大的作用,并且技术的发展和优化显著降低了危及器官的受照剂量,然而,正常组织放射损伤仍限制了肿瘤区域照射剂量的进一步提升。近年来的实验研究显示,采用剂量率为常规剂量率100倍以上的超高剂量率照射(也称为FLASH照射)时,肿瘤控制率相同,但正常组织的放射损伤明显减轻,该现象称为FLASH效应[1]。临床试验也初步表明,FLASH放疗可减轻正常组织放射损伤[2]。详尽阐述FLASH效应的潜在机制有助于FLASH照射的临床转化。
水为生物体内最主要的成份,人体水含量约占体重的55%~80%,其中40%存在于细胞内,对维持物质转运、神经传递、细胞周期等至关重要[3]。在经典的放射生物学中,生物体接受常规剂量率的低传能线密度的射线照射后,约30%的能量沉积于DNA,通过直接作用诱导DNA链断裂损伤;其余70%能量作用于生物体内水分子,诱导水分子电离和激发,在极短的时间内发生化学反应,生成活性氧自由基,扩散至周围组织微环境,通过间接作用引发生物学效应[4]。前期研究表明,FLASH照射能够减轻DNA链断裂损伤,FLASH效应与电离辐射的直接效应无关[5]。本研究尝试从电离辐射的间接作用入手,探讨FLASH照射后水分子的辐射化学效应。
材料与方法1.超纯水样品来源及处理:使用电导率为18.2 μS/cm的超纯水(Milli-Q Integral 3超纯水仪,德国MerckMilipore公司)。照射前,将超纯水放置在低氧培养箱(氧含量4%,Bugbox M低氧培养箱,英国Ruskinn公司)中24 h。
2.实验分组及照射条件:实验前,将超纯水转移到2 ml Eppendorf管中(完全装满)。样品分为3组:对照组、常规照射组和FLASH照射组。应用美国Varian TrueBeam SN1403加速器实施常规照射,剂量率为0.05 Gy/s;采用改造后的美国Varian 23CX加速器实施FLASH照射,剂量率为100 Gy/s,用于FLASH照射的直线加速器具体改造和验证过程见既往报道[6]。两种剂量率照射均使用9 MeV电子线,照射剂量为0~50 Gy。
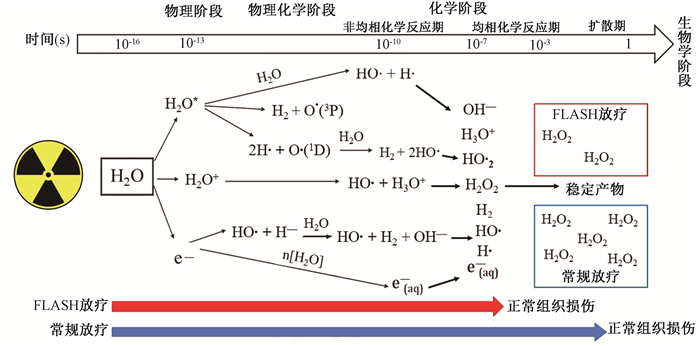
3.均相阶段羟自由基含量检测:电离后的超纯水样品可发生辐射化学效应,极短时间产生多种活性氧自由基,这些自由基具有高反应性、不稳定性和顺磁性。采用电子顺磁共振自旋捕获法(EMX-9.5/12电子顺磁共振波谱仪,德国Bruker公司),以自旋捕获剂5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO,50 mmol/L,德国MerckMilipore有限公司)研究FLASH照射和常规照射后水分子电离激发后均相化学反应阶段所产生的羟自由基(羟基自由基为均相阶段主要的活性氧自由基之一,可用来代表均相阶段的H2O2含量,图 1)[7]。于照射后立即收集样品,进行检测。具体参数为:微波频率9.78 GHz,微波功率20 mW,调制频率100 kHz,调制幅度2 G,中心磁场3 450 G,扫描宽度300 G。
|
图 1 水分子在常规照射和FLASH照射(电离辐射间接作用)下发生物理、化学及生物学效应过程示意图 Figure 1 Schematic diagram of the physical, chemical and biological effects in water molecules during conventional radiotherapy and FLASH irradiation (the indirect effect of ionizing radiation) |
4.扩散期H2O2含量检测:水分子电离后在非均相和均相化学反应阶段产生的自由基不稳定,化学性质活泼,接下来,水分子辐射分解产物中最稳定的H2O2进入扩散阶段并产生生物学效应(图 1)。照射后10 min,采用Amplex Red检测试剂盒(美国赛默飞世尔科技有限公司)依据使用说明书处理样品[荧光分析仪(美国Bio-Rad公司)测量580~640 nm范围内的荧光强度(激发波长520 nm)]。根据标准曲线所得的函数方程求得样品中H2O2的浓度。
5.脂质体制备及丙二醛(MDA)测定:L-α-磷脂酰胆碱(p3556)和三氯甲烷(288306)购自德国MerckMilipore有限公司。取60 mg的磷脂酰胆碱溶于2 500 μl三氯甲烷中,用旋转蒸发器(上海亚荣RE-2000A)缓慢蒸发溶剂。然后,加入2 ml的超纯水(4%氧含量放置24 h),孵育10 min。涡旋2 min,在超声浴中分散1 min,重复涡旋直到得到均匀的悬浮液。通过100 nmol/L微孔滤膜,重复6次,得到均匀的脂质体悬浮液。将此悬浮液稀释至14 ml,涡旋均匀。将脂质体转移到2 ml的Eppendorf管中,保留一个未辐照的样品作为空白对照,实验重复3次,放置在低氧培养箱(氧含量4%)中24 h。样品分别给予常规照射和FLASH照射(参数同步骤2)。10 min后,采用MDA检测试剂盒(英国Abcam公司)按照说明书处理样品,酶标仪测定样品532 nm处吸光度(A),根据标准曲线所得的函数方程计算样品MDA浓度。
6. 统计学处理:采用GraphPad Prism 8.0软件进行分析,计量资料符合正态分布,两组间比较采用独立样本t检验。P < 0.05为差异具有统计学意义。
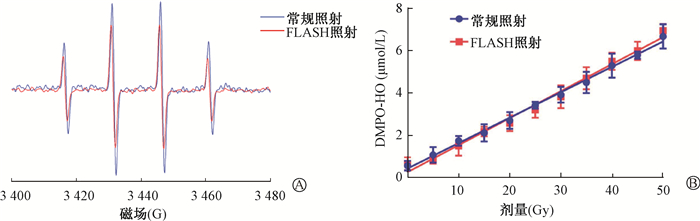
结果1.均相阶段FLASH照射产生羟基自由基的水平:采用电子顺磁共振法,检测了均相阶段所产生的羟自由基的自旋加合物(DMPO-OH,图 2A)。结果显示,FLASH照射和常规照射后的自由基产量都随着照射剂量的增加而线性增加;两种照射模式后,相同剂量的单次照射后,自由基产量差异无统计学意义(P>0.05)。这表明FLASH照射和常规照射在均相阶段自由基的生成量相似(图 2B)。
|
图 2 电子顺磁共振法检测常规照射和超高剂量率(FLASH)照射后超纯水均相阶段羟自由基自旋加合物(DMPO-OH)产量 A.超纯水常规照射和FLASH照射(30 Gy,DMPO,50 mmol/L)下DMPO-OH加合物的电子顺磁共振波谱;B.超纯水接受常规照射和FLASH照射后DMPO-OH加合物的生成量 Figure 2 EPR-detection of the yield of DMPO-OH in the homogeneous phase after conventional and FLASH irradiation A. EPR spectra of DMPO-OH in conventional and FLASH irradiation (30 Gy, DMPO, 50 mmol/L) in ultrapure water; B. The yield of DMPO-OH after conventional and FLASH irradiation in ultrapure water |
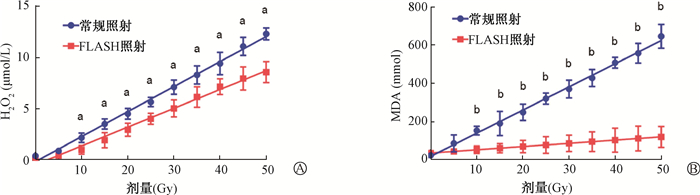
2.扩散期FLASH照射产生H2O2水平明显低于常规照射:采用Amplex Red过氧化氢荧光探针测定扩散阶段的H2O2含量。结果表明,扩散阶段FLASH照射和常规照射后的H2O2产量都随着照射剂量的增加而线性增加;且单次照射剂量≥10 Gy时,常规照射的H2O2合成量显著高于FLASH照射(t=0.49~12.81,P<0.05,图 3A)。
|
注:FLASH. 超高剂量率照射;MDA. 丙二醛。与同一剂量常规照射比较,at=0.49~12.81, P < 0.05;bt=0.31~11.73, P < 0.05 图 3 常规照射和FLASH照射后扩散期H2O2生成量分析(A)及丙二醛含量(B) Figure 3 Analysis of H2O2 yield (A) in diffusion phase and the content of MDA (B) after conventional and FLASH irradiation |
3.脂质体模型验证水辐射的化学效应:构建脂质体模型用于检测电离辐射间接作用导致的脂质氧化水平。如图 3B所示,常规照射后脂质体MDA生成量明显升高,且随着照射剂量的增加而线性增加;而FLASH照射后MDA水平无明显变化。当照射剂量≥10 Gy,常规照射后的MDA生成量显著高于FLASH照射(t=0.31~11.73,P<0.05,图 3B)后的MDA生成量。因此,常规照射可以通过电离辐射作用于水分子,发生化学反应产生大量活性氧自由基,诱导脂质氧化应激;而FLASH照射后的脂质过氧化水平不明显。
讨论本研究通过超纯水模型系统地分析比较了常规照射和FLASH照射后水分子辐射的化学效应。常规照射后,水分子辐射分解产生大量的活性氧自由基,而FLASH照射后,活性氧自由基的产量明显低于常规照射。脂质体模型证实,常规照射后脂质过氧化水平升高,FLASH照射后脂质体未发生明显的氧化应激。因此,剂量率可影响电离辐射间接作用的效果,FLASH效应可能与照射后水分子辐射的化学效应减弱有关。
电离辐射的间接作用使得生物体内水分子发生电离和激发,经过物理阶段、物理化学阶段产生多种活性氧自由基;这些自由基通过一系列化学反应,产生稳定的过氧化氢等活性氧物质,然后扩散至组织微环境,上述过程可于1 s内完成[8]。对于低传能线密度的射线来说,电离辐射的物理化学阶段多在10-12 s之内完成,形成初始自由基,包括H·、e-(aq)、HO·、H2、H2O2[9]。在接下来的化学效应阶段,上述产物首先进入非均相化学反应期,时间在10-12和10-7 s之间,自由基以不同的速度扩散并发生化学反应:一部分自由基与其他自由基重组形成新的自由基,同时,另一部分自由基不断扩散;之后,这些自由基物进入均相化学反应期,其中,HO·作为活性氧家族成员,可以用来代表均相阶段的H2O2含量[10]。常规剂量率照射时,自由基重组和扩散的结果在很大程度上取决于能量沉积的方式[8]。Montay-Gruel等[11]提出假说,认为FLASH可能改变了初始自由基、重组自由基的产量以及后续的扩散,最终导致不同的生物学效应。由于物理化学阶段发生时间极短,且初始自由基具有高反应性,不易检测。本研究中,采用成熟的电子顺磁共振法,检测了均相化学反应期的自由基生成量,结果表明无论是常规照射,还是FLASH照射,超纯水的放射性分解产物在均相阶段无差异。
常规剂量率照射和FLASH照射的参数中最主要区别是剂量率和照射时间。FLASH照射可在亚秒至毫秒的时间内完成全部能量传递,而常规照射由于剂量率的限制,其完成全部能量传递所需时间远超FLASH照射,故常规照射时水分子的辐射化学效应持续时间明显较FLASH照射长[12-13]。基于计算机模型分析认为,FLASH照射在极短时间内电离水分子生成大量的自由基,这些自由基在有限的空间内密集分布,虽然相互作用的概率显著增加,但与氧分子接触发生化学反应的概率下降,故活性氧生成量减少;相反,常规剂量率照射时,水分子电离产生的自由基分布较为疏散,可与氧分子充分作用,因此,产生的活性氧水平相对较高[7, 14]。水分子电离后处于扩散期的活性氧自由基化学性质相对稳定,其中以H2O2含量最多[8]。本研究用荧光法分析了4%氧含量下的超纯水辐射分解后扩散期H2O2含量,发现当单次剂量<10 Gy时,常规照射和FLASH照射后H2O2生成量无显著差异,而当单次剂量≥10 Gy时,FLASH照射后H2O2生成量明显低于常规照射。这与在正常组织中观察到FLASH照射相对常规照射产生较低放射损伤的效应是一致的[13]。Alanazi等[7]基于蒙特卡罗算法,利用计算机模型模拟不同剂量率对水辐射分解时形成的自由基产量的影响,发现随着剂量率的增加,水中氧分子的消耗量增加,自由基生成量呈现出降低趋势。本研究结果也提示水分子辐射化学效应受到剂量率和照射时间的影响。此外,FLASH照射和常规照射后活性氧自由基在均相化学期相同,而在扩散期差异显著,这可能与扩散期水中氧分子的快速耗竭有关,关于这一点有待进一步研究论证。
磷脂是生物膜的重要组成部分,细胞膜为磷脂双分子层结构。磷脂脂质体可以用来构建细胞膜模型,并广泛用于研究脂质氧化应激[15-16]。因此,本研究采用脂质体模型分析水分子辐射分解后产生的活性氧自由基的脂质过氧化作用,结果显示,FLASH照射的脂质过氧化水平显著低于常规照射。这与本研究中量化分析扩散期FLASH照射和常规照射后H2O2生成量的结果存在一定的偏差。可能的解释为:FLASH照射和常规照射后其余活性氧自由基的产量也存在差异,需要进一步研究明确。尽管如此,本研究观察到了电离辐射间接作用诱导脂质过氧化。这和既往研究中报道的常规剂量率照射会通过脂质过氧化破坏细胞膜而导致细胞铁死亡的结果[17]相一致。最近,来自瑞士洛桑大学的Froidevaux等[18]也报道了类似的结论,进一步佐证了本研究结果。与Froidevaux等[18]的研究相比,本研究不仅采用脂质体模型分析辐射的化学效应,而且从电离辐射的早期阶段入手,研究逻辑性强,结论更具说服力。
值得注意的是,电离辐射后水的分解是一个复杂的物理-化学-生物学过程,其中,早期的物理-化学阶段时间极短;目前,对该过程中分解产生的高活性自由基的检测手段不够成熟。而且,自由基的产生受多种因素的影响。Wardman[19]认为实验中使用塑料容器,并且将样品放置在塑料容器中过久可能会造成实验误差;因为即便是短时间的辐照,塑料中的化学物质也可能进入样品从而影响实验结果。此外,FLASH放疗后正常组织损伤涉及多个生物学过程,本研究基于水分子辐射化学模型探讨FLASH效应的可能机制,存在局限性。因此,后续研究可考虑优化实验方法,构建更多的模型,系统地分析常规照射和FLASH照射早期各种产物的差异,以准确地解释FLASH效应的生物学机制。
总之,本研究分析了电离辐射的早期,FLASH照射和常规照射后水分子的辐射化学效应,发现均相化学反应期不同剂量率照射后的羟自由基产量相似,而到了扩散阶段,FLASH照射后H2O2生成量较常规照射减少;脂质体模型显示FLASH照射不伴随脂质过氧化作用。由于H2O2可导致脂质过氧化,因此,FLASH照射和常规照射表现出不同的生物学效应,需要更多的研究从物理、化学角度全面深入阐述FLASH效应的机制。
利益冲突 本人与其他作者宣称没有任何利益冲突,未接受任何不当的职务或财务利益
志谢 感谢瑞士洛桑大学附属医院放疗科全体成员对本文的指导与帮助,感谢瑞士洛桑大学生物医学系的支持与建议
作者贡献声明 罗辉、Phyllis Zhang、李楠、Ke Chou、马蕾杰负责实验操作,数据整理分析,论文撰写;杨成梁、雷宏昌、毛荣虎、宋帅负责部分数据及文献整理,协助论文撰写;葛红指导论文命题、构思及修订
| [1] |
Vozenin MC, Bourhis J, Durante M. Towards clinical translation of FLASH radiotherapy[J]. Nat Rev Clin Oncol, 2022, 19(12): 791-803. DOI:10.1038/s41571-022-00697-z |
| [2] |
Mascia AE, Daugherty EC, Zhang Y, et al. Proton FLASH radiotherapy for the treatment of symptomatic bone metastases: the FAST-01 nonrandomized trial[J]. JAMA Oncol, 2023, 9(1): 62-69. DOI:10.1001/jamaoncol.2022.5843 |
| [3] |
Delpire E, Gagnon KB. Water homeostasis and cell volume maintenance and regulation[J]. Curr Top Membr, 2018, 81: 3-52. DOI:10.1016/bs.ctm.2018.08.001 |
| [4] |
Nascimento F, Bradshaw C. Direct and indirect effects of ionizing radiation on grazer-phytoplankton interactions[J]. J Environ Radioact, 2016, 155-156: 63-70. DOI:10.1016/j.jenvrad.2016.02.007 |
| [5] |
罗辉, 袁期刚, ZhangPhyllis, 等. 超高剂量率照射诱导质粒DNA链断裂损伤的研究[J]. 中华放射医学与防护杂志, 2023, 43(3): 161-167. Luo H, Yuan QG, Zhang P, et al. Ultra-high dose rate irradiation induced DNA strand break in plasmid DNA[J]. Chin J Radiat Med Prot, 2023, 43(3): 161-167. DOI:10.3760/cma.j.cn112271-20221122-00453 |
| [6] |
马蕾杰, 毛荣虎, 雷宏昌, 等. 改造常规医用加速器实现Flash-RT及物理性能测量[J]. 中华放射肿瘤学杂志, 2022, 31(11): 1022-1027. Ma LJ, Mao RH, Lei HC, et al. Transform routine medical accelerators to achieve Flash‐RT and physical performance measurements[J]. Chin J Radiat Oncol, 2022, 31(11): 1022-1027. DOI:10.3760/cma.j.cn113030-20210830-00325 |
| [7] |
Alanazi A, Meesungnoen J, Jay-Gerin JP. A computer modeling study of water radiolysis at high dose rates. relevance to FLASH radiotherapy[J]. Radiat Res, 2021, 195(2): 149-162. DOI:10.1667/RADE-20-00168.1 |
| [8] |
Kacem H, Almeida A, Cherbuin N, et al. Understanding the FLASH effect to unravel the potential of ultra-high dose rate irradiation[J]. Int J Radiat Biol, 2022, 98(3): 506-516. DOI:10.1080/09553002.2021.2004328 |
| [9] |
Baldacchino G, Brun E, Denden I, et al. Importance of radiolytic reactions during high-let irradiation modalities: Let effect, role of o2 and radiosensitization by nanoparticles[J]. Cancer Nanotechnol, 2019, 10(1): 1-21. DOI:10.1186/s12645-019-0047-y |
| [10] |
Yamamoto YI, Suzuki T. Ultrafast dynamics of water radiolysis: Hydrated electron formation, solvation, recombination, and scavenging[J]. J Phys Chem Lett, 2020, 11(14): 5510-5516. DOI:10.1021/acs.jpclett.0c01468 |
| [11] |
Montay-Gruel P, Acharya MM, Petersson K, et al. Long-term neurocognitive benefits of FLASH radiotherapy driven by reduced reactive oxygen species[J]. Proc Natl Acad Sci USA, 2019, 116(22): 10943-10951. DOI:10.1073/pnas.1901777116 |
| [12] |
Kacem H, Psoroulas S, Boivin G, et al. Comparing radiolytic production of H2O2 and development of Zebrafish embryos after ultra high dose rate exposure with electron and transmission proton beams[J]. Radiother Oncol, 2022, 175: 197-202. DOI:10.1016/j.radonc.2022.07.011 |
| [13] |
罗辉, 闫明阳, 贾雪超, 等. 超高剂量率放疗在恶性肿瘤中的应用[J]. 中华放射医学与防护杂志, 2021, 41(8): 636-640. Luo H, Yan MY, Jia XC, et al. Application of FLASH radiotherapy with an ultra-high dose rate in malignant tumors[J]. Chin J Radiol Med Prot, 2021, 41(8): 636-640. DOI:10.3760/cma.j.issn.0254-5098.2021.08.013 |
| [14] |
Lai Y, Jia X, Chi Y. Modeling the effect of oxygen on the chemical stage of water radiolysis using GPU-based microscopic Monte Carlo simulations, with an application in FLASH radiotherapy[J]. Phys Med Biol, 2021, 66(2): 025004. DOI:10.1088/1361-6560/abc93b |
| [15] |
Kaneko N, Sugioka T, Sakurai H. Aluminum compounds enhance lipid peroxidation in liposomes: Insight into cellular damage caused by oxidative stress[J]. J Inorg Biochem, 2007, 101(6): 967-975. DOI:10.1016/j.jinorgbio.2007.03.005 |
| [16] |
Thomas AH, Catalá Á, Vignoni M. Soybean phosphatidylcholine liposomes as model membranes to study lipid peroxidation photoinduced by pterin[J]. Biochim Biophys Acta, 2016, 1858(1): 139-145. DOI:10.1016/j.bbamem.2015.11.002 |
| [17] |
Luo H, Wang X, Song S, et al. Targeting stearoyl-coa desaturase enhances radiation induced ferroptosis and immunogenic cell death in esophageal squamous cell carcinoma[J]. Oncoimmunology, 2022, 11(1): 2101769. DOI:10.1080/2162402X.2022.2101769 |
| [18] |
Froidevaux P, Grilj V, Bailat C, et al. FLASH irradiation does not induce lipid peroxidation in lipids micelles and liposomes[J]. Radiat Phys Chem, 2023, 205(1): 110733. DOI:10.1016/j.radphyschem.2022.110733 |
| [19] |
Wardman P. Radiotherapy using high-intensity pulsed radiation beams (FLASH): a radiation-chemical perspective[J]. Radiat Res, 2020, 194(6): 607-617. DOI:10.1667/RADE-19-00016 |
 2023, Vol. 43
2023, Vol. 43


