结直肠癌是国内第4常见的恶性肿瘤[1]。超过50%的结直肠癌患者在其疾病发展过程中会出现肝转移,且肝转移是结直肠癌患者的主要死因[2]。手术是肝转移患者首选的局部治疗方式,但仅有10%~40%的患者可行手术切除[3]。对于不可手术的患者,射频消融也是有效的局部治疗手段,局部控制率可达60%~90%[4-5]。近年来,放疗在结直肠癌肝转移中的应用逐渐增多。据报道,接受放疗的结直肠癌肝转移患者2年局部控制率为70%~90%[6-7]。尽管局部病灶控制良好,但肝内失败是接受局部治疗患者最主要的失败模式[6]。这部分局部治疗后失败的患者通常也不适合接受手术治疗。随着放疗技术的进步,尤其是体部立体定向放射治疗(stereotactic body radiotherapy, SBRT)技术的普及,二程放疗也在尝试应用。目前,国内外对于肝脏二程放疗的报道大多针对肝细胞癌,或将肝细胞癌和肝转移瘤合并分析[8-9],暂无专门针对结直肠癌肝转移瘤二程放疗的研究。本研究拟收集北京大学肿瘤医院结直肠癌肝转移瘤接受二程放疗患者的数据资料,对结直肠癌肝转移瘤二程放疗的疗效和安全性进行分析。
资料与方法1.患者选择和资料收集:结直肠癌肝转移患者在本院接受肝脏病灶放疗的主要标准包括:①不可手术切除的结直肠腺癌肝转移瘤。②无未控的肝外转移灶。③美国东部肿瘤协作组(Eastern Cooperative Oncology group,ECOG)评分0~1分。④少于5枚肝内转移灶。⑤正常肝脏体积大于700 cm3。⑥良好的肝、肾、骨髓功能(无2级以上肝功能损伤)。⑦无腹水。二程放疗定义为患者既往接受过肝脏放疗,再次行肝转移灶的放疗。二程放疗的患者选择则更加严格,需确保患者有充足的肝脏体积和肝脏功能,正常肝脏、胃肠道等邻近危及器官的累积剂量在安全范围内。所有患者在接受肝转移瘤放疗前均需进行多学科会诊,确定当前最适合患者的局部治疗手段。在放疗开始前所有患者均需进行完整的临床评估,包括病史采集、体格检查,血常规、生化检查,胸、腹、盆腔CT检查,腹部磁共振成像(MRI)检查等。本研究回顾了2017年1月至2023年3月于本院进行放疗的结直肠癌肝转移患者,从中筛选出28例行二程放疗的患者。
2.放疗流程:患者仰卧位于热塑体膜或真空垫固定体位,行模拟CT和MRI定位扫描。腹压器或腹压带被推荐用于可耐受的患者,以减小肝脏病灶的呼吸动度。患者接受四维计算机断层扫描(4-dimensional computed tomography, 4D-CT)定位,以确定肝脏病灶的呼吸动度。自2019年后,四维磁共振成像(4-dimensional magnetic resonance imaging,4D-MRI)被推荐用于接受SBRT治疗的患者。接受4D-MRI定位的患者需在体表放置压力传感器,在图像采集过程中跟踪呼吸运动,使用基于振幅触发的方式前瞻性收集吸气末和呼气末的T2加权磁共振图像[10]。使用Eclipse治疗计划系统对模拟CT和MRI图像进行配准,以指导靶区勾画。
患者的大体肿瘤区(gross tumor volume, GTV)在CT和MRI融合的图像上进行勾画。内靶区(internal target volume, ITV)包括4D-CT、4D-MRI图像上观察到的GTV。计划靶区(planning target volume, PTV)则在ITV的基础上三维外扩5 mm形成。1例患者在首程针对肝转移瘤术后瘤床进行放疗,其临床靶区(clinical target volume, CTV)包括根据手术记录和解剖标记确定的术后瘤床,PTV则包括摆位误差和呼吸动度。根据患者的病灶大小、数目、位置、一程放疗情况、危及器官受量和可耐受的定位方式综合确定患者的剂量分割模式。一般而言,对于病灶较小(≤5 cm)、远离胃肠道、中央胆管,可行4D-MRI定位的患者采用单次剂量大于5 Gy的SBRT治疗,而对于大病灶、毗邻危及器官的患者则采用中等剂量分割或常规分割治疗。基于6~10 MV X射线设计调强放射治疗(intensity modulated radiotherapy, IMRT)或容积弧形调强治疗(volumetric modulated arc therapy, VMAT)计划,95%的PTV需达到处方剂量。正常组织限量参考2022年英国共识[11],正常肝脏体积(liver-GTV)定义为肝脏总体积减GTV体积,对于二程放疗的患者,需将首程和二程计划融合,重新计算两次计划的总剂量分布,并严格限制重要危及器官受量。使用美国瓦里安直线加速器实施放疗,接受SBRT治疗的患者需每日行锥形束CT(CBCT)验证,确保治疗位置准确。
3.评估和随访:放疗期间每周对患者进行问诊、查体,监测血常规及肝肾功能等。放疗后1个月对患者进行随访,后2年内每3个月1次,5年内每6个月1次,后续每年随访1次。随访内容包括问诊、查体、实验室检查和影像学检查。
研究终点包括肿瘤近期疗效、局部控制率、总生存率和无进展生存率。总生存(overall survival, OS)定义为从放疗开始至患者因任何原因死亡。无进展生存(progression-free survival, PFS)定义为从放疗开始至患者疾病进展或因任何原因死亡。局部复发定义为影像学证实的PTV内复发。
病灶近期疗效使用实体瘤疗效评价标准(response evaluation criteria in solid tumours, RECIST) 1.1版本评估。对于可行MRI检查的患者,基于MRI影像进行疗效评价,并保持基线测量和疗后评价序列一致;对于无法行MRI检查的患者,基于增强CT图像进行评价。治疗相关不良反应使用不良事件常用术语评定标准(common terminology criteria for adverse events, CTCAE)4.0评估。急性不良反应定义为放疗后3个月内发生的不良事件,晚期不良反应定义为放疗3个月后发生的不良事件。
4.统计学处理:使用SPSS 26.0和R 4.2.1软件进行统计分析。使用Kaplan-Meier法进行生存分析,使用竞争风险模型计算累积局部复发率,累积肝内复发率和累积肝外复发率,死亡视为竞争风险事件。P < 0.05为差异有统计学意义。
结果1.患者基线特征和治疗情况:本研究共纳入28例患者,患者基线特征和既往治疗情况见表 1和表 2。全组患者男女比例为1.55∶1,ECOG评分均≤1分。大部分患者在初诊时为同时性肝转移(75.0%),T3~4(85.7%),N阳性(64.3%)。在二程放疗时,患者的中位年龄为65岁(35~86岁),大于60岁以上患者占60.7%。二程放疗时存在肝外转移的患者较首程放疗时有所增加(42.9% vs. 17.9%,P = 0.042)。在首程放疗和二程放疗前,大部分患者(92.9%)都接受了肝脏的其他局部治疗。28例患者中首程放疗前后3个月内接受全身治疗的比例为64.3%,二程放疗前后3个月内接受全身治疗的比例为50.0%。在接受全身治疗的患者中,70%以上同时接受了化疗和靶向治疗。
|
|
表 1 结直肠癌肝转移患者首程和二程放疗时的基线特征 Table 1 Baseline characteristics of patients with colorectal cancer liver metastases undergoing the first- and second-course of radiotherapy |
|
|
表 2 结直肠癌肝转移患者首程和二程放疗时的既往治疗情况 Table 2 Previous treatment characteristics of patients with colorectal cancer liver metastases undergoing the first- and second-course of radiotherapy |
患者首程和二程放疗时的放疗情况见表 3,4。二程放疗和首程放疗的中位间隔时间为11.1个月(2.8~43.9个月)。首程放疗共治疗40枚病灶,二程放疗共治疗36枚病灶。接受二程放疗的病灶中,有2枚为首程未控病灶,其余为新发病灶。首程放疗的中位病灶大小为2.0 cm(0.6~6.3 cm),二程放疗的中位病灶大小为2.3 cm(0.9~9.3 cm)。首程放疗和二程放疗的中位生物有效剂量(biological effective dose, BED)(α/β = 10)分别为100 Gy(60~132 Gy)和96 Gy(60~132 Gy),分别有25例(89.3%)和24例(85.7%) 患者接受SBRT治疗。首程放疗的肝-GTV平均体积为1 283.3 cm3,二程放疗为1 245.5 cm3。首程放疗和二程放疗的正常肝脏平均受量的2 Gy分次的等效剂量(equivalent dose in 2 Gy fractions, EQD2)分别为10.1和7.9 Gy。
|
|
表 3 患者首程和二程放疗时的放疗情况 Table 3 Radiotherapy characteristics of the first- and second-course of treatment |
|
|
表 4 患者首程和二程放疗时病灶及剂量学参数 Table 4 Lesion′s characteristics and desimetric parameters of the first- and second-course of treatment |
2.近期与长期疗效:33枚二程放疗的病灶可按照RECIST 1.1标准评价最佳近期疗效,3枚病灶因缺少后续影像图像而无法评效。二程放疗的近期完全缓解(complete response, CR)率、部分缓解(partial response, PR)率和疾病稳定(stable disease, SD)率、疾病进展(progressive disease, PD)率分别为54.5%、18.2%、21.2%和6.1%。二程放疗的客观反应率(objective response rate, ORR)为72.7%。在24个二程放疗后达到ORR的病灶中,58.3%在治疗前后3月内行全身治疗,1枚病灶曾行首程放疗。二程放疗后全组、接受化疗和靶向治疗、接受化疗或靶向治疗、未接受全身治疗患者达到CR的中位时间分别为5.3(2.1~14.0)、2.3(2.1~9.0)、3.1(2.3~5.3)、7.5(4.4~14.0)个月,达到PR的中位时间分别为2.7(1.6~5.2)、1.6(1.6~1.6)、2.3(2.3~2.3)、3.6(2.0~5.2)个月。二程放疗后达到PR和SD的13枚病灶经中位45.2个月(1.5~45.2个月)的随访后,仅1枚病灶出现局部进展。
患者二程放疗后整体中位随访时间为20.2个月(1.5~45.2个月)。二程放疗的患者中有2例为首程治疗后原放疗病灶增大,后续又接受了二程放疗。其中,1例患者(仅1枚病灶)3个月时达到PR,11.8个月时病灶增大,接受二程放疗,首程和二程均采用常规分割放疗,BED均为72 Gy,二程放疗后病灶达到PR且长期控制,生存时间达41.4个月。另一例患者(仅1枚病灶)首程接受60 Gy/8次(BED 105 Gy)的SBRT治疗,2个月时达到PR,9.4个月时病灶增大,二程接受50 Gy/10次的照射,12.5个月后复查提示病灶增大,再次野内进展。二程放疗后共3例患者出现局部复发,均为原放疗病灶未控,其中1例为前述第2枚病灶,另外2枚病灶分别接受了60 Gy/10次(BED 96 Gy)和50 Gy/5次(BED 100 Gy)的大分割放疗。二程放疗后基于患者的2年的累积局部复发率为17.0%(图 1A),基于病灶的2年的累积局部复发率分别为15.1%(图 1B)。
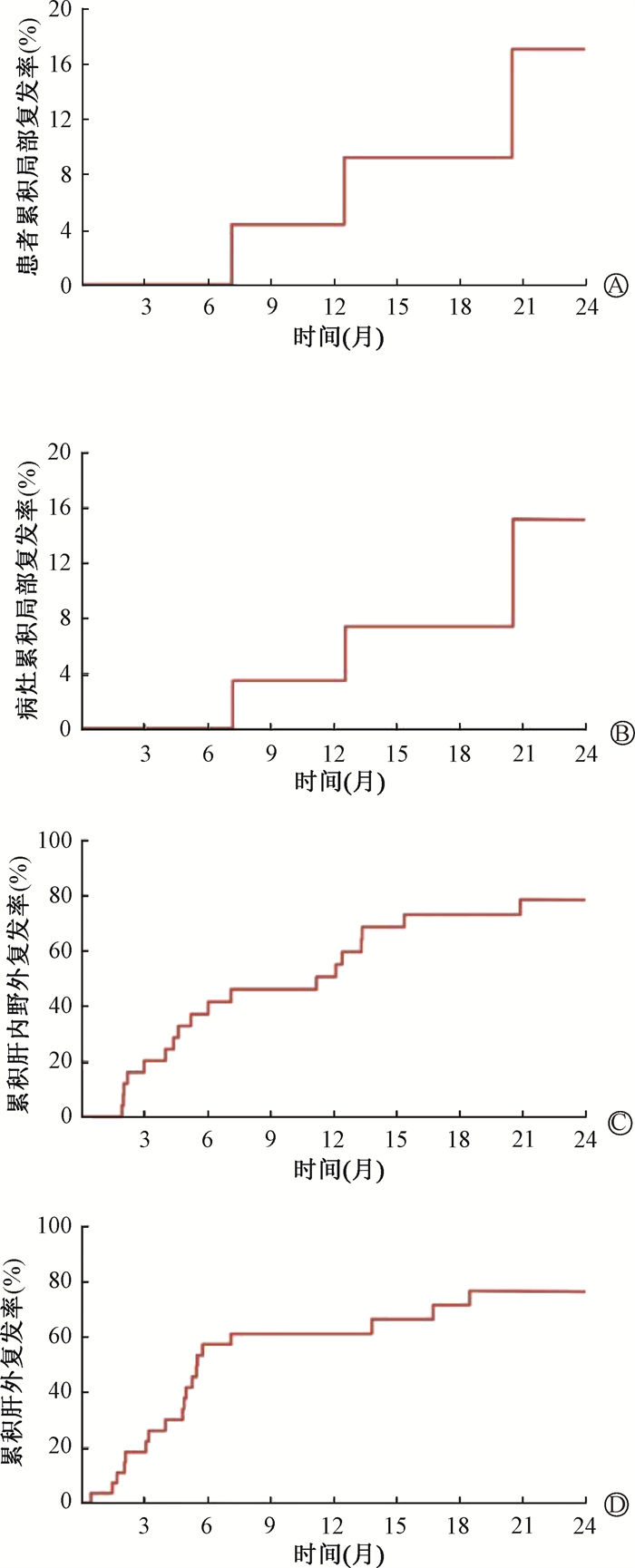
|
图 1 二程放疗后基于患者的累积局部复发率(A)、基于病灶的累积局部复发率(B)、累积肝内复发率(C)和累积肝外复发率(D) Figure 1 Cumulative rates of patient-based local recurrence (A), lesion-based local recurrence(B), intrahepatic recurrence (C) and extrahepatic recurrence(D) for patients after the second-course radiotherapy |
截至随访结束,二程放疗后有25例(89.3%)患者出现疾病进展。其中,多数为肝内野外进展,共19例(67.9%),1年的累积肝内野外复发率为50.5%(图 1C)。肝外进展者有20例(71.4%),2年的累积肝外复发率为76.7%(图 1D)。二程放疗后的中位PFS为4.8个月,1年PFS为27.4%(图 2A)。共11例(39.3%)患者死亡,患者二程放疗后中位OS为27.2个月,3年OS为46.7%(图 2B)。
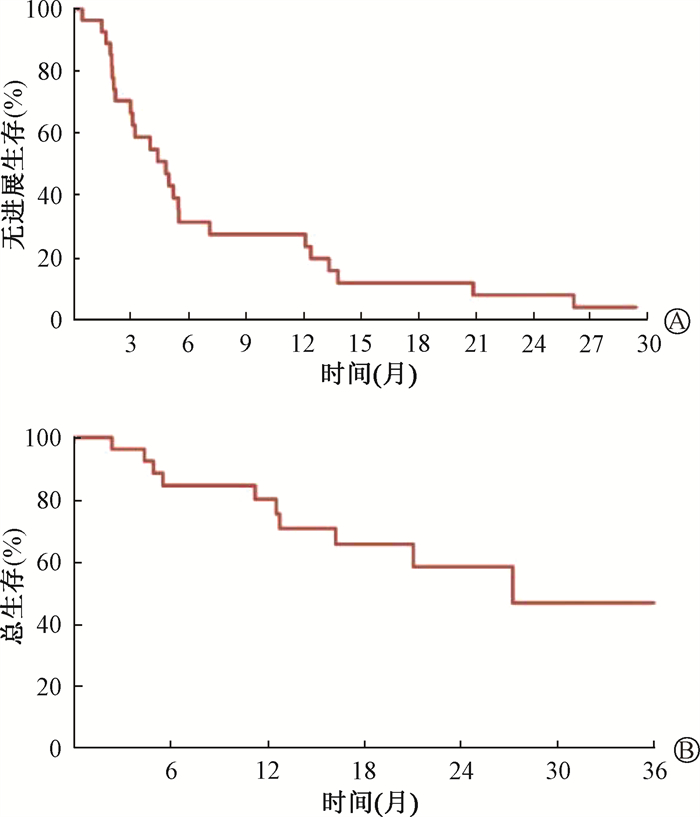
|
图 2 28例结直肠癌肝转移患者二程放疗后的无进展生存率(A)和总生存率(B) Figure 2 Progression-free survival (A) and overall survival (B) for 28 patients with colorectal cancer liver metastases after the second-course radiotherapy |
3.不良反应:二程放疗后患者的耐受性良好,未出现放射性肝病或晚期不良反应。急性不良反应归纳于表 5。二程放疗后21例(75.0%)患者出现了1~2级不良反应,其中1~2级血液学不良反应占46.4%,1~2级肝脏不良反应占39.3%,1例(3.6%)患者出现了3级血液学不良反应(白细胞减少)。
|
|
表 5 28例结直肠癌肝转移患者二程放疗后的急性不良反应 Table 5 Acute toxicities profile of 28 patients with colorectal cancer liver metastases after the second-course radiotherapy |
讨论
本研究报告了28例不可手术结直肠癌肝转移患者二程放疗的疗效和安全性。二程放疗距首程放疗的中位时间为11.1个月。在近期疗效方面,二程放疗的CR率、PR率和ORR分别为54.5%、18.2%和72.7%。在局部控制方面,二程放疗后基于患者的2年的累积局部失败率为17.0%,基于病灶的2年的累积局部失败率为15.1%。在不良反应方面,二程放疗后患者的耐受性良好,大部分患者仅出现1~2级血液学和肝脏不良反应,未出现放射性肝病或晚期不良反应。以上结果提示,对于部分已接受过放疗的不可手术结直肠癌肝转移患者,二程放疗仍可提供较好的局部疗效,且不良反应在可接受范围内,是这部分患者可选择的局部治疗手段之一。
局部治疗在结直肠癌肝转移患者中有着重要的地位[12]。对于可手术的患者,手术联合全身治疗可取得50~60个月的中位生存期[13]。而对于不可手术的患者,射频消融和放疗都是重要的局部治疗[12]。近年来,放疗在不可手术结直肠癌肝转移患者中的应用越来越多,接受放疗的结直肠癌肝转移患者2年局部控制率在70%~90%[6-7]。然而,对于放疗后肝内复发或局部失败的患者,可选择的局部治疗手段有限。随着放疗技术的发展,二程放疗逐渐在肝脏肿瘤中有所应用。SBRT技术在给予局部肿瘤高剂量照射的同时,其周边剂量快速跌落,可有效保护正常肝脏组织,有利于二程放疗的实施。既往研究报道,肝细胞癌患者接受二程SBRT治疗可取得较高的局部控制率,且安全性良好[9]。然而,结直肠腺癌放疗敏感性较肝细胞癌要低,往往需要更高的剂量以控制局部病灶[14],目前暂无专门针对结直肠癌肝转移二程放疗的研究报道。本研究首次在28例结直肠癌肝转移患者中初步探索了二程放疗的有效性和安全性。其中,SBRT是主要的放疗技术,有24例(85.7%)患者接受SBRT治疗。在局部控制率方面,二程放疗后基于病灶的2年累积局部失败率仅15.1%,这一结果与部分文献报道的首程放疗局部控制率相当[6-7, 15]。较好的局部控制率一方面可能是患者选择的原因,本研究中的患者有相对充足的正常肝脏储备,首程放疗的平均正常肝脏体积为1 283.3 cm3,而中位PTV体积仅为43.8 cm3,结合SBRT技术,在首程放疗后这组患者的正常肝脏功能得到了较好的保护,使得二程放疗仍可给予复发病灶相对充足的治疗剂量(中位BED为96.0 Gy)。相比之下,在McDuff等[8]的研究中,对肝转移瘤(52%为结直肠癌肝转移)实施中位BED 72.0 Gy的二程放疗后,1年局部复发率高达61.0%。其次可能是由于4D-MRI技术的应用,在二程放疗中,有78.6%的患者采用4D-MRI定位。4D-MRI技术可较好地显示局部病灶范围和呼吸动度,为治疗的准确实施提供了保障[16]。本研究中,二程放疗后的1年PFS为27.4%,3年OS达46.7%,在数值上甚至优于部分研究接受首程放疗后的OS[17-18],也提示二程放疗所带来的局部获益或可转化为长期生存获益。本研究中接受二程放疗的患者主要不良反应为1~2级不良反应,无患者出现放射性肝病,说明在这部分一程病灶较小,保存有充足肝脏储备的患者中,二程放疗总体耐受良好,仍相对安全。尽管本研究样本量偏小,且为回顾性研究,但以上结果也提示对于部分已接受过放疗的不可手术结直肠癌肝转移患者,二程放疗仍是有效且安全的局部治疗手段。
本研究中,二程放疗后患者的近期ORR为72.7%,但结合长期疗效来看,二程放疗后达到PR和SD的13枚病灶经中位45.2个月(1.5~45.2个月)的随访后,仅1枚病灶出现局部进展。这说明相对较低的ORR并不能反映二程放疗的实际疗效。这可能与RECIST 1.1评价标准有关,其评价病灶时未考虑到肿瘤强化程度的问题,只要肿瘤残存,即使影像学上已经没有强化表现,仍不能评价为CR[19]。相比之下,肝细胞癌采用的mRECIST标准则将病灶在动脉期是否强化纳入评价[20],在评价疗效时更为合理,但不同肝脏肿瘤的强化方式不同,直接套用mRECIST评价标准并不合适。随着放疗等局部治疗在结直肠癌肝转移瘤中的应用越来越多,未来还需要进一步探索更适合肝转移瘤的疗效评价标准,以提高近期疗效与局部控制率的相关性。
结直肠癌肝转移瘤对放疗相对不敏感,往往需要更高的放疗剂量以控制局部肿瘤[14]。在Joo等[21]的研究中,BED是结直肠癌肝转移患者局部控制率的独立预测因素,接受BED≤80 Gy,100~112 Gy和≥132 Gy的2年局部控制率分别为52%、83%和89%。本研究中,首程放疗时1例接受常规分割治疗的患者BED仅72 Gy,后续出现局部失败,经二程放疗补足剂量后达到PR且长期生存,提示给予结直肠癌肝转移瘤足够放疗剂量的重要性。然而,其他几例患者接受了BED在100 Gy左右的SBRT治疗后仍出现局部进展,1例患者在首程接受了60 Gy/8次的SBRT治疗后进展,二程又接受了50 Gy/10次的治疗,3个月后复查局部病灶仍有增大,这说明结直肠癌肝转移瘤可能存在较大的异质性,未来还需要进一步分析临床因素和分子指标,对患者的治疗剂量进行进一步优化。
本研究尚有一些不足。首先,本研究样本量较小,还需要更大样本量的研究或前瞻性研究进一步明确二程放疗的有效性和安全性;其次,本研究接受二程放疗的患者经过高度选择,能接受二程放疗的患者一般肝功能储备好、病灶远离重要危及器官、评估后可能从局部治疗中获益,其预后可能本身就优于不能接受二程放疗的患者,未来还需进一步研究确定适合二程放疗的患者特征。另外,本研究二程放疗后的随访时间相对较短,随着随访时间的延长可能会有更多病灶出现进展。
本研究提示,使用二程放疗来治疗经过选择的不可手术结直肠癌肝转移患者有效且安全。本研究为不可手术结直肠癌肝转移患者接受二程放疗提供了新的证据。然而,明确结论还需要更大规模的研究来验证。
利益冲突 无
作者贡献声明 郑宣负责资料收集、数据整理、统计分析和论文撰写;王洪智、董德左、朱向高、耿建昊、李帅、宋马小薇、张扬子、刘志艳、蔡勇、李永恒负责提供数据和论文修改;王维虎负责研究设计和论文修改
| [1] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
Helling TS, Martin M. Cause of death from liver metastases in colorectal cancer[J]. Ann Surg Oncol, 2014, 21(2): 501-506. DOI:10.1245/s10434-013-3297-7 |
| [3] |
Schadde E, Grunhagen DJ, Verhoef K, et al. Limitations in resectability of colorectal liver metastases 2020 - A systematic approach for clinicians and patients[J]. Semin Cancer Biol, 2021, 71: 10-20. DOI:10.1016/j.semcancer.2020.09.008 |
| [4] |
Ruers T, Coevorden F, Punt CJA, et al. Local treatment of unresectable colorectal liver metastases: results of a randomized phase Ⅱ trial[J]. J Natl Cancer Inst, 2017, 109(9): djx015. DOI:10.1093/jnci/djx015 |
| [5] |
Takahashi H, Berber E. Role of thermal ablation in the management of colorectal liver metastasis[J]. Hepatobiliary Surg Nutr, 2020, 9(1): 49-58. DOI:10.21037/hbsn.2019.06.08 |
| [6] |
Py JF, Salleron J, Courrech F, et al. Long-term outcome of stereotactic body radiation therapy for patient with unresectable liver metastases from colorectal cancer[J]. Cancer Radiother, 2021, 25(4): 350-357. DOI:10.1016/j.canrad.2021.01.004 |
| [7] |
Méndez Romero A, Keskin-Cambay F, Van os RM, et al. Institutional experience in the treatment of colorectal liver metastases with stereotactic body radiation therapy[J]. Rep Pract Oncol Radiother, 2017, 22(2): 126-131. DOI:10.1016/j.rpor.2016.10.003 |
| [8] |
McDuff SGR, Remillard KA, Zheng H, et al. Liver reirradiation for patients with hepatocellular carcinoma and liver metastasis[J]. Pract Radiat Oncol, 2018, 8(6): 414-421. DOI:10.1016/j.prro.2018.04.012 |
| [9] |
Kimura T, Takeda A, Tsurugai Y, et al. A multi-institutional retrospective study of repeated stereotactic body radiation therapy for intrahepatic recurrent hepatocellular carcinoma[J]. Int J Radiat Oncol Biol Phys, 2020, 108(5): 1265-1275. DOI:10.1016/j.ijrobp.2020.07.034 |
| [10] |
Hu Y, Caruthers SD, Low DA, et al. Respiratory amplitude guided 4-dimensional magnetic resonance imaging[J]. Int J Radiat Oncol Biol Phys, 2013, 86(1): 198-204. DOI:10.1016/j.ijrobp.2012.12.014 |
| [11] |
Diez P, Hanna GG, Aitken KL, et al. UK 2022 consensus on normal tissue dose-volume constraints for oligometastatic, primary lung and hepatocellular carcinoma stereotactic ablative radiotherapy[J]. Clin Oncol (R Coll Radiol), 2022, 34(5): 288-300. DOI:10.1016/j.clon.2022.02.010 |
| [12] |
Birrer DL, Tschuor C, Reiner C, et al. Multimodal treatment strategies for colorectal liver metastases[J]. Swiss Med Wkly, 2021, 151: w20390. DOI:10.4414/smw.2021.20390 |
| [13] |
Nordlinger B, Sorbye H, Glimelius B, et al. Perioperative FOLFOX4 chemotherapy and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC 40983): long-term results of a randomised, controlled, phase 3 trial[J]. Lancet Oncol, 2013, 14(12): 1208-1215. DOI:10.1016/s1470-2045(13)70447-9 |
| [14] |
Ahmed KA, Caudell JJ, El-Haddad G, et al. Radiosensitivity differences between liver metastases based on primary histology suggest implications for clinical outcomes after stereotactic body radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2016, 95(5): 1399-1404. DOI:10.1016/j.ijrobp.2016.03.050 |
| [15] |
Vautravers-Dewas C, Dewas S, Bonodeau F, et al. Image-guided robotic stereotactic body radiation therapy for liver metastases: is there a dose response relationship?[J]. Int J Radiat Oncol Biol Phys, 2011, 81(3): e39-e47. DOI:10.1016/j.ijrobp.2010.12.047 |
| [16] |
Thomas HR, Miao X, Ferguson D, et al. Contrast-enhanced 4D-MRI for internal target volume generation in treatment planning for liver tumors[J]. Radiother Oncol, 2022, 173: 69-76. DOI:10.1016/j.radonc.2022.05.037 |
| [17] |
Clerici E, Comito T, Franzese C, et al. Role of stereotactic body radiation therapy in the treatment of liver metastases: clinical results and prognostic factors[J]. Strahlenther Onkol, 2020, 196(4): 325-333. DOI:10.1007/s00066-019-01524-8 |
| [18] |
Chang DT, Swaminath A, Kozak M, et al. Stereotactic body radiotherapy for colorectal liver metastases: a pooled analysis[J]. Cancer, 2011, 117(17): 4060-4069. DOI:10.1002/cncr.25997 |
| [19] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [20] |
Lencioni R, Llovet JM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma[J]. Semin Liver Dis, 2010, 30(1): 52-60. DOI:10.1055/s-0030-1247132 |
| [21] |
Joo JH, Park JH, Kim JC, et al. Local control outcomes using stereotactic body radiation therapy for liver metastases from colorectal cancer[J]. Int J Radiat Oncol Biol Phys, 2017, 99(4): 876-883. DOI:10.1016/j.ijrobp.2017.07.030 |
 2023, Vol. 43
2023, Vol. 43


