肺组织巨噬细胞是维持肺部稳态的一种天然免疫细胞,在放射性肺损伤(RILI)的整个病理过程中均发挥关键作用。在RILI早期,肺组织巨噬细胞向M1型极化,分泌炎性细胞因子,诱导炎症反应,同时通过促进活性氧(ROS)级联反应,产生大量活性氧,进一步加剧肺组织损伤。在RILI中晚期,肺巨噬细胞向M2型极化,分泌抗炎促修复细胞因子,促进机体损伤修复。本实验制备了一种葡甘露聚糖修饰的自组装纳米颗粒(GM-PPS),通过调控肺组织巨噬细胞向抗炎促修复的M2表型极化,并通过聚丙烯硫醚的不饱和化学键结构消耗辐射损伤区域的活性氧,降低肺泡上皮细胞的氧化应激损伤,进而降低放射性肺组织早期炎症水平。本研究分别在细胞和动物水平考察糖基纳米颗粒对巨噬细胞极化、肺组织内的ROS以及炎症水平的调控能力,有望为放射性肺损伤救治提供无细胞无因子的新策略。
材料与方法1.实验动物:雄性C57BL/6小鼠(合格证号:110322231102115817),20只,6~8周龄,体重(20 ± 2)g,由北京华阜康生物科技股份有限公司提供[许可证号:SCXK(京)2020-0004],饲养于中国医学科学院北京协和医学院放射医学研究所实验动物中心。所有动物在无特定病原体(SPF)环境下,室内维持恒温(23℃ ± 2℃)、恒湿(45%~50%)及空气过滤(净化级别达100级)。所有动物的饲养和实验均获得中国医学科学院放射医学研究所动物实验伦理委员会批准[批准号:SYXK(津)2019-0002]。
2.主要试剂与仪器:DCFH-DA探针(D6470)购于北京索莱宝科技有限公司,流式抗体(SiglecF-APC,F4/80-APC,CD11c-PERCP,CD206-PE)购于美国BioLegend公司,酶联免疫吸附试验(ELISA)试剂盒白介素6(IL-6)购自美国R&D公司;谷胱甘肽(GSH)检测试剂盒购自上海碧云天生物技术公司,丙二醛(MDA)检测试剂盒购自武汉Elabscience公司,CCK-8试剂盒购自上海碧云天生物技术公司,组织单细胞提取试剂盒购自德国Miltenyi公司,生物学X射线辐照仪RS-2000购自美国Rad Source公司。
3.糖基纳米颗粒的制备及理化性质评价:将聚丙烯硫醚(PPS)与氧化多糖在二环己基碳二亚胺(DCC)和4-二甲氨基吡啶(DMAP)作用下发生酯化反应,得到糖基聚合物GM-PPS,并通过磁共振氢谱(1 H NMR)对其化学结构进行鉴定。将GM-PPS溶于水中(5 mg/ml),在4℃条件下,以20%额定功率超声破碎30 min。离心半径10 cm,3 000 r/min,离心5 min后得到GM-PPS纳米颗粒。使用Nanosizer ZS90(美国马尔文仪器公司)检测纳米颗粒的粒径大小。透射电子显微镜(TEM,日本日立公司)观察其形貌。所得纳米颗粒在磷酸盐缓冲液(PBS)中稀释,用于体外和体内实验。
4.CCK-8实验:将培养好的小鼠胚胎成纤维细胞NIH/3T3(美国ATCC公司)以5 × 103/孔的密度接种于96孔培养板中,每孔分别加入不同浓度的纳米颗粒溶液,孵育48 h后,用CCK-8试剂盒检测各细胞的存活率,以体外考察糖基纳米颗粒的生物相容性。
5.GSH含量检测:将培养好的3T3细胞以2 × 105/孔的密度接种于6孔培养板中,24 h后加入纳米颗粒使其浓度为500 μg/ml,孵育24 h后进行8 Gy照射,继续培养24 h,根据谷胱甘肽检测试剂盒说明书进行各组谷胱甘肽含量检测。
6.MDA含量检测:将培养好的3T3细胞以5 × 105/孔的密度接种于6 cm培养皿中,24 h后加入纳米颗粒,使其浓度为500 μg/ml,孵育24 h后进行8 Gy照射,继续培养48 h,根据试剂盒说明书进行各组MDA含量检测。
7.糖基纳米颗粒体内安全性评价:将制备的纳米颗粒经尾静脉注射到C57BL/6J小鼠体内(100 μg/只),28 d后收集血样,分析纳米颗粒对小鼠的血液不良反应(白细胞数、淋巴细胞数、单核细胞数)。从小鼠体内提取肝脏、脾脏、肾脏等器官,置于4%多聚甲醛溶液固定24 h,通过乙醇梯度脱水、组织透明、浸蜡、包埋和切片程序,获得5 μm厚度的组织切片。将各器官的石蜡切片进行苏木精-伊红(HE)染色,观察纳米颗粒体内的安全性。
8.C57BL/6小鼠X射线照射:将小鼠通过整体随机抽样法分为4组,每组5只:对照组、给药组、照射组和照射+给药组。照射组和照射+给药组进行X射线全肺照射,剂量率为2.69 Gy/min,剂量22 Gy,源皮距5 cm,照射野2 cm×2 cm。给药组以及照射+给药组分别在照射前1 d进行尾静脉注射(100 μg/只),给药频率为每2天一次,在照射后30 d对小鼠进行安乐死并取材。所有动物实验都在麻醉下无痛进行。
9.免疫荧光检测肺组织切片中ROS水平:分离小鼠肺组织标本,放置于4%多聚甲醛溶液固定24 h,通过乙醇梯度脱水、组织透明、浸蜡、包埋和切片程序,获得5 μm厚度的组织切片。经过二甲苯脱蜡、乙醇梯度复水、0.1% Triton X-100溶液破膜等过程在肺组织上滴加含DCFH2-DA的PBS染色液,24℃孵育2 h,用PBS洗涤3次。荧光显微镜观察肺组织中ROS的荧光强度,分析纳米颗粒对肺组织中ROS的清除水平。
10.HE染色检测肺组织病理变化:将制得的肺组织切片经过二甲苯脱蜡、乙醇梯度复水等过程,进行HE染色。随机选取10个不重叠的肺实质视野(× 20)观察和记录肺部损伤。
11.流式细胞仪检测肺组织中M2巨噬细胞的比例:分离小鼠肺组织,使用组织单细胞提取试剂盒进行消化,获得肺组织的单细胞悬液。然后进行细胞计数,按照流式抗体说明书进行标记,4℃孵育30 min,用PBS洗涤3次。最后用流式细胞仪进行检测,分析肺组织中M2型巨噬细胞的比例。
12.PCR检测肺组织中炎症基因及抗炎基因的表达:采用TRIzol法提取肺组织总RNA,用反转录试剂盒将RNA反转录为cDNA,以cDNA为模板进行PCR扩增。检测精氨酸酶1(ARG-1)、肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)等基因表达,同时检测甘油醛-3-磷酸脱氢酶(GAPDH)基因的表达作为内参。扩增条件:95℃ 10 min,95℃ 15 s,60℃ 1 min,循环35次。获得对应CT值,数据采用2-ΔΔCt法进行分析。引物由上海生工生物工程有限公司合成,序列如下:GAPDH引物序列:正向5′ CATCACTGCCACCCAGAAGACTG 3′,反向5′ ATGCCAGTGAGCTTCCCGTTCAG 3′;ARG-1引物序列:正向5′ CATTGGCTTGCGAGACGTAGAC 3′,反向5′ GCTGAAGGTCTCTTCCATCACC 3′;TNF-α引物序列:正向5′ GGTGCCTATGTCTCAGCCTCTT 3′,反向5′ GCCATAGAACTGATGAGAGGGAG 3′;IL-1β引物序列:正向5′ TGGACCTTCCAGGATGAGGACA 3′,反向5′ GTTCATCTCGGAGCCTGTAGTG 3′。
13.ELISA检测血液和肺组织液中炎症因子的分泌:收集小鼠的血液以及支气管肺泡灌洗液(BALF),血液在室温放置2 h后,2 000 × g,离心10 min,离心两次收集血清;将BALF用超滤离心管在4℃条件下5 000 × g,离心30 min,浓缩蛋白。按照ELISA试剂盒说明书定量检测IL-6的含量。
14.统计学处理:使用SPSS 22.0软件进行统计学分析。实验至少重复3次。计数资料采用卡方检验。计量资料结果符合正态分布,以x±s表示,采用Student′s t检验,数据符合方差齐性,采用方差分析。P < 0.05为差异具有统计学意义。
结果1.糖基纳米颗粒的制备、理化性质表征及体外安全性评价:将GM-PPS偶联物在冰上超声破碎30 min,制得GM-PPS纳米粒子。动态光散射测试结果表明,GM-PPS具有两亲性,可以自组装成纳米结构,其平均流体力学直径为(375.2 ± 18.6)nm(图 1A)。TEM图像显示形成了不规则球形的核-壳纳米结构(图 1B)。通过CCK-8实验研究了不同浓度的纳米颗粒对正常小鼠成纤维细胞(3T3)的细胞毒性,结果表明,当纳米颗粒浓度低于1 000 μg/ml时,均无毒性(图 1C)。因此,通过GM和PPS的共价偶联成功制备了自组装糖肽纳米颗粒。

|
图 1 糖基纳米颗粒的表征 A.粒径分布图;B.代表性透射电镜图;C. 细胞毒性实验结果图 Figure 1 Characteristics of glycosylated nanoparticles A. Particle size distribution; B. Representative TEM image; C. Cytotoxicity assay results |
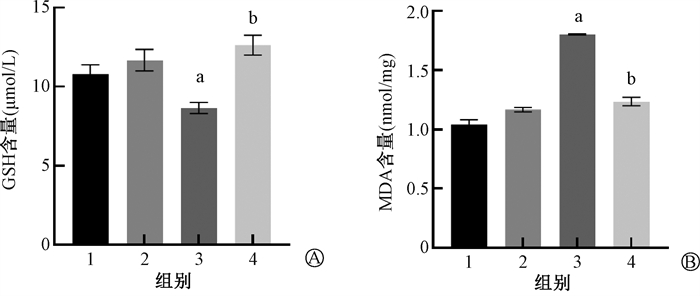
2.糖基纳米颗粒有效清除照射后细胞内的ROS:结果显示,相较于对照组,照射组的GSH含量明显减少(t=3.11, P < 0.05),说明ROS水平高;而照射+给药组相较于照射组,GSH含量显著增多,说明ROS水平有所降低(t=5.53,P < 0.05)。相较于对照组,照射组的MDA含量明显增多(t=18.19, P < 0.05),说明细胞内ROS水平升高;而照射+给药组相较于照射组,MDA含量显著减少(t=15.96,P < 0.05)。以上结果说明糖基纳米颗粒能够有效清除照射后细胞(3T3)内产生的ROS,见图 2。
|
注:GSH.谷光甘肽;MPA.丙二醛。1.对照组;2.给药组;3.照射组;4.照射+给药组;a与对照组相比,t=3.11、18.19,P < 0.05; b与照射组相比,t=5.53、15.96,P < 0.05 图 2 糖基纳米颗粒对受照3T3细胞内氧化能力的影响 A.GSH水平;B. MDA水平 Figure 2 Effects of glycosylated nanoparticles on the oxidation ability in irradiated 3T3 cells A. GSH level; B. MDA level |
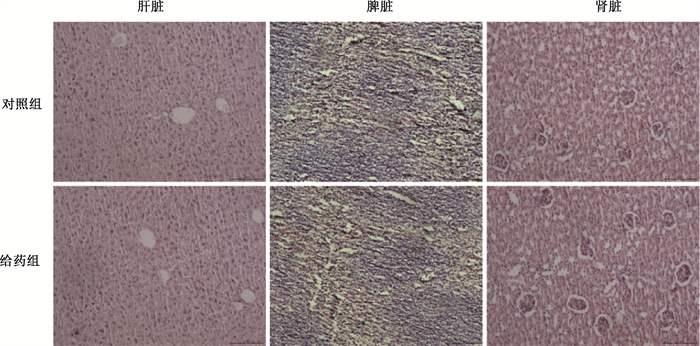
3.糖基纳米颗粒的体内安全性评价:HE结果显示,给药组的肝脏、脾脏、肾脏的病理结构与对照组无明显差异(图 3),说明该糖基纳米颗粒具有良好的组织相容性。
|
图 3 糖基纳米颗粒的体内安全性评价HE染色×20 Figure 3 In vivo safety evaluation of glycosylated nanoparticles HE staining ×20 |
同时,通过血常规检测评估了糖基纳米颗粒的体内安全性。单纯给药组和对照组中的白细胞数目(8.6×109±1.2×109vs. 9.0×109±1.8×109)、淋巴细胞比例(77.8%±5.9% vs.75.7%±4.9%)以及单核细胞比例(3.0%±0.3% vs.3.2%±0.4%)差异均无统计学意义(P>0.05),说明该糖基纳米颗粒具有良好的血液相容性。
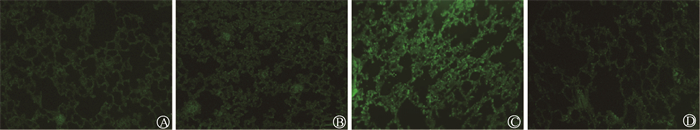
4.糖基纳米粒颗有效清除照射后肺组织内的活性氧:肺组织切片的免疫荧光结果显示,相较于对照组,照射组中,ROS荧光信号强度明显增多,而照射+给药组相较于照射组,ROS荧光强度明显降低,给药组与对照组中ROS荧光无明显差异(图 4)。对照组、给药组、照射组、照射+给药组平均荧光强度分别为30.43、31.56、50.73、30.00,相较于照射组,照射+给药组的平均荧光强度降低,差异具有统计学意义(t= 16.76,P < 0.05)。以上结果说明糖基纳米颗粒能够有效清除肺组织中的ROS。
|
图 4 各处理组的肺组织中活性氧水平×20 A.对照组;B.给药组;C.照射组;D.照射+给药组 Figure 4 ROS levels in lung tissues of each group ×20 A. Control group; B. Drug administration group; C. Irradiation group; D. Irradiation + drug administration group |
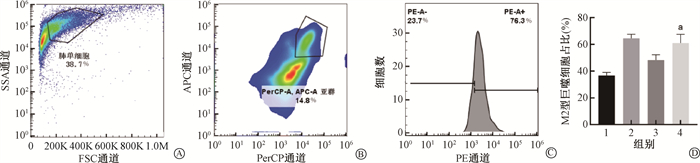
5.糖基纳米颗粒调控肺组织巨噬细胞的M2极化:通过siglecF+CD11c+圈出肺组织单细胞悬液中的肺泡巨噬细胞(图 5A),在该细胞群中通过CD206+圈出M2型的巨噬细胞。相较于照射组,照射+ 给药组的M2型巨噬细胞比例更高,差异具有统计学意义(t= 2.89,P < 0.05,图 5B),说明糖基纳米颗粒具有调控肺组织巨噬细胞向M2型极化的能力。
|
注:1.对照组;2. 给药组;3. 照射组;4. 照射+给药组;a与照射组相比,t= 2.89,P < 0.05 图 5 糖基纳米颗粒调控肺组织巨噬细胞的M2极化 A. 肺组织单细胞圈门策略;B. 肺组织单细胞悬液中巨噬细胞圈门策略;C. 巨噬细胞中M2型占比;D. 肺组织单细胞悬液中M2型巨噬细胞的比例 Figure 5 Glycosylated nanoparticles modulate the polarization of M2 macrophages in lung tissue A. Lung tissue single-cell trapdoor strategy; B. Macrophage trapdoor strategy single-cell suspension of lung tissue; C. Percentage of M2 macrophages in total macrophages; D. Percentage of M2 macrophages in the single-cell suspension of lung tissue |
6.糖基纳米颗粒降低放射性肺组织中炎症因子的分泌:相较于照射组,照射+给药组的ARG-1基因表达升高(t= 3.32,P < 0.05)),TNF-α(t= 2.90,P < 0.05)和IL-1β(t= 2.85,P < 0.05)基因表达水平下降,差异均具有统计学意义,说明照射+给药组中增加的M2巨噬细胞发挥了主要的抗炎作用,降低了炎症因子TNF-α以及IL-1β的表达。同时,相较于照射组,照射+给药组小鼠血液中与肺泡灌洗液中的IL-6炎症因子蛋白水平显著下降(t= 4.55、2.88,P < 0.05),进一步说明糖基纳米颗粒降低放射性肺组织及全身的炎症水平。
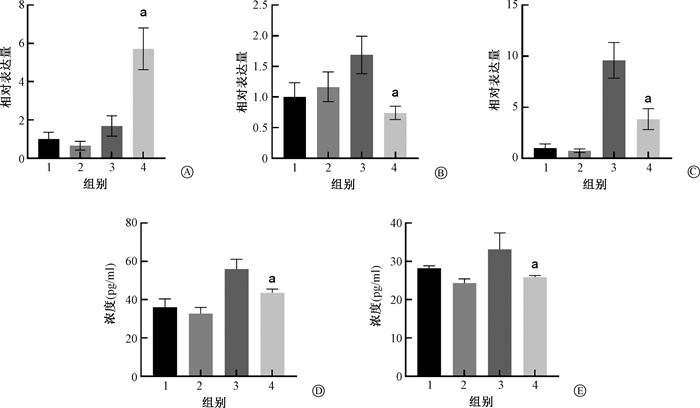
|
注:1.对照组;2.给药组;3.照射组;4.照射+给药组;a与照射组相比,t= 3.32、2.90、2.85、4.55、2.88,P < 0.05 图 6 各组炎症因子表达情况 A. PCR检测肺组织中M2型巨噬细胞标志基因ARG-1的表达;B. PCR检测肺组织中TNF-α炎症基因的表达水平;C. PCR检测肺组织中IL-1β炎症基因的表达水平;D. ELISA实验检测小鼠血清中IL-6炎症因子含量;E. ELISA实验检测小鼠肺泡灌洗液中IL-6炎症因子含量 Figure 6 The expressions of inflammatory factors in each group A. PCR assay of the expression of ARG-1 gene, a M2-type macrophage marker, in lung tissue; B. PCR assay of TNF-α gene in lung tissues; C. PCR assay of IL-1β gene in lung tissue; D. ELISA assay of IL-6 inflammatory factor in mouse serum; E. ELISA assay of IL-6 inflammatory factor in alveolar lavage fluid of mice |
7.糖基纳米颗粒改善放射性肺组织病理表现:HE染色结果见图 7。相较于对照组,照射组肺泡的完整性降低,肺质地增厚。而照射+给药组相较于照射组,肺部的损伤有显著的缓解,具体表现为破碎的肺泡壁得以修复,肺的质地恢复接近正常,聚集的炎症细胞减少。说明糖基纳米颗粒可以有效改善肺部照射后的病理损伤。
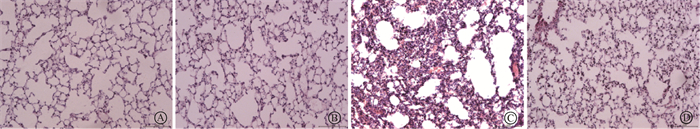
|
图 7 糖基纳米颗粒对肺组织病理变化的影响HE染色×20 A. 对照组;B.给药组;C.照射组;D.照射+给药组 Figure 7 Effects of glycosylated nanoparticles on lung tissues in each treatment group HE staining ×20 A. Control group; B. Drug administration group; C. Irradiation Group; D. Irradiation + drug administration group |
讨论
放射治疗是肿瘤综合治疗的重要手段之一,肺是辐射中度敏感器官,在胸部肿瘤的放射治疗中,放射性肺损伤是最常见的剂量限制因素,主要影响肺癌、乳腺癌、淋巴瘤或接受全身照射的骨髓移植患者[1-2]。最新数据表明,肺癌的放射性肺损伤发病率为5%~25%,其次是纵隔淋巴瘤(5%~10%)和乳腺癌(1%~5%)。放射性肺损伤的临床鉴别在癌症患者中尤其困难,临床表现常常因为其他基础疾病的存在而变得复杂,如肿瘤本身(无呼吸、梗阻和淋巴管炎)、药物(即化疗)或感染[3-4]。放射性肺损伤过程可以总结为辐射引起的细胞损伤导致炎性细胞因子的释放,进而招募炎性细胞浸润发展为急性肺炎[5];其次,机体对损伤的过度修复还会发展为肺纤维化[6]。巨噬细胞分为M1、M2型巨噬细胞。M1巨噬细胞主要分泌多种促炎因子及一氧化氮合酶。M2巨噬细胞主要分泌血管内皮生长因子、血小板衍生因子等,同时诱导产生精氨酸酶,具有抗炎、促进损伤修复的作用[7]。大量数据表明,疾病发生的早期炎症阶段,M2巨噬细胞的增加有助于清除病原微生物,抑制炎症反应[8]。
当肺组织受到电离辐射作用后,产生活性氧类物质,破坏DNA、蛋白质及脂膜;若机体的抗氧化体系,包括过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶等不足以抵消这种破坏时,便会出现氧化应激损伤[9-10]。在照射组损伤的肺组织中检测到大面积的绿色荧光,说明肺损伤后ROS的表达大幅度升高,ROS主要由肺上皮细胞和炎症细胞产生,从而导致急性肺组织炎症。但在照射+给药组ROS+细胞密度明显低于照射组,说明该纳米颗粒通过聚丙烯硫醚的不饱和化学键消耗受照肺组织内的ROS。然后,通过鉴定肺组织巨噬细胞的浸润和极化比例,进一步研究放射性肺损伤部位的炎症反应。在组织损伤修复过程中,巨噬细胞表型的M1-M2转换对于抑制慢性炎症和促进组织再生至关重要[11]。选择SiglecF用于鉴定肺巨噬细胞,CD206作为M2巨噬细胞的表面标记物。结果发现,照射+给药组中M2巨噬细胞的百分比明显高于照射组,说明纳米颗粒通过诱导肺巨噬细胞表面的甘露糖受体聚集[12-14],调控其向抗炎促修复M2表型极化,对炎症进行拮抗。为了进一步揭示纳米颗粒对放射性肺损伤炎症反应的影响,通过PCR分析评估肺组织中促炎细胞因子的表达。结果显示,纳米颗粒治疗降低了TNF-α、IL-1β和IL-6促炎细胞因子的表达,提高了抗炎基因ARG-1的表达。说明这种纳米颗粒可能阻断肺组织内M1巨噬细胞ROS—炎症反应通路,从而降低放射性肺炎早期炎症水平[15]。
本实验基于急性肺炎早期的病理特征,制备了一种葡甘露聚糖修饰的纳米颗粒(GM-PPS), 可有效清除ROS,促进M2型巨噬细胞极化,抑制炎症反应,从而缓解RILI。但本实验仍有很多不足之处,首先,本研究为初步探索性研究,仅进行了糖基纳米颗粒对辐射诱导的肺组织效果研究,而未对纳米材料进行剂量研究,后续将进一步研究药效与剂量的关系;其次,糖基纳米颗粒调控辐射诱导的肺组织巨噬细胞极化的具体作用机制需要进一步深入研究和探讨。
综上所述,本研究成功制备了一种糖基纳米颗粒,其能有效清除ROS,诱导M2巨噬细胞极化,降低炎症微环境,缓解放射性肺损伤。该纳米颗粒具有制造简单、粒径均一、化学性质稳定和安全性高等优点。此外,聚丙烯硫醚的引入使纳米颗粒具有清除ROS和辐射防护能力,可以减轻辐照后组织部位的急性损伤和炎症反应。此外,葡甘露聚糖与巨噬细胞有高亲和力可以通过甘露糖受体聚集诱导巨噬细胞向M2型极化。因此,该糖基纳米颗粒不含任何药物、细胞因子和细胞,能有效降低炎症反应。这项研究也强调了免疫调节策略在急慢性炎症中的重要性。总之,这种多功能糖基纳米颗粒是一种很有前途的候选者,用于临床防治辐射引起的肺损伤,也可用于其他类型的组织损伤,如肠损伤、皮肤损伤。
利益冲突 无
作者贡献声明 李科君负责研究课题的设计、实施、数据分析、论文撰写;杜利清负责设计研究课题和论文审阅;刘强负责指导实验和论文审阅;宋会娟指导实验的实施、数据的分析以及论文修改
| [1] |
Yan Y, Fu J, Kowalchuk RO, et al. Exploration of radiation-induced lung injury, from mechanism to treatment: a narrative review[J]. Transl Lung Cancer Res, 2022, 11(2): 307-322. DOI:10.21037/tlcr-22-108 |
| [2] |
Hanania AN, Mainwaring W, Ghebre YT, et al. Radiation-induced lung injury: assessment and management[J]. Chest, 2019, 156(1): 150-162. DOI:10.1016/j.chest.2019.03.033 |
| [3] |
Marks LB, Bentzen SM, Deasy JO, et al. Radiation dose-volume effects in the lung[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3 Suppl): S70-S76. DOI:10.1016/j.ijrobp.2009.06.091 |
| [4] |
Pinnix CC, Smith GL, Milgrom S, et al. Predictors of radiation pneumonitis in patients receiving intensity modulated radiation therapy for Hodgkin and non-Hodgkin lymphoma[J]. Int J Radiat Oncol Biol Phys, 2015, 92(1): 175-182. DOI:10.1016/j.ijrobp.2015.02.010 |
| [5] |
Yahyapour R, Shabeeb D, Cheki M, et al. Radiation protection and mitigation by natural antioxidants and flavonoids: implications to radiotherapy and radiation disasters[J]. Curr Mol Pharmacol, 2018, 11(4): 285-304. DOI:10.2174/1874467211666180619125653 |
| [6] |
Meziani L, Mondini M, Petit B, et al. CSF1R inhibition prevents radiation pulmonary fibrosis by depletion of interstitial macrophages[J]. Eur Respir J, 2018, 51(3): 1702120. DOI:10.1183/13993003.02120-2017 |
| [7] |
Ogger PP, Byrne AJ. Macrophage metabolic reprogramming during chronic lung disease[J]. Mucosal Immunol, 2021, 14(2): 282-295. DOI:10.1038/s41385-020-00356-5 |
| [8] |
S N SG, Raviraj R, Nagarajan D, et al. Radiation-induced lung injury: impact on macrophage dysregulation and lipid alteration - a review[J]. Immunopharmacol Immunotoxicol, 2019, 41(3): 370-379. DOI:10.1080/08923973.2018.1533025 |
| [9] |
李成城, 张秋宁, 王小虎. 活性氧与放射性肺损伤的相关研究进展[J]. 辐射研究与辐射工艺学报, 2019, 37(6): 5-11. Li CC, Zhang QN, Wang XH. A review of the relationship of reactive oxygen species with radiation-induced lung injuries[J]. J Radiat Res Radiat Processing, 2019, 37(6): 1-7. DOI:10.11889/j.1000-3436.2019.rrj.37.060101 |
| [10] |
Mahmoud AM, Wilkinson FL, Sandhu MA, et al. Modulating oxidative stress in drug-induced injury and metabolic disorders: the role of natural and synthetic antioxidants[J]. Oxid Med Cell Longev, 2019, 2019: 3206401. DOI:10.1155/2019/3206401 |
| [11] |
牛卓娅, 张亚玲, 姚智燕, 等. 巨噬细胞极化与炎性疾病的研究进展[J]. 河北医科大学学报, 2020, 41(6): 4. Niu ZY, Zhang YL, Yao ZY, et al. Advances in macrophage polarisation and inflammatory diseases[J]. J Hebei Med Univ, 2020, 41(6): 4. DOI:10.3969/j.issn.1007-3205.2020.06.028 |
| [12] |
Gan J, Dou Y, Li Y, et al. Producing anti-inflammatory macrophages by nanoparticle-triggered clustering of mannose receptors[J]. Biomaterials, 2018, 178: 95-108. DOI:10.1016/j.biomaterials.2018.06.015 |
| [13] |
Gan J, Liu C, Li H, et al. Accelerated wound healing in diabetes by reprogramming the macrophages with particle-induced clustering of the mannose receptors[J]. Biomaterials, 2019, 219: 119340. DOI:10.1016/j.biomaterials.2019.119340 |
| [14] |
Feng Z, Zhang Y, Yang C, et al. Bioinspired and inflammation-modulatory glycopeptide hydrogels for radiation-induced chronic skin injury repair[J]. Adv Healthc Mater, 2023, 12(1): e2201671. DOI:10.1002/adhm.202201671 |
| [15] |
荣建芳, 余韬, 舒徐. 活性氧调控巨噬细胞极化的研究进展[J]. 基础医学与临床, 2019, 39(1): 92-96. Chai JF, Yu T, Shu X. Research progress of ROS in regulating macrophage polarization[J]. Basic Clin Med, 2019, 39(1): 92-96. DOI:10.3969/j.issn.1001-6325.2019.01.024 |
 2023, Vol. 43
2023, Vol. 43


