低剂量CT(low dose CT,LDCT)可以降低肺癌高危人群死亡率,已被广泛用于肺癌筛查[1]。此外,LDCT经常发现冠状动脉钙化(coronary artery calcium,CAC),借助其评估的钙化积分(calcium scoring,CACS)与心电门控心脏CT的评估结果一致性良好[2-3],因此指南推荐在LDCT检查中报告CAC[4-5]。目前,与LDCT比较,已开始应用于肺癌筛查的超低剂量胸部CT(ultra-low-dose chest CT,ULD-CT)可进一步降低辐射剂量至亚mSv。该技术除在肺结节的检出和诊断方面有较高的准确性外,也可发现CAC[6-7]。因此,使用ULD-CT不仅可降低总的辐射剂量,也可潜在的附加评估CACS。但ULD-CT所使用的sn100 kVp会降低钙的CT值并造成CACS的低估,因此,需要调整钙的阈值以提供相当的CACS[8]。对此,钙感知重建算法通过校正不同kVp下钙的CT值,能重建出等效120 kVp标准卷积核的骨和钙的图像[9-10]。据此,本研究旨在探讨ULD-CT中不同重建算法对CACS评估的影响,验证ULD-CT联合钙感知算法评估CACS的临床可行性。
资料与方法1. 研究对象:本研究为前瞻性研究,通过了浙江省人民医院伦理委员会的审核(批号:QT2022165),并获得所有患者的书面知情同意书。收集2022年4月至10月于浙江省人民医院在同一定位像下行心电门控CACS CT(CACS-CT)扫描和非心电门控ULD-CT平扫的患者120例,年龄≥40岁。排除标准:冠状动脉搭桥或支架植入术后;心脏金属植入物史;胸部横径>35 cm。最终纳入115名患者,其中男性67例,女性48例;年龄41~83岁,平均(62.91±9.69)岁;体质量指数15.79~29.55 kg/m2,平均(23.11±2.74)kg/m2。根据扫描技术和重建卷积核将影像资料分为3组:标准CACS-CT扫描采用卷积核Qr36重建,定义为CACS-CTQr组;ULD-CT扫描采用卷积核Qr36和Sa36重建,分别定义为ULD-CTQr组和ULD-CTSa组。
2. 扫描协议:使用第3代双源CT (SOMATOM Force,西门子公司,德国) 进行扫描。探测器准直2 × 192 × 0.6 mm,机架旋转时间0.25 s/r。两次扫描的具体采集参数如下:①CACS-CT扫描:采用前瞻性心电门控触发的序列采集模式,采集期相为R-R间期的70%。管电压120 kVp,使用CARE Dose4D技术,质量参考mAs为80。②ULD-CT平扫:采用非心电门控大螺距扫描模式,螺距为3.0。管电压sn100 kVp, 使用CARE Dose4D技术,质量参考mAs为106。所有患者取仰卧位,扫描方位为头足方向,嘱患者吸气后屏气进行扫描。CACS-CT扫描范围为从气管隆突到心脏膈面;ULD-CT扫描范围为从胸腔入口到后肋膈角。所有横断面图像均使用滤波反投影法重建,CACS-CTQr和ULD-CTQr使用标准重建卷积核Qr36,ULD-CTSa使用钙感知重建卷积核Sa36。图像重建层厚为3 mm,层间隔为1.5 mm。
3. CACS量化:横断面图像均传送至专用的后处理工作站(syngo.via,VB20,德国西门子公司),使用半自动CACS量化工作流进行分析。2名分别具有11年和6年心脏后处理经验的技师在对患者临床资料和重建序列不知情的情况下独立评估所有重建图像的CACS,评估结果的平均值作为最终量化结果。
钙化定义为病灶面积≥1.03 mm2,衰减值>130 HU[11]。测定左主干、左前降支、左回旋支和右冠状动脉钙化灶的CACS,并累计作为患者水平的CACS。CACS使用Agatston法[11],分为存在(>0)和不存在(=0)两类。基于CACS值将心血管风险等级划分极低风险(0)、轻度风险(1~99)、中度风险(100~399)和重度风险(≥400)。为了评估扫描协议间CACS的差异,对于CACS>0的患者计算CACS差异百分比[2]:
| $ \text { 差异百分比 }=\left(\frac{2 \times\left|\operatorname{CACS}_{\text {CACS-CT }}-\mathrm{CACS}_{\mathrm{ULD}-\mathrm{CT}}\right|}{\mathrm{CACS}_{\mathrm{CACS}-\mathrm{CT}}+\mathrm{CACS}_{\mathrm{ULD}-\mathrm{CT}}}\right) \times 100 \% $ | (1) |
4. 客观图像质量评价:将一个感兴趣区(3 cm2) 放置于冠状动脉左主干起点水平的升主动脉,测量升主动脉CT值作为信号强度,其标准差(standard deviation,SD)作为噪声。依据信号强度/噪声计算图像信噪比(signal noise ratio, SNR)。由2名分别具有4年和3年心血管成像经验的技师采用双盲法进行测量,测量结果平均值计入最终结果。
5. 辐射剂量估算:记录每次扫描后设备提供的容积CT剂量指数(CT dose index volume,CTDIvol)和剂量长度乘积(dose length product,DLP)。分别使用心脏和胸部特异性转换因子计算CACS-CT和ULD-CT的有效剂量(effective radiation dose,E)。
| $ \mathrm{CACS-CT}\; E= \mathrm{DLP} (\mathrm{mGy} \cdot \mathrm{cm}) \times 0.026\left(\mathrm{mSv} \cdot \mathrm{mGy}^{-1} \cdot\right. \left.\mathrm{cm}^{-1}\right) $ | (2) |
| $ \text { ULD-CT } E=\text { DLP }(\mathrm{mGy} \cdot \mathrm{cm}) \times 0.014\left(\mathrm{mSv}^{-\mathrm{mGy}^{-1}} \cdot\right. \left.\mathrm{cm}^{-1}\right) $ | (3) |
6. 统计学处理:使用SPSS 26.0进行统计分析,对计量资料进行正态性检验,正态分布数据描述为x±s,非正态分布描述为中位数(下四分位数,上四分位数)[M (Q1, Q3)]。符合正态分布使用配对样本t检验,否则使用Wilcoxon signed-ranks检验。CACS量化观察者间一致性分析使用组内相关系数(intra-class correlation coefficient,ICC)。在CAC检测效能方面,以CACS-CT的结果为参照,计算ULD-CT检测CAC的准确性,并使用kappa评估扫描协议间CAC检测一致性。使用Friedman检验比较3组CACS和客观图像质量,如果差异有统计学意义,则使用Wilcoxon signed-ranks检验进行两两比较。扫描协议间CACS的相关性评估使用Spearman相关分析,一致性评估使用ICC和Bland-Altman图。由于误差随CACS的增加而增加,因此使用非均匀差异回归来估算Bland-Altman图的95%一致性界限[12]。使用线性加权kappa评估扫描协议间风险分类的一致性。k>0.90被解释为一致性极好。P <0.05为差异有统计学意义。
结果1. CAC的检测:ULD-CT两组检测CAC的准确性见表 1。CACS-CTQr中66.96%(77/115)患者发现CAC。以CACS-CTQr检出结果为参照,ULD-CTSa检测CAC的准确性稍高于ULD-CTQr;ULD- CTSa检测CAC一致性的kappa值高于ULD-CTQr[k= 0.921(95%CI: 0.845~0.997)vs. 0.902(95%CI: 0.818~0.986)]。ULD-CTQr和ULD-CTSa中假阳性均有2例;ULD-CTQr假阴性有3例,而ULD-CTSa仅2例。两组假阴性结果都发生在CACS-CTQr单一钙化灶的患者中,CACS值为1.1~2.8。
|
|
表 1 ULD-CT两组检测CAC的准确性(%) Table 1 Accuracy of CAC detection in two groups of ULD-CT(%) |
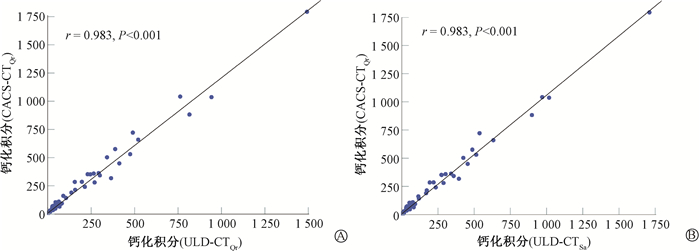
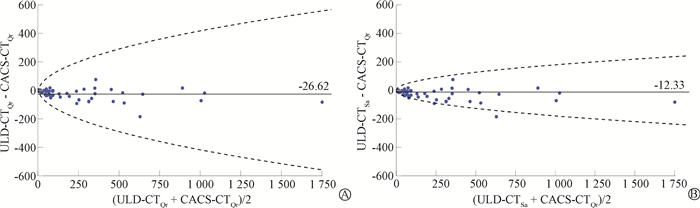
2. CACS定量:CACS-CTQr、ULD-CTQr和ULD-CTSa在CACS量化方面显示出极好的观察者间一致性,ICC值分别为1(95%CI: 1~1)、1(95%CI: 0.999~1)、1(95%CI: 0.999~1)。CACS-CTQr、ULD-CTQr和ULD-CTSa 3组CACS中位数分别为8.5(0~94.1)、3.6(0~63.9)、6.2(0~75.9),差异有统计学意义(M=117.43,P<0.001)。两两比较ULD-CTQr与CACS-CTQr、ULD-CTSa与CACS-CTQr、ULD-CTQr与ULD-CTSa间CACS差异均有统计学意义(Z = -7.34、-7.58、-5.68, P<0.001)。ULD-CTQr和ULD-CTSa与CACS-CTQr间的CACS均有强相关性(r = 0.983,P<0.001),见图 1。ULD-CTQr和ULD-CTSa与CACS-CTQr间的CACS一致性极好(ICC = 0.968、0.992,P<0.001);Bland-Altman图显示ULD-CTSa与CACS-CTQr间CACS的95%一致性界限较ULD-CTQr更窄,CACS平均差值分别为-12.33、-26.62(图 2)。同与CACS-CTQr相比,ULD-CTSa的CACS差异百分比中位数小于ULD-CTQr(26.33% vs. 42.42%)。基于CACS-CTQr的心血管风险分类:轻度风险、中度风险和重度风险中,ULD-CTQr的差异百分比中位数分别为66.67%、33.09%、20.96%;ULD-CTSa的百分比差异中位数分别为40.18%、21.90%、4.52%。
|
注:ULD-CTQr. 超低剂量胸部CT,重建卷积核为Qr36;ULD-CTSa. 超低剂量胸部CT,重建卷积核为Sa36;CACS-CTQr. 钙化积分CT,重建卷积核为Qr36;CACS. 钙化积分 图 1 ULD-CTQr或ULD-CTSa与CACS-CTQr 间CACS的相关性 A. ULD-CTQr;B. ULD-CTSa Figure 1 Correlation of CACS between ULD-CTQr or ULD-CTSa and CACS-CTQr A. ULD-CTQr; B. ULD-CTSa |
|
注:ULD-CTQr. 超低剂量胸部CT,重建卷积核为Qr36;ULD-CTSa. 超低剂量胸部CT,重建卷积核为Sa36;CACS-CTQr. 钙化积分CT,重建卷积核为Qr36;CACS. 钙化积分 图 2 ULD-CTQr或ULD-CTSa与CACS-CTQr间CACS一致性的Bland-Altman图 A. ULD-CTQr;B. ULD-CTSa Figure 2 Bland-Altman plots showing agreement of CACS between ULD-CTQr or ULD-CTSa and CACS-CTQr A. ULD-CTQr; B. ULD-CTSa |
3. 风险分类:基于CACS的心血管风险分类病例分布见表 2。以CACS-CTQr为参照,ULD-CTSa 风险分类的一致性高于ULD-CTQr[加权k:0.936 (95%CI: 0.851~0.964) vs. 0.907(95%CI: 0.888, 0.983)]。ULD-CTSa重新分类率为6.08%(7/115),低于ULD-CTQr的8.7%(10/115)。重新分类的患者中ULD-CTSa 71.43%(5/7)被分类到低一级风险等级,而ULD-CTQr为80%(8/10)。两组重新分类的患者均被错误分类到相邻风险等级。
|
|
表 2 CACS-CT与ULD-CT风险分类病例分布(n=115) Table 2 Distribution of patients with CACS-CT and ULD-CT risk categorization(n=115) |
4. 客观图像质量:CACS-CTQr、ULD-CTQr和ULD-CTSa3组噪声和SNR差异均有统计学意义(M = 194.98、117.87,P<0.001,表 3)。ULD-CTQr和ULD-CTSa的噪声均高于CACS-CTQr(Z = -9.34、-9.33,P<0.001),SNR均低于CACS-CTQr(Z = -9.31、-9.31,P<0.001)。ULD-CTQr和ULD-CTSa间噪声差异有统计学意义(Z = -2.74,P<0.05),而SNR差异无统计学意义(P>0.05)。
|
|
表 3 CACS-CT和ULD-CT客观图像质量比较[M(Q1, Q3)] Table 3 Comparison of objective image quality between CACS-CT and ULD-CT [M(Q1, Q3)] |
5. 辐射剂量:相比于CACS-CT,ULD-CT的CTDIvol、DLP和E分别减少了约84.58%、57.43%和77.22%,其差异均具有统计学意义(Z=-9.31、-9.31、-9.31,P<0.001,表 4)。
|
|
表 4 CACS-CT和ULD-CT辐射剂量比较[M(Q1, Q3)] Table 4 Comparison of radiation dose between CACS-CT and ULD-CT [M(Q1, Q3)] |
讨论
本研究使用第三代双源CT对非心电门控大螺距ULD-CT和心电门控CACS-CT采集的CACS进行比较,结果显示ULD-CT联合钙感知重建算法在CAC检测方面有很高的准确性;ULD-CT联合钙感知重建算法低估了CACS,但与CACS-CT的CACS有很强的相关性和极好的一致性,且两者在风险分类方面一致性极好。
本研究中ULD-CT检测CAC的敏感性为96.1%~97.4%,与使用第三代双源和256排CT行LDCT扫描的结果(95%~96%)相似[2, 13],并高于64排CT检测结果(86%~91%)[14-15]。本研究更高的敏感性可能与大螺距扫描在一定程度上减少了冠状动脉的运动伪影有关。此外,大螺距扫描通常与sn100 kVp结合,可显著降低辐射剂量。本研究中ULD-CT的ED仅为0.18 mSv,比CACS-CT减少了约77.22%。需要注意的是辐射剂量降低将增加图像的噪声,导致噪点被误识别为钙化,因此ULD-CTQr和ULD-CTSa的2例假阳性可能与此有关。同时结果中使用常规算法重建的ULD-CTQr有3例假阴性,这可能与sn100 kVp将钙的CT值降低到钙化识别阈值130 HU以下导致不被识别有关。但钙感知算法可以校正不同kVp下钙的CT值,本研究中ULD-CTSa检测CAC的假阴性较ULD-CTQr减少也佐证了钙感知算法具有提高CAC检测的能力。
本研究中ULD-CTQr和ULD-CTSa的CACS中位数均低于CACS-CTQr,但均与CACS-CTQr有很强的相关性,这与先前报道胸部CT评估CACS的研究相似[2-3, 16]。ULD-CT低估CACS可能与该技术无法消除冠状动脉运动模糊和sn100 kVp增加了平均光子能量,导致钙的CT值降低有关[17-18]。在CACS量化一致性方面,使用钙感知算法重建的ULD-CTSa与CACS-CTQr的一致性要优于常规算法重建的ULD-CTQr (ICC = 0.992 vs. 0.968)。同样Bland-Altman图也显示,ULD-CTSa与CACS-CTQr间更窄的95%一致性界限及更小的差异百分比(26.33% vs. 42.42%)。上述结果表明,钙感知重建算法可以削弱管电压变化对CACS量化的不利影响[17]。在CACS量化差异方面,ULD-CT与CACS-CT间CACS的绝对差值随着CACS的增加而增加,而差异百分比随着风险等级的增加却降低,这与以往报道CACS量化扫描重复性有限的研究相符[19-21]。以往研究报道胸部CT与心脏CT间CACS的平均差值为8.0~53.1[2, 22-23],而本研究的平均差值12.33接近该范围下限。此外ULD-CTSa与CACS-CTQr间CACS差异百分比(26.33%)也与Xia等[2]采用大螺距LDCT评估CACS的研究(29%)相近。
非心电门控胸部CT中CAC的严重程度对未来心血管不良事件和全因死亡率具有重要的预测价值[24-25]。本研究中ULD-CT与CACS-CT在风险分类方面具有高度的一致性,这与以往胸部和心脏CT风险分类一致性的对比研究相似[2-3, 16]。同时还发现钙感知算法重建的ULD-CTSa比ULD-CTQr有更高的风险分类一致性(0.936 vs. 0.907)及更低的重新分类率(6.08% vs. 8.7%),并且ULD-CTSa 的重新分类率(6.08%)与最近基于第三代双源和256排CT系统进行LDCT采集的结果(5%~7%)相当,但ED远低于上述研究(0.18 vs. 1.0~1.3 mSv)[2, 13]。这些结果提示ULD-CT联合钙感知算法可以在超低的辐射剂量下得到较高的风险分类准确性。
值得注意的是,本研究ULD-CT未使用迭代重建改善图像噪声,因为迭代重建可能会导致较低的CACS从而低估风险等级[26]。但根据先前低剂量CACS扫描的研究,图像噪声18~30 HU为可接受的噪声水平,且噪声的增加并不会导致风险重新分类的明显增加,而本研究中ULD-CTSa图像噪声为27 HU。因此,可以预期风险重新分类的变化与先前的研究相近,ULD-CT联合钙感知算法后较低的重新分类结果也佐证了预期[10, 27]。
本研究尚有一定的局限性。首先,这是一个样本相对较少的单中心研究,结果尚需更大的队列来验证。其次,使用的大螺距扫描限制了扫描野,结果不适用于胸部横径>35 cm的患者。最后,本研究的结果并不适用于其他CT系统。
总之,非心电门控ULD-CT联合钙感知算法比标准重建算法能更有效检测CAC,更准确量化CACS和风险分类,因此采用ULD-CT联合钙感知算法评估CACS是可行的。
利益冲突 全体作者无利益冲突,进行该研究未接受任何不正当职务及财务利益,并对本研究的独立性和科学性予以保证
作者贡献声明 肖华伟负责病例收集、数据分析、论文撰写;王相权负责病例收集和数据处理;杨盼峰负责数据处理;王铃负责病例收集和数据处理;徐健负责研究方案设计和论文修改。
| [1] |
Aberle DR, Adams AM, Berg CD, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening[J]. N Engl J Med, 2011, 365(5): 395-409. DOI:10.1056/NEJMoa1102873 |
| [2] |
Xia C, Vonder M, Pelgrim GJ, et al. High-pitch dual-source CT for coronary artery calcium scoring: A head-to-head comparison of non-triggered chest versus triggered cardiac acquisition[J]. J Cardiovasc Comput Tomogr, 2021, 15(1): 65-72. DOI:10.1016/j.jcct.2020.04.013 |
| [3] |
Kim JY, Suh YJ, Han K, et al. Reliability of coronary artery calcium severity assessment on non-electrocardiogram-gated CT: a meta-analysis[J]. Korean J Radiol, 2021, 22(7): 1034-1043. DOI:10.3348/kjr.2020.1047 |
| [4] |
Hecht HS, Cronin P, Blaha MJ, et al. 2016 SCCT/STR guidelines for coronary artery calcium scoring of noncontrast noncardiac chest CT scans: A report of the Society of Cardiovascular Computed Tomography and Society of Thoracic Radiology[J]. J Cardiovasc Comput Tomogr, 2017, 11(1): 74-84. DOI:10.1016/j.jcct.2016.11.003 |
| [5] |
Williams MC, Abbas A, Tirr E, et al. Reporting incidental coronary, aortic valve and cardiac calcification on non-gated thoracic computed tomography, a consensus statement from the BSCI/BSCCT and BSTI[J]. Br J Radiol, 2021, 94(1117): 20200894. DOI:10.1259/bjr.20200894 |
| [6] |
Tækker M, Kristjánsdóttir B, Graumann O, et al. Diagnostic accuracy of low-dose and ultra-low-dose CT in detection of chest pathology: a systematic review[J]. Clin Imaging, 2021, 74: 139-148. DOI:10.1016/j.clinimag.2020.12.041 |
| [7] |
Gheysens G, De Wever W, Cockmartin L, et al. Detection of pulmonary nodules with scoutless fixed-dose ultra-low-dose CT: a prospective study[J]. Eur Radiol, 2022, 32(7): 4437-4445. DOI:10.1007/s00330-022-08584-y |
| [8] |
Vonder M, Pelgrim GJ, Huijsse SE, et al. Feasibility of spectral shaping for detection and quantification of coronary calcifications in ultra-low dose CT[J]. Eur Radiol, 2017, 27(5): 2047-2054. DOI:10.1007/s00330-016-4507-z |
| [9] |
van der Werf NR, Booij R, Schmidt B, et al. Evaluating a calcium-aware kernel for CT CAC scoring with varying surrounding materials and heart rates: a dynamic phantom study[J]. Eur Radiol, 2021, 31(12): 9211-9220. DOI:10.1007/s00330-021-08076-5 |
| [10] |
Vingiani V, Abadia AF, Schoepf UJ, et al. Low-kV coronary artery calcium scoring with tin filtration using a kV-independent reconstruction algorithm[J]. J Cardiovasc Comput Tomogr, 2020, 14(3): 246-250. DOI:10.1016/j.jcct.2019.11.006 |
| [11] |
Agatston AS, Janowitz WR, Hildner FJ, et al. Quantification of coronary artery calcium using ultrafast computed tomography[J]. J Am Coll Cardiol, 1990, 15(4): 827-832. DOI:10.1016/0735-1097(90)90282-t |
| [12] |
van Velzen S, Lessmann N, Velthuis BK, et al. Deep learning for automatic calcium scoring in CT: validation using multiple cardiac CT and chest CT protocols[J]. Radiology, 2020, 295(1): 66-79. DOI:10.1148/radiol.2020191621 |
| [13] |
Chen Y, Hu Z, Li M, et al. Comparison of nongated chest CT and dedicated calcium scoring CT for coronary calcium quantification using a 256-dector row CT scanner[J]. Acad Radiol, 2019, 26(10): e267-e274. DOI:10.1016/j.acra.2018.12.005 |
| [14] |
Azour L, Kadoch MA, Ward TJ, et al. Estimation of cardiovascular risk on routine chest CT: Ordinal coronary artery calcium scoring as an accurate predictor of Agatston score ranges[J]. J Cardiovasc Comput Tomogr, 2017, 11(1): 8-15. DOI:10.1016/j.jcct.2016.10.001 |
| [15] |
Chandra D, Gupta A, Leader JK, et al. Assessment of coronary artery calcium by chest CT compared with EKG-gated cardiac CT in the multicenter AIDS cohort study[J]. PLoS One, 2017, 12(4): e0176557. DOI:10.1371/journal.pone.0176557 |
| [16] |
Hutt A, Duhamel A, Deken V, et al. Coronary calcium screening with dual-source CT: reliability of ungated, high-pitch chest CT in comparison with dedicated calcium-scoring CT[J]. Eur Radiol, 2016, 26(6): 1521-1528. DOI:10.1007/s00330-015-3978-7 |
| [17] |
Tao S, Sheedy E, Bruesewitz M, et al. Technical note: kV-independent coronary calcium scoring: A phantom evaluation of score accuracy and potential radiation dose reduction[J]. Med Phys, 2021, 48(3): 1307-1314. DOI:10.1002/mp.14663 |
| [18] |
Jubran A, Mastrodicasa D, van Praagh GD, et al. Low-dose coronary calcium scoring CT using a dedicated reconstruction filter for kV-independent calcium measurements[J]. Eur Radiol, 2022, 32(6): 4225-4233. DOI:10.1007/s00330-021-08451-2 |
| [19] |
Sabour S, Rutten A, van der Schouw YT, et al. Inter-scan reproducibility of coronary calcium measurement using Multi Detector-Row Computed Tomography (MDCT)[J]. Eur J Epidemiol, 2007, 22(4): 235-243. DOI:10.1007/s10654-007-9123-4 |
| [20] |
Budoff MJ, McClelland RL, Chung H, et al. Reproducibility of coronary artery calcified plaque with cardiac 64-MDCT: the multi-ethnic study of atherosclerosis[J]. AJR Am J Roentgenol, 2009, 192(3): 613-617. DOI:10.2214/AJR.08.1242 |
| [21] |
Ann SH, Kim JH, Ha ND, et al. Reproducibility of coronary artery calcium measurements using 0.8-mm-thickness 256-slice coronary CT[J]. Jpn J Radiol, 2014, 32(12): 677-684. DOI:10.1007/s11604-014-0364-3 |
| [22] |
Arcadi T, Maffei E, Sverzellati N, et al. Coronary artery calcium score on low-dose computed tomography for lung cancer screening[J]. World J Radiol, 2014, 6(6): 381-387. DOI:10.4329/wjr.v6.i6.381 |
| [23] |
Choi AD, Leifer ES, Yu J, et al. Prospective evaluation of the influence of iterative reconstruction on the reproducibility of coronary calcium quantification in reduced radiation dose 320 detector row CT[J]. J Cardiovasc Comput Tomogr, 2016, 10(5): 359-363. DOI:10.1016/j.jcct.2016.07.016 |
| [24] |
Ruparel M, Quaife SL, Dickson JL, et al. Evaluation of cardiovascular risk in a lung cancer screening cohort[J]. Thorax, 2019, 74(12): 1140-1146. DOI:10.1136/thoraxjnl-2018-212812 |
| [25] |
Fan L, Fan K. Lung cancer screening CT-based coronary artery calcification in predicting cardiovascular events: A systematic review and meta-analysis[J]. Medicine (Baltimore), 2018, 97(20): e10461. DOI:10.1097/MD.0000000000010461 |
| [26] |
van der Werf NR, Willemink MJ, Willems TP, et al. Influence of dose reduction and iterative reconstruction on CT calcium scores: a multi-manufacturer dynamic phantom study[J]. Int J Cardiovasc Imaging, 2017, 33(6): 899-914. DOI:10.1007/s10554-017-1061-y |
| [27] |
Vonder M, van der Werf NR, Leiner T, et al. The impact of dose reduction on the quantification of coronary artery calcifications and risk categorization: A systematic review[J]. J Cardiovasc Comput Tomogr, 2018, 12(5): 352-363. DOI:10.1016/j.jcct.2018.06.001 |
 2023, Vol. 43
2023, Vol. 43


