乳腺癌是全球女性最常见的恶性肿瘤之一,虽然乳腺癌的发病率不断增加,但由于早期筛查和综合治疗的广泛应用,死亡率并未明显增加[1]。在这些治疗手段中,放射治疗是不可或缺的一部分,调强放射治疗(intensity-modulated radiotherapy, IMRT)能够为患者带来高度适形和一致的剂量分布,同时降低周围危及器官的剂量[2]。然而,目前计划系统仍然需要物理师调节大量函数参数和勾画辅助器官,这是一项费时费力的任务。不同工作经验的物理师之间, 设计计划的质量存在差异,这可能会对患者的治疗效果产生一定影响[3-4]。目前采用卷积神经网络方法对头颈、胸部和腹部等肿瘤进行剂量预测已经取得了很好的效果[5-7]。本研究基于U-net构建训练模型[8],将该技术应用到乳腺癌保乳术后的剂量分布预测中,通过建立CT图像、感兴趣区(regions of interest, ROI)、体素与靶区距离特征和对应剂量分布之间的关系,实现对乳腺癌保乳术后放疗剂量分布的精准预测,为临床提供更多有力帮助,从而提高乳腺癌患者的治疗效果和生存质量。
资料与方法1. 病例选择:选取2018年1月至2023年3月在上海国际医学中心接受IMRT的110例左乳腺癌保乳术后患者数据。患者均采取乳腺癌托架仰卧位固定摆位。采用德国西门子公司SOMATOM Confidence大孔径CT进行定位扫描,扫描层厚为5 mm, 图像分辨率为512 × 512。扫描完成后由经验丰富的医生在Eclipse治疗计划系统工作站上勾画计划靶区(planning target volume, PTV)和危及器官(organ at risk, OAR),由经验丰富物理师设计放疗计划,所有患者均采用6 MV X射线IMRT技术。所有患者计划靶区(PTV50)处方剂量为50 Gy, 瘤床计划靶区(PTV60)处方剂量同步推量至60 Gy, 治疗总次数为25次。靶区勾画主要参考美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)乳腺癌靶区勾画共识[9]。计划由主任医师和物理师共同审核评价,确保放疗计划的准确性和可行性。
2. 数据预处理: 选取将CT图像、感兴趣区、体素与靶区距离和剂量分布四通道特征作为网络的输入数据。感兴趣区图像包括靶区和危及器官,其中靶区包括PTV50、PTV60, 危及器官包括患侧肺、左肱骨头、心脏、脊髓和健侧乳腺。CT图像、感兴趣区图像和剂量分布图像由DICOM格式数据导出,并转换为512 × 512二维矩阵文件,感兴趣区图像用数值1.0表示。其中,体素与靶区距离特征为PTV外某体素与PTV表面最近点的距离[10]。为了确保训练模型的收敛,输入网络之前均作归一化处理。
3. 网络搭建概述:整个模型是以U-net(2D)为基准框架,输入层与输出层之间为5层的U形结构。网络结构包含了左侧编码器、右侧解码器和中间跳跃连接部分,编码器用于下采样来分析整张图片并进行特征提取与分析,解码器则用于上采样逐步恢复图像分辨率。跳跃连接联系于编码器和解码器,起到补充原始图像信息作用, 在最后一层,内核大小为1 × 1的卷积层将输出通道的数量减少到标签数量。其中,编码器主要由卷积层,批量归一化(batch normalization,BN)层,激活函数层和池化层构成,而解码器则主要由卷积层,批量归一化层,激活函数层和上采样层构成。每层模块执行两次操作, 每个卷积层使用3 × 3的卷积核, 池化层使用2 × 2最大池化,上采样则使用2 × 2反卷积。通过使用Relu激活函数对卷积之后的特征添加非线性因素,在卷积层与激活函数之间加入BN层使输出特征图中每个通道数据的均值为0,方差为1。网络输入数据大小为512 × 512 × 4,其中,4代表 4个通道依次对应输入网络的切片;U-net网络输出层数据大小为512 × 512 × 1,代表解剖结构分布层对应的剂量分布。
4. 模型训练: 本研究选用Python作为编程语言, 使用Pytorch作为深度学习网络框架, 操作系统为Ubuntu。从110个病例中随机固定抽取80例作为训练集,随机固定10例作为验证集,剩余的20例作为测试集数据。其中,训练数据包括CT图像、感兴趣区图像、体素与靶区距离特征和剂量分布图像,具体如图 1所示。损失函数为均方误差(MSE),使用Adam算法对损失函数进行优化,批处理参数为8, 学习率为3 × 10-4,同时在训练过程中使用平移、翻转和旋转技术进行数据增强。模型训练好后,输入测试集数据特征,生成三维剂量分布作为输出数据, 并对模型的性能进行评估。
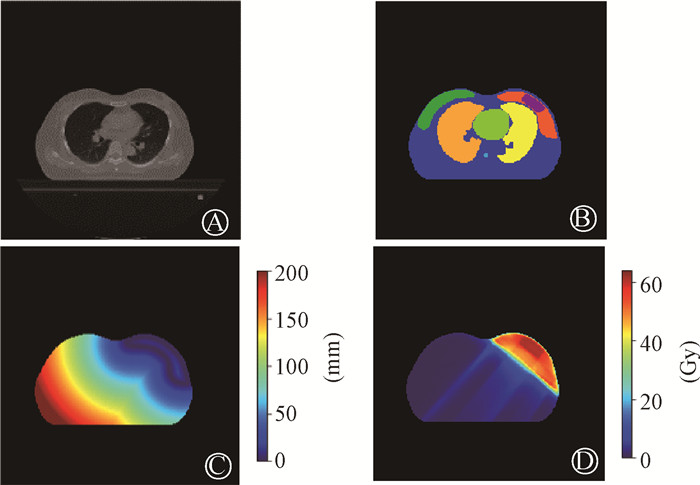
|
图 1 四通道特征数据 A. CT图像; B.感兴趣区; C.体素与靶区距离; D.剂量分布 Figure 1 Four-channel feature data A.CT image; B.Region of interest; C.Distance between voxel and PTV; D.Dose distribution |
5. 评估方式:使用剂量评分和剂量体积直方图(dose volume histogram, DVH)评分对两种剂量预测方法进行评估[11],同时评估靶区和危及器官剂量学指标。两个评分数值越小越好,代表模型预测与实际手动计划更加接近。剂量评分为预测剂量与手动计划剂量之间绝对差值。
剂量评分Ah计算公式如下:
| $ A_h=\frac{1}{\left|o^h\right|} \sum\limits_{p \varepsilon o^h} \frac{\left|s_p-\hat{s}_p\right|}{v^p} $ | (1) |
式中,oh为结构体素总数量;sp为第p个体素预测剂量;
DVH评分Bh是指预测与手动计划DVH指标之间剂量差异。计算公式如下:
| $ \begin{aligned} & B_h=\frac{1}{\sum\limits_{p \in o^h} \sum\limits_{r \in L_p \cup T_p}\left|c_r\right|} . \\ & \sum\limits_{p \in o^h} \sum\limits_{r \in L_p \cup T_p} \sum\limits_{C \in C_r} \mid D_c^r\left(s_p\right)-D_c^r\left(\hat{s}_p\right) \\ & \end{aligned} $ | (2) |
式中,Lp为危及器官;Tp为靶区。其中,危及器官DVH评价指标为Dmeani和D0.1 cm3i,靶区为D1t、D95t和D99t。
6. 统计学处理:采用SPSS 19.0软件对数据进行统计处理。数据满足正态分布,结果采用x±s表示。对剂量评分、DVH评分、PTV和OAR数据结果进行配对样本t检验。P<0.05为差异有统计学意义。
结果1. 预测方法评分对比: 其中剂量评分和DVH评分越低越好。采用U-net结合体素与靶区距离特征的剂量评分和DVH评分分别为2.10±0.18和2.28±0.08,与未加入此特征(评分分别为2.17±0.17和2.35±0.09)相比,降低了约3%(t=2.52、2.40,P<0.05),展现更好的精确性,与手动计划剂量分布和DVH曲线更加相近。图 2为测试集中1例的手动计划和两种预测方法的剂量对比,两种预测方法预测的剂量都与手动计划相近,说明深度学习剂量预测具有很高的精准性。
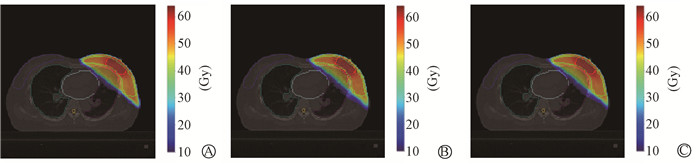
|
注: D-img表示体素与靶区距离特征 图 2 手动计划与预测剂量对比 A.手动计划; B.未包含D-img剂量预测; C.包含D-img剂量预测 Figure 2 Comparison between manually planning and predicted dose A. Manual planning; B. Dose prediction without D-img; C. Dose prediction with D-img |
2. 剂量学数据对比: 表 1为手动计划和剂量预测的靶区和危及器官数据对比,其中剂量预测方法为U-net结合体素与靶区距离特征。对比发现,PTV60、PTV50、脊髓、患侧肺、左肱骨头和心脏剂量偏差在4%以内,虽然健侧乳腺平均剂量增加了13 cGy,但均处于临床可接受范围内。其中,PTV60的D2、D98和Dmean预测值略低于实际值(t=3.74、2.91和2.99,P<0.05),这可能是由于靠近皮肤边界效应所致[12]。患侧肺V5和Dmean预测值低于实际值(t=3.47、2.29,P<0.05),说明实际值还有下降空间,其余评价指标差异无统计学意义(P>0.05)。图 3为测试集中1例DVH图对比,包含D-img的剂量预测的DVH曲线与手动计划相似,趋势一致。
|
|
表 1 20例测试集病例手动计划与预测的剂量学比较(x±s) Table 1 Dosimetric comparison between manual planning and prediction of 20 cases in test set(x±s) |
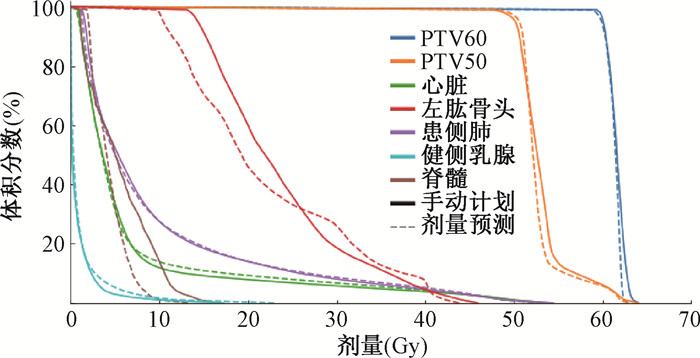
|
注: DVH为剂量体积直方图 图 3 测试集中1例的手动计划与预测的DVH图对比 Figure 3 Comparison between manual planning and predicted DVH of one case in the test set |
讨论
近年来,随着深度学习的发展,剂量预测的精度已经提高到了像素级别。Song等[4]使用DeepLav3+网络对直肠癌VMAT计划进行剂量预测,选取CT图像,靶区和危及器官图像以及剂量分布特征作为输入建立模型,预测结果均符合临床需求,其中均方差为0.001,归一化剂量差是0.4%,同时剂量预测结果有助于物理设计计划,初级物理师完成计划时间平均节省约15 min。Fan等[5]使用残差网络对头颈部患者计划进行剂量预测,提出一种新的自动计划方案,将剂量预测结果导入到开源软件matRad中作为体素目标函数进行优化,并生成自动计划。这种方案优势是不需要手动输入目标优化参数并减少辅助结构勾画,省时省力,生成的自动计划是临床上可以接受的。
已有研究表明,加入体素与靶区距离特征对提高剂量预测精确性具有有效性,Zhang等[10]利用密集连接扩张网络预测食管癌的剂量,与未加入此特征相比,其中PTV、左肺、右肺和心脏剂量平均绝对误差分别减少了0.1%、0.2%、0.1%和0.8%。本研究采用端到端U-net网络,组成CT图像、感兴趣区、体素与靶区距离特征和对应剂量分布四通道特征输入数据建模,增加了靶区外像素位置信息,进一步优化模型,提高了预测的准确性。
预先对乳腺癌剂量预测已经有比较好的研究,白雪等[13]使用全卷积网络(FCN)直接输入ROI图像进行剂量预测, 患者PTV、患侧肺、心脏和脊髓的剂量平均绝对离差均临床符合要求,但缺乏输入CT图像(相对电子密度信息)和体素与PTV距离信息,剂量预测结果还有很大的改进空间。范嘉伟等[12]同样采用U-net网络,将相邻7层图像特征输入到网络进行训练以增加相邻层对剂量影响,取得不错的结果。由于训练模型的训练集和验证结果的测试集都不相同,所以本研究结果很难与前面的研究比较优劣,但本研究使用4通道输入特征进一步提供OAR与PTV空间信息,加强了模型性能,提高了预测精度。
本研究仍有很大的局限性,由于不同机构的数据来源差异以及模型算法固有局限性,不同的医疗机构在应用过程中,需要重新采集数据和建立模型。
综上所述,本研究采用U-net结合体素与靶区距离特征可以精准预测乳腺癌保乳术后调强放疗剂量分布预测,均符合临床需求。物理师可以在做新计划前首先进行剂量预测,对剂量分布有预先了解,对优化计划有指导意义。精确的剂量预测分布也为自动计划设计提供更优的目标函数,为物理师设计优秀的计划提供优质和一致性的保障,进一步提高乳腺癌治疗精度和临床应用产生积极的效果。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 李红伟负责研究的设计、实现及论文撰写;韩鸣、史以龙负责数据的收集和处理;姚晖、孟歌负责技术指导和论文修改
| [1] |
王若峥, 尹勇. 肿瘤精确放射治疗计划设计学[M]. 北京: 科学出版社, 2014: 178-207. Wang RZ, Yin Y. Design of accurate radiotherapy plan for tumor[M]. Beijing: Science press, 2014: 178-207. |
| [2] |
陈刚, 张顺康, 沈磊, 等. 三种全乳同步瘤床加量调强放疗计划的比较[J]. 中国癌症杂志, 2020, 30(8): 611-619. Chen G, Zhang SK, Shen L, et al. Comparison of three types of intensity-modulated radiotherapy plans for adjuvant whole breast and simultaneous tumor bed boost radiotherapy[J]. Chin Oncol, 2020, 30(8): 611-619. DOI:10.19401/j.cnki.1007-3639.2020.08.008 |
| [3] |
王文成, 周解平, 张朋, 等. 基于深度学习方法的食管癌术后调强放疗三维剂量分布预测[J]. 中国医学物理学杂志, 2022, 39(2): 133-138. Wang WC, Zhou JP, Zhang P, et al. Deep learning-based prediction of three-dimensional dose distribution inpostoperative intensity-modulated radiotherapy for esophageal cancer[J]. Chin J Med Phys, 2022, 39(2): 133-138. DOI:10.3969/j.issn.1005-202X.2022.02.001 |
| [4] |
Song Y, Hu JJ, Liu Y, et al. Dose prediction using a deep neural network for accelerated planning of rectalcancer radiotherapy[J]. Radiother Oncol, 2020, 149: 111-116. DOI:10.1016/j.radonc.2020.05.005 |
| [5] |
Fan JW, Wang JZ, Chen Z, et al. Automatic treatment planning based on three dimensional dose distribution predicted from deep learning technique[J]. Med Phys, 2019, 46(1): 370-381. DOI:10.1002/mp.13271 |
| [6] |
Barragán-Montero AM, Nguyen D, Lu WG, et al. Three dimensional dose prediction for lung IMRT patients with deep neural networks: robust learning from heterogeneous beam configurations[J]. Med Phys, 2019, 46(8): 3679-3691. DOI:10.1002/mp.13597 |
| [7] |
Lempart M, Benedek H, Jamtheim Gustafsson C, et al. Volumetric modulated arc therapy dose prediction and deliverable treatment plan generation for prostate cancer patients using a densely connected deep learning model[J]. Phys Imaging Radiat Oncol, 2021, 19: 112-119. DOI:10.1016/j.phro.2021.07.008 |
| [8] |
Ronneberger O, Fischer P, Brox T. U-net: convolutional networks for biomedical image segmentation [C]//International Conference on Medical Image Computing and Computer-assisted Intervention[J]. Cham: Springer, 2015: 234-241. DOI: 10.1007/978-3-319-24574-4_28.
|
| [9] |
Julia W, An T, Douglas A, et al. Breast cancer atlas for radiation therapy planning: consensus definitions [EB/OL]. https://www.rtog.org/LinkClick.aspx?fileticket=SQhssxHu7Jg%3d#38;tabid=227, 2019-05-01.
|
| [10] |
Zhang J, Liu S, Yan H, et al. Predicting voxel-level dose distributions for esophageal radiotherapy using densely connected network with dilated convolutions[J]. Phys Med Biol, 2020, 65(20): 205013. DOI:10.1088/1361-6560/aba87b |
| [11] |
Babier A, Zhang B, Mahmood R, et al. OpenKBP: the open-access knowledge-based planning grand challenge and dataset[J]. Med Phys, 2021, 48(9): 5549-5561. DOI:10.1002/mp.14845 |
| [12] |
范嘉伟, 陈帜, 王佳舟, 等. 基于深度学习方法的乳腺癌调强放疗自动计划研究[J]. 中华放射肿瘤学杂志, 2020, 29(8): 671-675. Fan JW, Chen Z, Wang JZ, et al. Study of automatic treatment planning of intensity-modulated radiotherapy based on deep learning technique for breast cancer patients[J]. Chin J Radiat Oncol, 2020, 29(8): 671-675. DOI:10.3760/cma.j.cn113030-20190320-00103 |
| [13] |
白雪, 王升晔, 王彬冰, 等. 全卷积网络放疗三维剂量分布预测研究[J]. 中华放射肿瘤学杂志, 2020, 29(8): 666-670. Bai X, Wang SY, Wang BB, et al. Study of three-dimensional dose distribution prediction model in radiotherapy planning based on full convolution network[J]. Chin J Radiat Oncol, 2020, 29(8): 666-670. DOI:10.3760/cma.j.cn113030-20191018-00427 |
 2023, Vol. 43
2023, Vol. 43


