食管癌为我国较为常见的恶性肿瘤之一,其侵袭性较强,临床就诊时多数患者存在局部区域或/和远处转移,而且大多数以根治为目的的患者最终也发展为局部区域复发或/和远处转移[1]。对于局部晚期或转移性食管癌患者,近年来治疗手段取得了长足的进步[2],但患者的生存情况仍不能令人满意。免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗已逐渐成为包括食管癌在内的各种恶性肿瘤的重要治疗手段之一。目前为止,ICIs治疗食管癌的经验主要局限于晚期患者[3-6]。依据近年来ICIs治疗食管癌患者的数据显示,ICIs不但对于食管癌二线治疗具有更优越的抗肿瘤活性和可控的安全性[7];ICIs也推进了晚期食管癌患者一线免疫治疗的探索,并显示了显著的疗效[3-6]。基于目前现有的Ⅲ期随机临床试验的结果,ICIs联合化疗而不是单独化疗已被推荐作为晚期食管癌的一线治疗方法。在局部晚期或转移性食管鳞癌(locally advanced or metastatic esophageal squamous cancer,LA/M ESCC)患者中,ICIs和放化疗(chemoradiotherapy,CRT)的联合治疗已成为一种新的策略,可能具有协同作用和更好的疗效,但目前研究报道并不多见[8-10]。因此,本研究回顾性分析了ICIs联合CRT在LA/M ESCC患者中的临床应用,并讨论了CRT与ICIs联合治疗方式、治疗后失败模式和治疗相关不良反应等情况,以期为食管癌综合治疗提供参考。
资料与方法1. 入排标准:收集2018年3月至2021年5月在河北医科大学第四医院放疗科接受CRT联合ICIs治疗的ESCC患者,并进行筛选。入组标准:年龄≥18岁;病理组织学明确诊断为ESCC;东部肿瘤协作组体力状况评分(Eastern Cooperative Oncology Group performance status,ECOG PS)≤2;首次治疗;治疗方式为CRT同期或序贯应用ICIs,且ICIs周期数≥3个;依据美国癌症联合委员会(American Joint Committeeon Cancer,AJCC)2017年食管癌TNM分期标准,纳入Ⅲ~Ⅳ期患者;治疗前无合并感染或其他严重全身性疾病的患者;脏器转移瘤数量为1~3个。排除标准:除治愈的皮肤基底细胞癌、皮肤鳞状癌或其他原位癌外,合并其他恶性肿瘤;治疗前存在异常骨髓增生和其他造血系统疾病;需要治疗的活动性感染、艾滋病毒感染、治疗前病毒性肝炎;其他严重全身性疾病患者需要药物干预。
转移性疾病被定义为非区域的淋巴结转移和任何远处的脏器转移,本研究主要纳入寡转移患者,最终纳入符合条件的患者57例。回顾性收集并分析的临床资料,包括患者的基线临床特征、疾病进展及死亡时间、近期疗效,以及治疗相关的不良事件(treatment-related adverse events,trAEs)等。在接受治疗前均取得了患者及其家属的知情同意,并经过河北医科大学第四医院伦理委员会批准。
2. 治疗方案
(1) 放射治疗:均采用同步加量调强放射治疗(simultaneous modulated accelerated radiotherapy, SMART)技术,累及野照射;照射部位均为食管癌病变局部及转移淋巴结照射;剂量为50.4~60.0 Gy/28~30次,常规分割;要求双肺V5<60%,V20<28%,V30<18%;心脏V30<40%,V40<30%;脊髓最大剂量<45 Gy。
(2) 化疗:化疗同步放疗进行,化疗药物采用以铂类为基础的联合方案,其中联合白蛋白紫杉醇39例(68.4%),另18例(31.6%)联合紫杉醇;化疗周期数2~6个,中位4个。
(3) 免疫治疗:38例(66.7%)患者使用卡瑞丽珠单抗(camrelizumab),200 mg/次,3次/周;13例(22.8%)使用特瑞普利单抗(toripalimab),240 mg/次,3次/周;6例(10.5%)使用帕博利珠单抗(pembrolizumab),240 mg/次,3次/周。其中,免疫治疗同步放化疗的25例(43.9%),放化疗后序贯免疫治疗23例(40.4%),免疫治疗后序贯放化疗9例(15.8%)。免疫周期为3~9个,中位6个周期,≤5个周期25例(43.9%)。
3. 治疗相关不良反应评价与疗效评价标准:免疫相关反应标准(immune-related response criteria,irRC)用于确定免疫治疗启动后的反应和进展;治疗期间及治疗后的相关不良反应评价根据美国国家癌症研究所不良事件通用术语标准(National Cancer Institute Common Terminology Criteria for Adverse Events,NCI-CTCAE)5.0版进行分级(本研究只对≥2级的不良反应进行分析);实体瘤免疫相关疗效评价标准(immune-related response evaluation criteria in solid tumors,irRECIST)为免疫治疗的疗效评价标准;为了避免免疫治疗假性进展的影响,选择治疗3个月后进行疗效评价;疗效分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、稳定(stable disease, SD)和疾病进展(progressive disease, PD)。治疗后总有效率(overall response rate, ORR)=(CR+PR)/总人数×100%;疾病控制率(disease control rate,DCR) = (CR+PR+SD)/总人数× 100%。
4.随访:入组患者均规律进行了复查和随访,复查内容主要为血液检查、胸部和腹部CT扫描、食管钡剂检查和浅表淋巴结超声等。免疫治疗期间每2~3周期进行一次,免疫治疗结束后每隔1~3个月复查一次。最后随访日期截至2022年12月31日。
5.统计学处理:应用SPSS 25.0软件进行统计学分析,采用χ2或Fisher精确检验分析分类变量的差异,连续变量的差异采用Mann-Whitney U检验。生存分析采用Kaplan-Meier法和Log-rank检验,中位随访采用Kaplan-Meier方法计算。采用Cox比例风险回归模型进行单因素和多因素分析。对单因素分析中P < 0.05的变量进行多变量分析。P < 0.05为差异有统计学意义。本研究的主要终点是总生存(OS)和无进展生存(PFS)。OS被定义为从治疗开始到死亡日期或最后一次随访的时间。PFS被定义为从治疗开始到首次记录的疾病进展、死亡或最后一次接触(以先发生者为准)的时间。
结果1. 临床资料:57例符合纳入标准的ESCC患者,男46例(80.7%)、女11例(19.3%),平均年龄(64.4±9.4)岁,中位64岁。中位随访时间为30.3个月(95%CI:27.14~33.46)。患者的一般临床资料见表 1。转移脏器均为肺脏和肝脏,其中肺转移6例,肝转移1例;远隔部位淋巴结转移为21例,其中7例为颈部淋巴结转移,8例为腹腔淋巴结转移,另有6例为颈部合并腹腔淋巴结转移。
|
|
表 1 患者的一般临床资料 Table 1 General clinical data of patients |
2. 治疗反应:全组患者治疗后,2例患者疗效评价为CR,44例PR,8例SD,3例PD;ORR为80.7%(46/57),DCR为94.7%(54/57)。
3. 疗效及影响因素分析:全组患者1、2、3年OS率和PFS率分别为86.0%、57.5%、53.9%和61.4%、31.0%、31.0%;中位OS值未达到,中位PFS为15.0个月(95%CI:10.77~19.23)。对可能影响患者预后的一般临床指标和治疗指标进行单因素分析,并随后对单因素中差异有统计学意义的指标进行多因素分析。单因素分析显示,患者年龄、ECOG、组织分化程度、临床分期、免疫治疗周期数和近期疗效为影响其OS的显著性因素(χ2=5.75、5.74、5.73、10.74、5.40、9.05,P < 0.05);患者ECOG、临床分期和近期疗效为影响其PFS的显著性因素(χ2=6.39、10.34、5.05,P < 0.05)。多因素分析显示,患者年龄、临床分期、免疫治疗周期数和近期疗效为影响患者OS的独立性预后因素(HR=0.25、2.58、0.35、4.05,P < 0.05),而临床分期和近期疗效为影响患者PFS的独立性因素(HR= 2.27、1.97,P < 0.05),见表 2,3。
|
|
表 2 影响患者OS的单因素和多因素分析结果 Table 2 Results of univariate and multivariate analyses of patient OS |
|
|
表 3 影响患者PFS的单因素和多因素分析结果 Table 3 Results of univariate and multivariate analyses of patient PFS |
4. 亚组分层分析结果:本组患者中,CRT同期ICIs、ICIs后序贯CRT和CRT后序贯ICIs的患者分别为25、9和23例,3组间或两组间比较,患者OS和PFS差异均无统计学意义(P>0.05),见表 4。
|
|
表 4 免疫治疗与放化疗的使用顺序亚组分析结果 Table 4 Analytical results of the sequences of immunotherapy and chemoradiotherapy |
全组患者中有15例患者接受包括食管在内的其他部分转移病灶的放疗,其余42例患者照射范围包含全部肿瘤病灶,结果显示两组患者的OS率和PFS率差异均无统计学意义(P>0.05,表 5)。
|
|
表 5 不同照射范围患者预后分析结果 Table 5 Prognostic analytical results of patients with different irradiation ranges |
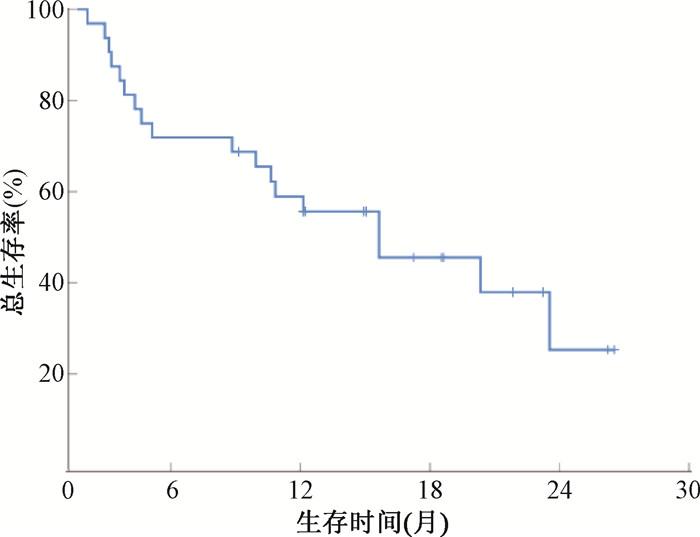
5. 患者治疗后失败模式及二次治疗后生存分析:治疗结束后至随访结束日期,共有32例患者出现病情进展,其中出现新病灶患者17例,原发病灶进展7例,两者兼有8例。其中29例患者均接受了二线治疗(化疗联合免疫治疗11例、单纯免疫治疗5例、放化疗联合免疫治疗5例、单纯放疗5例、单纯化疗1例、化疗联合免疫及靶向药物治疗2例),仅3例患者为对症支持治疗。患者进展后二次治疗后1、2年OS率分别为55.7%和25.3%,中位OS为14.0个月(95%CI:5.17~22.83),生存曲线见图 1。
|
图 1 32例治疗后肿瘤进展患者二次治疗后生存曲线 Figure 1 Survival curve after secondary treatment for 32 patients with tumor progression |
6. ≥2级CTCAE分析结果:全组患者在治疗期间及治疗结束后出现≥2级CTCAE共26例(同时出现多种不良反应的患者以其中最严重的不良反应计算其级别)。最常见的合并不良反应为骨髓抑制,共12例,其中有1例为免疫性血小板减少;另外出现了7例心脏功能异常,最常见为中度瓣膜返流和心房扑动,1例为3级免疫性心肌炎;食管炎4例,肺炎3例;有4例患者出现食管瘘,2例为CRT同期使用ICIs,另2例为CRT后序贯使用ICIs。
讨论CRT是目前LA/M ESCC患者的常用治疗方法,联合免疫治疗是否能提高治疗效果尚不清楚。理论上,化疗联合ICIs具有协同作用[11-12]。临床上越来越多的证据表明,放疗和免疫联合治疗可以增强各自疗效[13],放射治疗与免疫治疗相结合,可促进肿瘤特异性抗原的释放,增强获得性免疫应答,杀死肿瘤细胞;放射治疗通过激活抗原提呈的树突状细胞产生系统的抗肿瘤免疫反应,该细胞与免疫治疗的持续免疫激活协同作用,诱导T细胞归巢[14]。
Zhang等[15]对20例接受了CRT联合卡瑞利珠单抗的临床结果进行了报道,最终19例进行了分析,结果显示,患者1、2年的OS率和PFS率分别为85.0%、69.6%和80.0%、65.0%;中位OS和PFS时间分别为16.7个月(95% CI:5.9~27.9)和11.7个月(95% CI:0~30.3)。Park等[16]报道的另一项Ⅱ期临床试验,研究者应用CRT联合度伐利尤单抗和替西木单抗对40例患者进行治疗,结果显示患者2年的OS和PFS率分别为75%和57.5%,且细胞程序性死亡-配体1(PD-L1)表达高的患者受益更加明显。Wu等[17]对接受RT或CRT联合ICIs的患者进行了一项荟萃分析,共有668例患者,结果显示患者1、2年OS率分别为84.5%(95%CI:69.9%~100%)和68.3%(95% CI:49.0%~95.1%)。本研究结果显示,患者具有较好的治疗反应:ORR为80.7%,DCR为94.7%;患者2、3年OS率和PFS率分别为57.5%、53.9%和31.0%、31.0%;中位PFS为15.0个月(95%CI:10.77~19.23);由于随访时间问题中位OS值未达到。这些数据略低于现有的临床实验数据,但考虑到本研究中纳入了45.6%的Ⅳ期患者,也是可以接受的。Wu等[8]回顾性分析了127例转移性或复发性ESCC患者的数据,40例患者接受了RT联合ICIs,RT组(40例)和未接收放射治疗(NRT)组(87例)的中位OS和PFS分别为11.9、10.3个月(P = 0.890)和5.45、4.60个月(P=0.660),且局部复发患者通过免疫治疗联合放疗获得更好的OS(P=0.026)。Wang等[18]评估了50例应用信迪利单抗联合化疗的晚期食管癌患者,其中38例患者存在脏器或和区域淋巴结转移,24例接受了放疗,结果显示全组患者的1年OS率和PFS率分别为67.1%和49.2%,中位PFS为11.3个月(95% CI:5.0~17.6个月);ORR和DCR分别为60%(30/50)和92%(46/50);联合RT组患者的1年OS率高于NRT患者(85.9% vs. 53.2%,P = 0.020)。以上研究结果表明,与传统CRT治疗ESCC相比,免疫治疗和CRT联合治疗可以提高生存率。
CRT与ICIs联合治疗模式目前尚无定论,临床上多数针对于ICIs联合CRT治疗食管癌的Ⅲ期研究的设计均为同期使用[19-20],而TENERGY研究设计则是先CRT后序贯应用阿替利珠单抗进行巩固性免疫治疗[21]。本研究结果显示,虽然CRT同期ICIs组和CRT后序贯ICIs组相比,后组患者OS似乎更优,但总体ICIs与CRT的使用顺序对患者预后无明显影响,可能由于本研究的例数较少且为回顾性有关。CRT与ICIs联合治疗的最佳联合模式需要更多的临床试验来验证,虽然放化疗技术、药物、剂量和治疗时间的优化尚不清楚,但通过不断收集和分析临床试验(NCT 03278626、NCT 02520453、NCT 03377400、NCT032786626和NCT 02844075)的数据,可以验证放化疗和免疫治疗联合治疗的疗效。
一种新的联合方案比单独治疗的不良反应的发生率和级别可能会更高一些[22-23],另外一种新的治疗模式可能与传统治疗方案有不一样的治疗失败模式,既往单纯和根治性手术切除和根治性放化疗食管癌患者主要以局部区域复发为主要失败模式[24-25],而新辅助放化疗后手术患者的主要失败模式为远处转移[26-27],在放化疗的基础上加上ICIs后失败模式如何,目前可参考的数据不多。本研究显示患者治疗后有32例患者出现治疗后失败,治疗后进展患者多数再次接受了治疗,患者的二次治疗后1、2年OS率分别为55.7%和25.3%,中位14.0个月。本研究中最常见的不良反应为骨髓抑制(12例,46.1%),次之为心脏功能异常(7例,26.9%);最严重的的为食管瘘(4例,15.3%)。Zhang等[15]研究显示,治疗结束后6例(30%)患者发生肿瘤复发,包括1例(5%)局部失败,3例(15%)远处转移,2例(10%)两者兼有;有11例(55%)患者发生了与免疫相关的急性期不良事件,5例患者出现晚期不良事件,其中2级食管狭窄1例。并且最终有2例患者出现食管瘘(10.5%)。在Park等[16]的研究中,有13例患者(32.5%)出现疾病进展,其中局部区域失败7例,远处转移5例,两者兼有1例;最常见的免疫介导的≥2级不良事件为甲状腺功能减低(7例),其次为皮疹和淀粉酶增高(均为4例),仅出现1例4级的脂肪酶升高。依据本研究和既往研究显示,CRT联合ICIs治疗患者的不良反应不尽相同,这与每项研究入组患者人数、使用免疫药物及其联合治疗模式均有关系。因此,对于ICIs治疗带来的不良反应,尤其是后期不良反应值得临床进一步观察和深入研究。
尽管目前ICIs联合CRT一线治疗ESCC的研究多数仍处于临床试验阶段,但初步结果仍显示出了较好的疗效,且不良反应可控;从肿瘤精准治疗方面考虑,利用ICIs与CRT之间的协同作用来进行个体化治疗ESCC患者可能是未来的主要方向。然而,ICIs治疗ESCC的机制有待进一步研究,尤其是后期疗效和不良反应有待进一步验证。
本研究的局限性:本研究为单中心回顾性研究,研究结果需要更多的前瞻性多中心研究来验证;回顾性设计存在其固有的选择性偏倚;由于在大多数患没有进行PD-L1表达的检测,因此,本研究中没有分析PD-L1表达水平对患者生存的影响;另外,本研究中免疫药物不统一。
综上所述,放化疗联合免疫治疗对局部晚期或转移性食管鳞癌患者是有效且安全的;其治疗后失败模式仍是局部区域复发和远处转移;免疫药物和放化疗联合治疗模式值得进一步的研究。本研究在单中心初步证实了CRT联合ICI治疗LA/M ESCC的有效性和安全性。此外,还对患者预后潜在的独立预测因子进行了初步研究,并对CRT联合ICIs的联合模式、治疗后失败模式和相关不良反应等进行了初步探讨。然而,上述结论仍有待于未来进行更大规模的前瞻性研究的进一步证实。
利益冲突 无
作者贡献声明 李幼梅负责采集、分析数据及论文撰写;李曙光、宋春洋、赵小涵、邓文钊负责病例收集及临床观察;温晶媛、许金蕊负责随访和数据库建立;祝淑钗、沈文斌负责课题设计和论文修改
| [1] |
Krug S, Michl P. Esophageal cancer: new insights into a heterogenous disease[J]. Digestion, 2017, 95(4): 253-261. DOI:10.1159/000464130 |
| [2] |
Gronnier C, Collet D. New trends in esophageal cancer management[J]. Cancers (Basel), 2021, 13(12): 3030. DOI:10.3390/cancers13123030 |
| [3] |
Sun JM, Shen L, Shah MA, et al. Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study[J]. Lancet, 2021, 398(10302): 759-771. DOI:10.1016/S0140-6736(21)01234-4 |
| [4] |
Luo H, Lu J, Bai Y, et al. Effect of camrelizumab vs placebo added to chemotherapy on survival and progression-free survival in patients with advanced or metastatic esophageal squamous cell carcinoma: the ESCORT-1st randomized clinical trial[J]. JAMA, 2021, 326(10): 916-925. DOI:10.1001/jama.2021.12836 |
| [5] |
Wang ZX, Cui C, Yao J, et al. Toripalimab plus chemotherapy in treatment-naïve, advanced esophageal squamous cell carcinoma (JUPITER-06): A multi-center phase 3 trial[J]. Cancer Cell, 2022, 40(3): 277-288. DOI:10.1016/j.ccell.2022.02.007 |
| [6] |
Choueiri TK, Powles T, Burotto M, et al. Nivolumab plus cabozantinib versus sunitinib for advanced renal-cell carcinoma[J]. N Engl J Med, 2021, 384(9): 829-841. DOI:10.1056/NEJMoa2026982 |
| [7] |
Cao Y, Qin S, Luo S, et al. Pembrolizumab versus chemotherapy for patients with esophageal squamous cell carcinoma enrolled in the randomized KEYNOTE-181 trial in Asia[J]. ESMO Open, 2022, 7(1): 100341. DOI:10.1016/j.esmoop.2021.100341 |
| [8] |
Wu X, Li Y, Zhang K, et al. Immunotherapy with or without radiotherapy for metastatic or recurrent esophageal squamous cell carcinoma: A real-world study[J]. Clin Transl Radiat Oncol, 2023, 38: 130-137. DOI:10.1016/j.ctro.2022.10.011 |
| [9] |
Sihag S, Ku GY, Tan KS, et al. Safety and feasibility of esophagectomy following combined immunotherapy and chemoradiotherapy for esophageal cancer[J]. J Thorac Cardiovasc Surg, 2021, 161(3): 836-843. DOI:10.1016/j.jtcvs.2020.11.106 |
| [10] |
Wang R, Liu S, Chen B, et al. Recent advances in combination of immunotherapy and chemoradiotherapy for locally advanced esophageal squamous cell carcinoma[J]. Cancers (Basel), 2022, 14(20): 5168. DOI:10.3390/cancers14205168 |
| [11] |
Salas-Benito D, Pérez-Gracia JL, Ponz-Sarvisé M, et al. Paradigms on immunotherapy combinations with chemotherapy[J]. Cancer Discov, 2021, 11(6): 1353-1367. DOI:10.1158/2159-8290.CD-20-1312 |
| [12] |
Wu J, Waxman DJ. Immunogenic chemotherapy: dose and schedule dependence and combination with immunotherapy[J]. Cancer Lett, 2018, 419: 210-221. DOI:10.1016/j.canlet.2018.01.050 |
| [13] |
Mondini M, Levy A, Meziani L, et al. Radiotherapy-immunotherapy combinations-perspectives and challenges[J]. Mol Oncol, 2020, 14(7): 1529-1537. DOI:10.1002/1878-0261.12658 |
| [14] |
Donlon NE, Power R, Hayes C, et al. Radiotherapy, immunotherapy, and the tumour microenvironment: turning an immunosuppressive milieu into a therapeutic opportunity[J]. Cancer Lett, 2021, 502: 84-96. DOI:10.1016/j.canlet.2020.12.045 |
| [15] |
Zhang W, Yan C, Zhang T, et al. Addition of camrelizumab to docetaxel, cisplatin, and radiation therapy in patients with locally advanced esophageal squamous cell carcinoma: a phase 1b study[J]. Oncoimmunology, 2021, 10(1): 1971418. DOI:10.1080/2162402X.2021.1971418 |
| [16] |
Park S, Oh D, Choi YL, et al. Durvalumab and tremelimumab with definitive chemoradiotherapy for locally advanced esophageal squamous cell carcinoma[J]. Cancer, 2022, 128(11): 2148-2158. DOI:10.1002/cncr.34176 |
| [17] |
Wu J, Deng R, Ni T, et al. Efficacy and safety of radiotherapy/chemoradiotherapy combined with immune checkpoint inhibitors for locally advanced stages of esophageal cancer: A systematic review and meta-analysis[J]. Front Oncol, 2022, 12: 887525. DOI:10.3389/fonc.2022.887525 |
| [18] |
Wang C, Jin L, Cheng X, et al. Real-world efficacy and safety of sintilimab-based regimens against advanced esophageal cancer: a single-center retrospective observational study[J]. Biomed Res Int, 2022, 2022: 7331687. DOI:10.1155/2022/7331687 |
| [19] |
Yu R, Wang W, Li T, et al. RATIONALE 311: tislelizumab plus concurrent chemoradiotherapy for localized esophageal squamous cell carcinoma[J]. Future Oncol, 2021, 17(31): 4081-4089. DOI:10.2217/fon-2021-0632 |
| [20] |
Shah MA, Bennouna J, Doi T, et al. KEYNOTE-975 study design: a Phase Ⅲ study of definitive chemoradiotherapy plus pembrolizumab in patients with esophageal carcinoma[J]. Future Oncol, 2021, 17(10): 1143-1153. DOI:10.2217/fon-2020-0969 |
| [21] |
Bando H, Kotani D, Tsushima T, et al. TENERGY: multicenter phase Ⅱ study of Atezolizumab monotherapy following definitive chemoradiotherapy with 5-FU plus cisplatin in patients with unresectable locally advanced esophageal squamous cell carcinoma[J]. BMC Cancer, 2020, 20(1): 336. DOI:10.1186/s12885-020-06716-5 |
| [22] |
Zheng J, Huang B, Xiao L, et al. Treatment- and immune-related adverse events of immune checkpoint inhibitors in esophageal or gastroesophageal junction cancer: A network meta-analysis of randomized controlled trials[J]. Front Oncol, 2022, 12: 821626. DOI:10.3389/fonc.2022.821626 |
| [23] |
Martins F, Sofiya L, Sykiotis GP, et al. Adverse effects of immune-checkpoint inhibitors: epidemiology, management and surveillance[J]. Nat Rev Clin Oncol, 2019, 16(9): 563-580. DOI:10.1038/s41571-019-0218-0 |
| [24] |
Huang TT, Li SH, Chen YH, et al. Definitive chemoradiotherapy for clinical T4b esophageal cancer - Treatment outcomes, failure modes, and prognostic factors[J]. Radiother Oncol, 2021, 157: 56-62. DOI:10.1016/j.radonc.2021.01.007 |
| [25] |
Du R, Fan S, Wang X, et al. Postoperative lymphatic recurrence distribution and delineation of the radiation field in lower thoracic squamous cell esophageal carcinomas: a real-world study[J]. Radiat Oncol, 2022, 17(1): 47. DOI:10.1186/s13014-022-01987-7 |
| [26] |
Liu S, Wen J, Yang H, et al. Recurrence patterns after neoadjuvant chemoradiotherapy compared with surgery alone in oesophageal squamous cell carcinoma: results from the multicenter phase Ⅲ trial NEOCRTEC5010[J]. Eur J Cancer, 2020, 138: 113-121. DOI:10.1016/j.ejca.2020.08.002 |
| [27] |
Eyck BM, van Lanschot J, Hulshof M, et al. Ten-year outcome of neoadjuvant chemoradiotherapy plus surgery for esophageal cancer: the randomized controlled CROSS trial[J]. J Clin Oncol, 2021, 39(18): 1995-2004. DOI:10.1200/JCO.20.03614 |
 2023, Vol. 43
2023, Vol. 43


