2. 苏州大学苏州医学院放射医学与防护学院, 放射医学与辐射防护国家重点实验室, 苏州 215123
2. State Key Laboratory of Radiation Medicine and Protection, School of Radiation Medicine and Protection, Suzhou Medical College of Soochow University, Suzhou 215123, China
胶质瘤是常见的原发性中枢神经系统的恶性肿瘤之一,目前手术切除加术后放射治疗及化疗是胶质瘤治疗的标准方案。常规放射治疗(conventional radiotherapy)可以杀死肿瘤细胞,但也增加了正常脑组织发生不良反应的可能性。超高剂量率放射治疗(FLASH)以超高剂量率(>40 Gy/s)进行辐射,“闪光效应”的出现既保证了辐射对肿瘤组织的杀伤效果又保护了正常组织。最近发表的一项质子FLASH姑息性治疗四肢骨转移癌患者的临床试验,结果显示大部分患者能够获得疼痛缓解且没有明显的不良反应,说明FLASH疗法在临床环境中是可行的[1]。在大脑中,与CONV-RT相比,FLASH-RT已被证明导致更少的炎症,并且对小鼠的血管和神经认知功能有更高程度的保护[2-3]。Montay\|Gruel等[4]进一步研究发现大分割FLASH-RT能够有效治疗脑胶质母细胞瘤。但目前关于FLASH-RT治疗胶质瘤的研究较少,关于FLASH-RT治疗胶质瘤后血浆代谢组学变化的研究鲜有报道。本研究采用非靶向代谢组学方法,探究FLASH-RT与CONV-RT引起的胶质瘤小鼠血浆代谢物变化,为进一步研究FLASH-RT治疗胶质瘤的分子机制提供新思路。
材料与方法1. 实验动物:健康雄性C57BL/6J小鼠21只,SPF级,6~8周龄,体重18~22 g,购自成都达硕实验动物有限公司[生产许可证号:SCXK(川)2020-030],饲养于苏州大学无特定病原体级动物房屏障环境内,饲养温度18~25℃,相对湿度40%~70%,小鼠饲养1周适应环境后构建颅内胶质瘤模型(1×106个GL261细胞移植入小鼠的右侧额叶),胶质瘤模型构建成功后按随机数字表法分为健康对照组(3只)、超高剂量率照射组(FLASH-RT组,9只)、常规照射组(CONV-RT组,9只)。其中,FLASH-RT组和CONV-RT组按照后1、3、7 d又分别设亚组,每组3只。
2. 仪器与照射:小鼠腹腔注释异戊巴比妥麻醉,用胶布将小鼠固定在塑料板上。FLASH-RT利用中国原子能科学研究院北京串列加速器核物理国家实验室CYCIAE-100平台进行,以60 Gy/s的剂量率对小鼠头部进行单次24 Gy质子射线照射,能量为90 MeV,射野为5 cm×5 cm。CONV-RT剂量率为0.4 Gy/s,其他条件相同。健康对照组小鼠在相同条件下接受0 Gy假照射。
3. 血浆制备:照射组分别于照射后1、3、7 d后,收集小鼠眼内眦静脉血于1.5 ml离心管中,健康对照组于假照射7 d后收集小鼠眼内眦静脉血;4℃,3 000 r/min,离心半径8 cm,离心10 min,收集血浆于新的离心管中置于-80℃冰箱。上样前取出样本在4℃条件下解冻,解冻后样本涡旋1 min,混合均匀,取100 μl样本加入400 μl甲醇溶液,涡旋1 min;12 000 r/min,离心半径8 cm,4℃离心10 min,取全部上清至新的离心管,加入150 μl 80%甲醇水配置的2-氯-L-苯丙氨酸溶液复溶样本,取上清液过0.22 μm膜过滤,过滤液用于检测。
4. 液相色谱-质谱联用:①色谱条件:Thermo Vanquish(美国Thermo Fisher公司)超高效液相系统,使用ACQUITY UPLC® HSS T3(2.1×150 mm, 1.8 μm,美国Waters公司)色谱柱,流速0.25 ml/min,柱温40℃,进样量2 μl,进行梯度洗脱。其中,正离子模式流动相为0.1%甲酸乙腈和0.1%甲酸水;负离子模式流动相为乙腈和5 mmol/L甲酸铵水。②质谱条件:Thermo Orbitrap Exploris 120质谱检测器(美国Thermo Fisher公司),电喷雾离子源(ESI),正负离子模式分别采集数据。正离子喷雾电压为3.50 kV,负离子喷雾电压为-2.50 kV。以分辨率60 000进行一级全扫描,一级离子扫描范围m/z 100~1 000,并采用离能碰撞解离(HCD)进行二级裂解,碰撞电压为30%,二级分辨率为15 000,采集信号前离子进行碎裂,同时采用动态排除去除无必要的MS/MS信息。
5. 数据处理、分析与代谢物鉴定:通过Proteowizard软件包(v3.0.8789)中MSConvert工具将原始质谱下机文件转换为mzXML文件格式。采用R XCMS软件包进行峰检测、峰过滤、峰对齐处理,得到物质定量列表。采用公共数据库Human Metabolome Database (HMDB)、massbank、LipidMaps、mzcloud、KEGG及自建物质库进行物质的鉴定,参数设置为ppm < 30 ppm。基于质量控制样本的LOESS信号校正方法实现数据矫正,消除系统误差。数据质量控制中过滤掉质量控制样本中相对标准偏差>30%的物质。
6. 统计学处理:使用OPLS-DA降维方法计算变量投影重要度(VIP)、fold change(FC)计算组间差异倍数,衡量各代谢物组分含量对样本分类判别的影响强度和解释能力,辅助标志代谢物的筛选。采用SPSS 26.0软件进行统计分析。两组间比较经正态检验符合正态分布采用独立样本t检验。当P<0.05且VIP>1时,认为代谢物分子差异具有统计学意义。
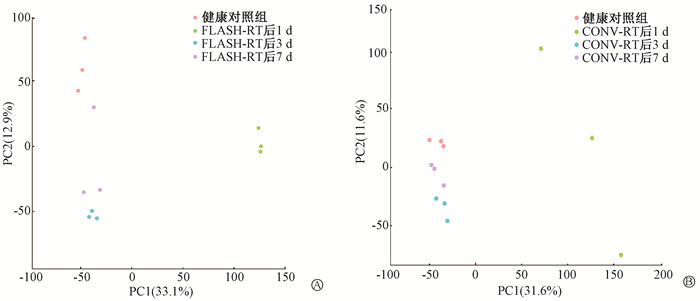
结果1. FLASH-RT与CONV-RT影响胶质瘤小鼠血浆代谢物改变:为研究照射对胶质瘤小鼠血浆代谢物的影响,对不同照射处理的血浆样本进行了非靶向代谢组学分析,结果见图 1。FLASH-RT组与健康对照组血浆样本主成分分析(PCA)结果表明,小鼠头部照射后,血浆代谢物发生了明显变化,FLASH-RT照后1与3 d组间分布聚集,与健康对照组能被明显区分;照后7 d组间分布相对分散,但仍能与健康对照组区分。CONV-RT组与健康对照组血浆样本PCA结果同样表明,小鼠头部照射后,血浆代谢物发生了明显变化。但与FLASH-RT组不同,CONV-RT照后1 d组间分布相对分散,而照后3和7 d组间分布相对聚集,但均可与健康对照组区分。以上结果表明,超高剂量率照射与常规照射均会引起胶质瘤小鼠血浆代谢物的差异,照射后第1天差异最明显,随着时间延长,照射引起的差异减小。
|
注:FLASH-RT. 超高剂量率照射;CONV-RT. 常规照射 图 1 FLASH-RT(A)与CONV-RT(B)后1、3、7 d胶质瘤小鼠血浆代谢物变化 Figure 1 Changes in plasma metabolites in glioma mice at 1, 3 and 7 d after FLASH-RT (A) and CONV-RT (B) |
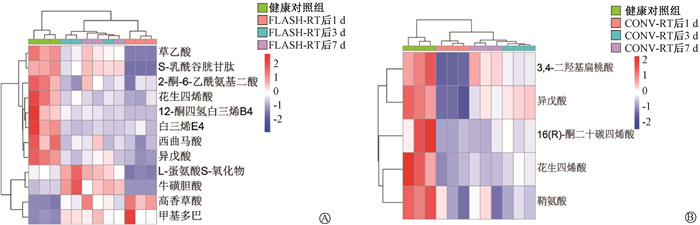
2. 血浆差异代谢物的筛选:通过比对公共数据库HMDB,再根据VIP>1且P < 0.05筛选出内源性差异代谢物。与健康对照组相比,FLASH-RT组3个时间点均存在的血浆差异代谢产物共有12种(表 1)。其中,甲基多巴和高香草酸在FLASH-RT后血浆含量升高,在照射1 d后血浆含量最高,照射3与7 d后血浆含量有所降低但仍高于健康对照组。而其余10种代谢物在照射1 d后血浆含量均较健康对照组低,其中牛磺胆酸与L-蛋氨酸S-氧化物在照射3、7 d后血浆含量升高,高于健康对照组;而其他8种代谢产物在照射3、7 d后血浆含量发生变化但仍低于健康对照组(图 2)。与健康对照组相比,CONV-RT组3个时间点均存在的差异代谢产物共有5种(表 2)。CONV-RT后,5种差异代谢物的血浆含量均发生下调(图 2),在照后1、3、7 d均低于健康对照组。
|
|
表 1 FLASH-RT后1、3、7 d胶质瘤小鼠共有血浆差异代谢物参数 Table 1 Parameters of the common plasma differential metabolites in glioma mice at 1, 3 and 7 d after FLASH-RT |
|
|
表 2 CONV-RT后1、3、7 d胶质瘤小鼠共有血浆差异代谢物参数 Table 2 Parameters of the common plasma differential metabolites in glioma mice at 1, 3 and 7 d after CONV-RT |
|
注:FLASH-RT.超高剂量率照射;CONV-RT.常规照射 图 2 胶质瘤小鼠照射后血浆差异代谢物热图分析A. FLASH-RT组;B. CONV-RT组 Figure 2 Heat map analysis of plasma differential metabolites after radiation in glioma mice A. FLASH-RT group; B. CONV-RT group |
|
注:FLASH-RT.超高剂量率照射;CONV-RT.常规照射 图 3 胶质瘤小鼠照射后代谢物KEGG富集代谢通路分析A. FLASH-RT组;B. CONV-RT组 Figure 3 KEGG enrichment pathway analysis of the plasma metabolites after radiation in glioma mice A. FLASH-RT group; B. CONV-RT group |
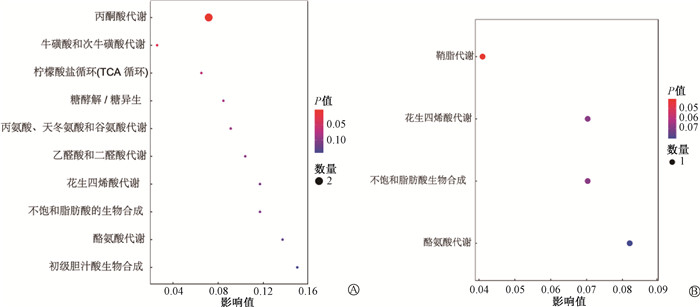
3. 代谢通路分析:为探索不同照射方式诱导胶质瘤小鼠血浆代谢途径的变化,分别将FLASH-RT组筛选出的12种代谢物和CONV-RT组筛选出的5种代谢物进行代谢通路的富集分析。结果表明,胶质瘤小鼠受到超高剂量率照射后,共有10条代谢通路发生变化(图 3),分别为丙酮酸代谢、牛磺酸和次牛磺酸代谢、柠檬酸盐循环、糖酵解/糖异生、丙氨酸、天冬氨酸和谷氨酸代谢、乙醛酸和二羧酸代谢、花生四烯酸代谢、不饱和脂肪酸的生物合成、酪氨酸代谢、初级胆汁酸生物合成。而胶质瘤小鼠受常规照射之后,共有4条代谢通路发生变化(图 3),分别为鞘脂代谢、花生四烯酸代谢、不饱和脂肪酸的生物合成和酪氨酸代谢。
讨论脑胶质瘤发病率高、侵袭性显著,呈浸润性生长,单纯手术难以完全切除,目前临床治疗以手术切除联合放化疗为主。常规放射治疗高级别胶质瘤所需照射剂量大,易导致邻近脑组织放射性脑损伤,带来认知功能障碍、视力障碍等不良反应,影响患者生存质量,因此探寻更为安全有效的放疗措施成为治疗脑胶质瘤的研究热点之一。有学者研究发现使用FLASH-RT治疗患有癌症的猫,与CONV-RT相比,猫的急性辐射损伤反应较轻,并且获得更长的无进展生存时间[5]。本课题组之前的一项研究比较了FLASH-RT与CONV-RT之后小鼠的肝脏损伤情况,发现FLASH-RT能够明显降低小鼠肝脏的炎症反应[6]。临床上使用FLASH-RT治疗过一位皮肤T细胞淋巴瘤患者,照射之后通过体格检查及光学相干断层扫描技术共同观察皮肤炎症及肿瘤消退变化,结果显示FLASH-RT对于减轻皮肤炎症反应及消除肿瘤细胞均有良好的效果[7]。Konradsson等[8]发现FLASH-RT能够提高胶质瘤大鼠的生存率,保持与CONV-RT治疗相同的疗效。Montay\|Gruel等[4]进一步研究发现,大分割FLASH-RT能够有效治疗脑胶质母细胞瘤,并且显著减少小鼠神经认知不良反应。Iturri等[9]也证实质子FLASH-RT能够治疗脑胶质瘤,并且具有神经保护作用。
过往已有研究利用代谢组学技术筛选CONV-RT之后小鼠或者大鼠血浆、尿液、粪便等样本中差异表达的代谢物[10],以期寻找敏感的生物标志物为电离辐射的危害评估和防护提供依据。本课题组前期对比了FLASH-RT与CONV-RT对AOM/DSS结直肠癌模型小鼠粪便代谢组学的影响,发现FLASH-RT后,L-精氨酸、D-精氨酸和精胺下调[11]。但尚未探索过FLASH-RT治疗胶质瘤小鼠后血浆代谢产物的变化,也未探索过FLASH-RT与CONV-RT之间存在哪些相同或者异同的差异代谢物。本研究采用不同的辐射方式照射胶质瘤小鼠头部,利用代谢组学方法,发现FLASH-RT与CONV-RT均会引起胶质瘤小鼠血浆代谢物的变化。结果表明,与健康对照组相比,照射后1 d血浆代谢物差异最明显,照后3和7 d差异减小。
FLASH-RT与CONV-RT相比,既有相同点,即都能通过辐射杀死肿瘤细胞;又有不同点,FLASH-RT能够更好地保护正常组织,减轻辐射引起的损伤反应。但引起两者相同及不同机体表现的分子机制尚不十分明确,仍需要继续探索。与健康对照组相比,FLASH-RT后3个时间点均存在的血浆差异代谢物有12种,而CONV-RT组有5种。其中花生四烯酸与异戊酸既存在于FLASH-RT组与健康对照组的比对中,也存在于CONV-RT组与健康对照组的比对中,并且照射后的变化趋势相对一致,照射后1 d血浆含量降低,第3、7天略有回升,有可能成为不同辐射方式共有的辐射敏感标志物。
高香草酸和甲基多巴是FLASH-RT后血浆含量升高的2种差异代谢物,并且照射后的1、3、7 d血浆含量均高于健康对照组。高香草酸是多巴胺在降解酶的作用下产生的主要代谢产物,通常被视为多巴胺活性的主要指标。多巴胺是脑内重要神经递质,在控制行为和认知功能中具有重要作用,多巴胺异常调节,可以导致精神活动和运动功能紊乱[12]。研究发现随着认知功能的恶化,帕金森患者血清中的高香草酸浓度下降,推测高香草酸的变化可能协同参与帕金森患者执行功能障碍的发生和发展[13]。FLASH-RT后血浆中高香草酸含量增高,推测其与FLASH-RT后小鼠神经认知功能损坏减轻的分子机制相关。白三烯E4在FLASH-RT后含量下调,3个时间点含量均低于健康对照组。白三烯E4主要参与调节肥大细胞与嗜酸性细胞脱颗粒,促进气道的炎症反应。有研究发现,在哮喘的急性发作期血中或尿液中的白三烯E4升高[14],调控白三烯E4表达增多会加重气道炎症[15],其可以作为哮喘严重程度的生物标志物。FLASH-RT后白三烯E4在血浆中的含量下降,推测其引起的机体炎症反应减轻,该现象提示FLASH-RT后辐射损伤减轻的分子机制可能与白三烯E4的代谢途径及相关通路有关。草乙酸在FLASH-RT后的第1天血浆含量明显低于健康对照组,随后随着时间延长,血浆含量逐渐升高,但仍然低于健康对照组。草乙酸参与的生理过程包括丙酮酸代谢、柠檬酸循环、糖酵解/糖异生等,调控机体的能量代谢、糖代谢和氧化还原过程。有研究发现,草乙酸能够降低细胞内的活性氧(ROS)水平,发挥类似ROS清除剂的作用[16]。本研究结果显示,FLASH-RT引起胶质瘤小鼠血浆草乙酸含量降低,提示FLASH-RT使得机体在短时间内进行了大量的能量代谢,消耗大量氧,推测可能与FLASH-RT使正常组织缺氧的分子机制相关。S-乳酰谷胱甘肽的变化规律同草乙酸一致,在FLASH-RT后的第1天血浆含量明显低于健康对照组,随后血浆含量逐渐升高,但照后7 d血浆含量尚未恢复正常,仍然低于健康对照组。它是乙二醛酶对甲基乙二醛进行谷胱甘肽依赖性代谢的中间体。乙二醛酶1以还原型谷胱甘肽为辅因子,将甲基乙二醛转化为中间产物s-乳酰基谷胱甘肽,后者被乙二醛酶2转变为乳酸,同时再生成还原性谷胱甘肽。产生的乳酸在乳酸脱氢酶的作用下转变为丙酮酸。乙二醛酶系统不仅可清除过量的甲基乙二醛保持其稳态,也可通过调节还原性谷胱甘肽的再生,维持细胞中的氧化还原系统。S-乳酰基谷胱甘肽是线粒体还原性谷胱甘肽的储存库[17],参与能量代谢调节及氧化还原反应。FLASH-RT破坏了S-乳酰基谷胱甘肽的动态平衡。
通过对筛选出的血浆差异代谢物进行KEGG代谢通路富集分析,发现FLASH-RT与CONV-RT都涉及参与花生四烯酸代谢、不饱和脂肪酸生物合成及酪氨酸代谢等生理过程。与CONV-RT组不同,FLASH-RT组主要涉及丙酮酸代谢。丙酮酸代谢调控机体的能量转换过程,葡萄糖通过糖酵解生成丙酮酸,在有氧条件下,丙酮酸进入三羧酸循环,无氧条件下则生成乳酸。为了适应肿瘤细胞具有快速增殖的特点,大多数肿瘤细胞通过产能率相对较低的糖酵解过程,肿瘤细胞中的大部分丙酮酸进入无氧糖酵解途径生成乳酸,进入线粒体进行氧化的丙酮酸减少,分析结果提示FLASH-RT可以通过调节丙酮酸代谢途径影响肿瘤细胞的消亡。
综上所述,本研究通过非靶向代谢组学探究了FLASH-RT与CONV-RT对胶质瘤小鼠血浆代谢物的影响,发现FLASH-RT和CONV-RT能够共同引起一些代谢物变化,共有2种,分别为花生四烯酸和异戊酸,有希望成为共有的辐射敏感标记物;FLASH-RT后也能引起一些特有的血浆代谢物变化,共有10种,主要涉及能量代谢和氧化还原反应,有可能为探索FLASH-RT控制胶质瘤、降低神经认知功能等不良反应的分子机制提供思路。但本研究也存在着一定的缺陷,使用非靶向代谢组学方法筛选出差异代谢物之后,没有进一步应用靶向代谢组学方法对胶质瘤小鼠血浆进行定量分析,因而无法对筛选得到的代谢物进行验证,导致了假阳性结果存在的可能性,需要在后期的实验中进一步完善与验证。
利益冲突 无
作者贡献声明 张俊负责实验操作和论文撰写;胡文涛、许志明、程馨阳协助实验动物处理和样本制备;张永胜、曹志飞负责课题设计和论文修改
| [1] |
Mascia AE, Daugherty EC, Zhang Y, et al. Proton FLASH radiotherapy for the treatment of symptomatic bone metastases: the FAST-01 nonrandomized trial[J]. JAMA Oncol, 2023, 9(1): 62-69. DOI:10.1001/jamaoncol.2022.5843 |
| [2] |
Montay-Gruel P, Markarian M, Allen BD, et al. Ultra-high-dose-rate FLASH irradiation limits reactive gliosis in the brain[J]. Radiat Res, 2020, 194(6): 636-645. DOI:10.1667/RADE-20-00067.1 |
| [3] |
Allen BD, Acharya MM, Montay-Gruel P, et al. Maintenance of tight junction integrity in the absence of vascular dilation in the brain of mice exposed to ultra-high-dose-rate FLASH irradiation[J]. Radiat Res, 2020, 194(6): 625-635. DOI:10.1667/RADE-20-00060.1 |
| [4] |
Montay-Gruel P, Acharya MM, Gonçalves Jorge P, et al. Hypofractionated FLASH-RT as an effective treatment against glioblastoma that reduces neurocognitive side effects in mice[J]. Clin Cancer Res, 2021, 27(3): 775-784. DOI:10.1158/1078-0432.CCR-20-0894 |
| [5] |
Vozenin MC, De Fornel P, Petersson K, et al. The advantage of FLASH radiotherapy confirmed in mini-pig and cat-cancer patients[J]. Clin Cancer Res, 2019, 25(1): 35-42. DOI:10.1158/1078-0432.CCR-17-3375 |
| [6] |
杨天宇, 徐蒙蒙, 胡文涛, 等. 超高剂量率照射和常规照射对小鼠肝脏辐射损伤的转录组学比较研究[J]. 中华放射医学与防护杂志, 2023, 43(3): 168-175. Yang TY, Xu MM, Hu WT, et al. Transcriptomic comparative study on mouse liver injury caused by ultra-high dose rate irradiation and conventional irradiation[J]. Chin J Radiol Med Prot, 2023, 43(3): 168-175. DOI:10.3760/cma.j.cn112271-20221130-00463 |
| [7] |
Bourhis J, Sozzi WJ, Jorge PG, et al. Treatment of a first patient with FLASH-radiotherapy[J]. Radiother Oncol, 2019, 139: 18-22. DOI:10.1016/j.radonc.2019.06.019 |
| [8] |
Konradsson E, Liljedahl E, Gustafsson E, et al. Comparable long-term tumor control for hypofractionated FLASH versus conventional radiation therapy in an immunocompetent rat glioma model[J]. Adv Radiat Oncol, 2022, 7(6): 101011. DOI:10.1016/j.adro.2022.101011 |
| [9] |
Iturri L, Bertho A, Lamirault C, et al. Proton FLASH radiation therapy and immune infiltration: evaluation in an orthotopic glioma rat model[J]. Int J Radiat Oncol Biol Phys, 2023, 116(3): 655-665. DOI:10.1016/j.ijrobp.2022.12.018 |
| [10] |
赵骅, 习聪, 田雪蕾, 等. 全身照射后大鼠血浆代谢特征分析[J]. 中华放射医学与防护杂志, 2021, 41(6): 401-406. Zhao H, Xi C, Tian XL, et al. Analysis of the metabolic characteristics in rat plasma after total body irradiation[J]. Chin J Radiol Med Prot, 2021, 41(6): 401-406. DOI:10.3760/cma.j.cn0254-5098.2021.06.001 |
| [11] |
Xu M, Qiu X, Chen Q, et al. Changes of gut microbiome and metabolome in the AOM/DSS mouse model of colorectal cancer with FLASH radiation[J]. Radiat Med Prot, 2023, 4(1): 1-10. DOI:10.1016/j.radmp.2023.02.001 |
| [12] |
Saha S, Chatterjee M, Dutta N, et al. Analysis of neurotransmitters validates the importance of the dopaminergic system in autism spectrum disorder[J]. World J Pediatr, 2023, 19(8): 770-781. DOI:10.1007/s12519-023-00702-0 |
| [13] |
Tong SY, Wang RW, Li Q, et al. Serum glial cell line-derived neurotrophic factor (GDNF) a potential biomarker of executive function in Parkinson's disease[J]. Front Neurosci, 2023, 17: 1136499. DOI:10.3389/fnins.2023.1136499 |
| [14] |
Ban GY, Kim SH, Park HS. Persistent eosinophilic inflammation in adult asthmatics with high serum and urine levels of leukotriene E(4)[J]. J Asthma Allergy, 2021, 14: 1219-1230. DOI:10.2147/JAA.S325499 |
| [15] |
Choi Y, Sim S, Lee DH, et al. Effect of TGF-β1 on eosinophils to induce cysteinyl leukotriene E4 production in aspirin-exacerbated respiratory disease[J]. PLoS One, 2021, 16(8): e0256237. DOI:10.1371/journal.pone.0256237 |
| [16] |
Ma N, Shangguan F, Zhou H, et al. 6-methoxydihydroavicine, the alkaloid extracted from Macleaya cordata (Willd.) R. Br. (Papaveraceae), triggers RIPK1/Caspase-dependent cell death in pancreatic cancer cells through the disruption of oxaloacetic acid metabolism and accumulation of reactive oxygen species[J]. Phytomedicine, 2022, 102: 154164. DOI:10.1016/j.phymed.2022.154164 |
| [17] |
Armeni T, Cianfruglia L, Piva F, et al. S-D-Lactoylglutathione can be an alternative supply of mitochondrial glutathione[J]. Free Radic Biol Med, 2014, 67: 451-459. DOI:10.1016/j.freeradbiomed.2013.12.005 |
 2023, Vol. 43
2023, Vol. 43


