放射性直肠炎是盆腔肿瘤放疗最常见的并发症,而传统药物治疗重症放射性直肠炎疗效有限,需探索新的治疗策略应用于临床。本研究报道3例重症放射性直肠炎患者,经大剂量维生素C联合环氧合酶-2(cyclooxygenase-2,COX-2)抑制剂治疗后,其腹泻、便血、里急后重、疼痛等症状明显改善,影像学复查直肠壁水肿较前明显好转,提示大剂量维生素C联合治疗重症放射性直肠炎具有较高的安全性和有效性。
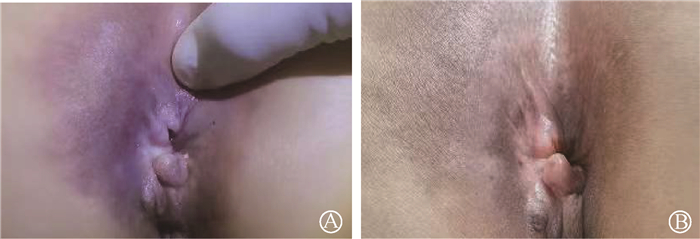
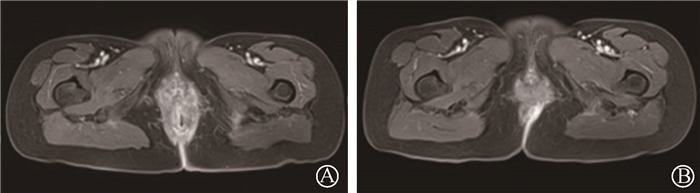
一、临床资料1. 病例一:患者女,57岁,确诊为肛管鳞癌(cT3N0M0),于2019年8月15日开始行原发灶腔内后装治疗(12 Gy/3次,192Ir,美国瓦里安GammaMedplus),后行盆腔外照射放疗(美国安科锐TomoTherapy System TOMO-HD 6 MV X射线),45 Gy/25次,予丝裂霉素联合5-氟尿嘧啶(5-FU)同步化疗。放疗后程患者出现Ⅲ级放射性直肠炎、肛周Ⅲ级放射性皮炎,予以对症治疗后稍有好转。之后定期复查,肿瘤完全缓解。后于2020年5月开始无明显诱因腹泻,5~6次/d,为黏液血便,伴里急后重及肛门疼痛,行抗炎治疗后未见好转。查体可见肛门及肛周皮肤红肿,指诊括约肌张力正常,肛门触痛明显无法配合完成查体,指套染血。入院后检查粪便潜血(HB法):阳性(+)。盆腔磁共振(MRI)提示,直肠下段—肛管肠壁明显增厚,肿瘤信号消失,但周围软组织肿胀明显。诊断为Ⅲ级放射性直肠炎及放射性皮炎。于2020年6月19日至10月14日给予大剂量维生素C输注(24 g/d,静脉泵入,第1~21天,1次/28 d)并口服塞来昔布(0.2 g/次,1次/12 h),辅以阿莫西林克拉维酸静脉注射2周。两程大剂量维生素C治疗后,患者症状显著缓解,肛门及肛周红肿明显好转,盆腔MRI对比前片:直肠下段—肛管肠壁增厚及周围软组织肿胀较前范围明显缩小。2020年10月14日治疗结束后于门诊随访,肛周皮肤恢复正常,肛门指诊无异常,放射性直肠炎相关症状无复发(图 1,2)。
|
图 1 病例一肛门和局部皮肤 A.治疗前体检可见肛门周围皮肤红肿,色素沉着,脓血性分泌物,11点处肛裂;B.经2个周期大剂量维生素C治疗后明显好转 Figure 1 Anus and local skin of case 1 A.Physical examination revealed that red swelling, hyperpigmentation, and purulent secretion around the anus, and anal fistula at 11 o′clock; B. The clinical features were significant relief after 2 cycles of high dose vitamin C treatment compared with previous |
|
图 2 病例一盆腔MRI显示直肠-肛门周围软组织水肿经治疗后明显好转 A.治疗前;B.治疗后 Figure 2 Pelvic MRI scanning images of case 1 showed that edema of soft tissue around the rectum and anus was significant relief after the treatment A.Before treatment; B.After treatment |
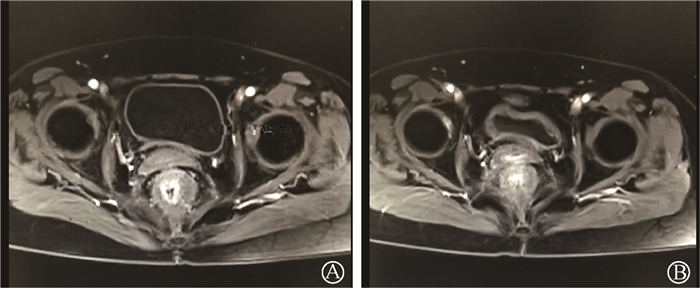
2. 病例二:患者女,55岁,因宫颈鳞癌ⅡB期于2018年3月26日开始行盆腔调强放疗(美国瓦里安Clinac IX,6 MV X射线,45 Gy/25次,同步顺铂化疗4次,期间行后装治疗30 Gy/5次(192Ir,瓦里安GammaMedplus)。之后复查显示肿瘤完全缓解,但反复出现血便,对症处理缓解不明显。2019年3月肠镜检查见直肠黏膜表面溃烂出血,病检示肠黏膜组织慢性炎症,予抗炎、抗感染等治疗后无显著好转,仍间断反复便血。2019年8月17日开始便血加重,5次/d,每次30~80 ml,伴里急后重及肛门疼痛、头昏乏力。入院查体:体温36.4℃,心率101次/min,血压95/62 mmHg,呼吸24次/min。精神差,贫血貌,肛周皮肤红肿伴局部破溃,指诊可及肛管松紧适中,直肠黏膜欠光滑,触痛明显,指套退出少量染血。入院后查血常规:白细胞3.1×109/L,血红蛋白31.0 g/L。盆腔MRI提示盆底筋膜水肿,直肠壁水肿增厚。诊断为Ⅲ级放射性直肠炎、重度失血性贫血。予以补液、止血、输血、补铁升红等对症支持治疗。肠镜活检报告为直肠黏膜炎性改变。于2019年8月31日至9月10日予大剂量维生素C治疗(12 g,静脉泵入,每日1次),症状稍好转。之后继续于2019年10月2日至12月24日予大剂量维生素C(24 g,静脉泵入,第1~21天,1次/28 d),并口服塞来昔布(0.2 g,1次/12 h)治疗。治疗结束后,患者便血症状显著缓解,持续监测血红蛋白可维持在110~120 g/L,2020年1月复查盆腔MRI提示直肠壁水肿增厚较前好转。长期随访,患者放射性肠炎症状未复发,血红蛋白维持正常。治疗效果见图 3。
|
图 3 病例二盆腔MRI显示治疗前直肠壁水肿增厚(A) 治疗后减轻(B) Figure 3 Pelvic MRI scanning images of case 2 showed the rectal wall was edema and thickening before treatment (A) and relief after treatment (B) |
3. 病例三:患者女,62岁,确诊为肛管鳞癌(cT2N0M0),于2018年9月开始行盆腔调强放疗(美国瓦里安Clinac IX,6 MV X射线,50.4 Gy/28次,期间同步卡培他滨化疗。放疗后期放射性肠炎症状明显,给予抗炎、止痛等对症处理后好转。后影像学复查肿瘤完全缓解。患者于2019年8月出现大便带血,4~5次/d,伴肛周疼痛及间断便血,于外院抗炎治疗未见明显好转。入院查体:肛门周围皮肤明显色素沉着,肛门口可见部分皮肤破溃,表面干燥无脓性分泌物,肛门指诊未及肿物,肛门直肠局部肿胀,退出指套染血。入院后检查:粪便潜血(HB法):阳性(+)。肠镜显示可见一深基溃疡,附白苔,质韧,弹性消失)。肛管病理活检显示黏膜脱垂性息肉伴炎性改变。诊断为Ⅲ级放射性直肠炎。于2019年10月16日至20日给予大剂量维生素C输注(18 g,静脉泵入,1次/d),并口服艾瑞昔布(0.1 g,1次/12 h),静脉滴注头孢孟多酯钠粉针(2 g,2次/d),治疗结束后患者未诉血便及肛周疼痛,长期随访未见症状复发。
二、讨论盆腔肿瘤发病率居高不下。在男性中,前列腺癌位居第1位,结直肠癌位居第3位,膀胱癌位居第4位;女性中,结直肠位居第3位,子宫肿瘤位居第4位[1]。放射治疗是盆腔肿瘤治疗的重要手段之一,而直肠黏膜是高放射敏感性组织,放疗会导致超过75%的患者发生急性放射性直肠炎,5%~20%的患者会发展成慢性放射性直肠炎[2]。环氧合酶抑制剂等非甾体类抗炎药、类固醇激素、抗生素等已经广泛用于治疗放射性直肠炎。但放射性直肠炎症状常易反复,难以痊愈,需要探索更有效且安全的联合治疗策略应用于临床。
放射性炎症的主要发病机制之一是氧化应激,因此联合应用抗氧化剂有望取得更好的疗效。维生素C作为一种天然抗氧化剂,其减轻正常组织,特别是胃肠道组织的放疗不良反应已经在大量临床前模型中得到验证。研究表明,在7.5 Gy全身照射后24 h内给予小鼠大剂量维生素C(3.0 g/kg),可以使辐射诱导的炎性细胞因子及自由基代谢物减少,降低辐射致死率[3]。Yamamoto等[4]发现,维生素C预处理小鼠可以显著抑制辐射诱导的隐窝细胞DNA损伤,防止肠黏膜的剥脱,从而预防高剂量照射引起的致死性胃肠综合征。Ito等[5]的研究发现,放疗前后使用维生素C可以保护小鼠免受辐射诱导的胃肠道损伤。其后续的研究中,发现维生素稳定的衍生物抗坏血酸葡萄苷(AA2G)可以减轻大鼠膀胱癌分次放疗后诱导的肠道损伤,而且并不降低放疗的抗肿瘤效果,这可能与AA2G促使M2型巨噬细胞功能恢复,从而促进肠道组织重塑和伤口愈合有关[6]。目前一些临床研究也证实了维生素C在治疗放射性炎性不良反应方面的疗效,包括乳腺癌放疗引起的放射性皮炎[7]、肺癌放疗导致的放射性肺炎[8]、头颈部肿瘤放疗引起的放射性口腔黏膜炎[9]等。在治疗放射性直肠炎方面,Kennedy等[10]给20例盆腔放疗的患者长期口服维生素C(500 mg,3次/d)合剂,其出血、腹泻、里急后重的症状较治疗前明显改善,并且10例患者1年后症状持续改善,取得成功且持久的疗效。而本研究中3例患者均以静脉给药的方式,并且极大提高维生素C的治疗剂量(24 g/d)。
大剂量口服维生素C可以促进胃肠蠕动,引起腹痛、腹泻、胃酸反流等不适,而采用静脉注射方式胃肠道反应更轻。有研究表明,在胃肠道吸收、组织转运及肾脏排泄等限制下,即使口服维生素C达到最大耐受剂量(3 g/4 h),所达到的血药浓度也十分有限,而静脉注射可将血药浓度提高至30~70倍,并且不同注射剂量下的血药浓度一般7 h内可恢复基线水平[11],因此即使每日连续给药也无需考虑累积不良反应发生。还有研究显示,静脉注射维生素C剂量递增至1.5 g/kg或110 g/m2,患者耐受性仍良好,无3级以上不良反应发生[12-13]。目前,国内外已经有多项探索静脉注射大剂量维生素C抗肿瘤作用的临床研究结果发表,每次注射剂量从十几克到上百克不等。因此,大剂量维生素C静脉输注有充足的安全性证据。需要注意的是,大剂量维生素C可能引起葡萄糖-6-磷酸脱氢酶(G6PD)缺乏的患者发生危及生命的溶血性反应,特别是在感染和发热的情况下。因此,建议患者治疗前进行酶活性检查,并且肾功能异常、尿路结石、血栓形成者等患者应谨慎使用大剂量维生素C治疗,注意监测相关指标。
3例患者均在盆腔放疗后出现急性放射性直肠炎,常规药物治疗效果不佳,迁延不愈,演变为重度慢性放射性直肠炎,且临床症状明显,严重影响患者生活质量。使用大剂量维生素C联合COX-2抑制剂治疗后,患者疼痛、便血、腹泻、里急后重等症状改善,影像学复查提示水肿较前明显好转,之后随访肠炎症状未再发,临床治愈。大剂量维生素C治疗过程中未出现明显不良反应,患者耐受性良好。本中心共为4例重度放射性直肠炎患者行大剂量维生素C治疗,有长期随访资料者为该3例,另有1例患者失访。本中心大剂量维生素C应用于局部晚期直肠癌新辅助放化疗的前瞻性Ⅱ期临床研究(NCT04801511)也正在进行中,预期研究结果将为大剂量维生素C在减轻放疗不良反应方面的临床应用提供更高级别的证据。
综上,应用大剂量维生素C联合传统药物治疗重症放射性直肠炎具有较好的安全性和有效性,且廉价易得,具有较好的临床应用前景。
利益冲突 该研究无影响其科学性与可信度的经济利益冲突,且作者间不存在任何利益冲突
志谢 感谢湖北省黄石市爱康医院朱琳燕主任医师提供部分病例资料
作者贡献声明 刘苗苗负责病例讨论、论文撰写与修改;江换钢、周福祥指导病例分析讨论;戴静、徐会、彭晋、杨萍负责病例收集和参与论文修改
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. DOI:10.3322/caac.21708 |
| [2] |
Gami B, Harrington K, Blake P, et al. How patients manage gastrointestinal symptoms after pelvic radiotherapy[J]. Aliment Pharm Ther, 2003, 18(10): 987-994. DOI:10.1046/j.1365-2036.2003.01760.x |
| [3] |
Sato T, Kinoshita M, Yamamoto TS, et al. Treatment of irradiated mice with high-dose ascorbic acid reduced lethality[J]. PLoS One, 2015, 10(2): e0117020. DOI:10.1371/journal.pone.0117020 |
| [4] |
Yamamoto T, Kinoshita M, Shinomiya N, et al. Pretreatment with ascorbic acid prevents lethal gastrointestinal syndrome in mice receiving a massive amount of radiation[J]. J Radiat Res, 2010, 51(2): 145-156. DOI:10.1269/jrr.09078 |
| [5] |
Ito Y, Kinoshita M, Yamamoto T, et al. A combination of pre-and post-exposure ascorbic acid rescues mice from radiation-induced lethal gastrointestinal damage[J]. Int J Mol Sci, 2013, 14(10): 19618-19635. DOI:10.3390/ijms141019618 |
| [6] |
Ito Y, Yamamoto T, Miyai K, et al. Ascorbic acid-2 glucoside mitigates intestinal damage during pelvic radiotherapy in a rat bladder tumor model[J]. Int J Radiat Biol, 2022, 98(5): 942-957. DOI:10.1080/09553002.2021.2009145 |
| [7] |
di Franco R, Calvanese M, Murino P, et al. Skin toxicity from external beam radiation therapy in breast cancer patients: protective effects of resveratrol, lycopene, vitamin C and anthocianin (Ixor (R))[J]. Radiat Oncol, 2012, 7: 12. DOI:10.1186/1748-717x-7-12 |
| [8] |
李向荣, 戈伟, 刘晓丽, 等. 放射性肺炎使用大剂量维生素C治疗的临床观察[J]. 内科急危重症杂志, 2012, 18(4): 214-215. Li XR, Ge W, Liu XL, et al. Clinical observation on application of high-dose vitamin C in patients with radiation pneumonia[J]. J Intern Intensive Med, 2012, 18(4): 214-215. DOI:10.11768/nkjwzzzz20220401 |
| [9] |
Chen G, Jiang H, Jiang D, et al. Pretreatment serum vitamin level predicts severity of radiation-induced oral mucositis in patients with nasopharyngeal carcinoma[J]. Head Neck, 2021, 43(4): 1153-1160. DOI:10.1002/hed.26576 |
| [10] |
Kennedy M, Bruninga K, Mutlu EA, et al. Successful and sustained treatment of chronic radiation proctitis with antioxidant vitamins E and C[J]. Am J Gastroenterol, 2001, 96(4): 1080-1084. DOI:10.1111/j.1572-0241.2001.03742.x |
| [11] |
Padayatty SJ, Sun H, Wang YH, et al. Vitamin C pharmacokinetics: implications for oral and intravenous use[J]. Ann Intern Med, 2004, 140(7): 533-537. DOI:10.7326/0003-4819-140-7-200404060-00010 |
| [12] |
Hoffer LJ, Levine M, Assouline S, et al. Phase Ⅰ clinical trial of i.v. ascorbic acid in advanced malignancy[J]. Ann Oncol, 2008, 19(11): 1969-1974. DOI:10.1093/annonc/mdn377 |
| [13] |
Stephenson CM, Levin RD, Spector T, et al. Phase Ⅰ clinical trial to evaluate the safety, tolerability, and pharmacokinetics of high-dose intravenous ascorbic acid in patients with advanced cancer[J]. Cancer Chemother Pharmacol, 2013, 72(1): 139-146. DOI:10.1007/s00280-013-2179-9 |
 2023, Vol. 43
2023, Vol. 43


