乳腺癌根治术后放射治疗可以降低患者的局部复发风险,并大大提高总生存率[1-2]。胸壁作为极易复发的部位[3-4],在治疗时需要通过覆盖由组织等效材料制成的补偿物来提高胸壁皮肤的剂量,以避免治疗失败的发生[5-6]。然而,补偿物的日常使用规范却存在着很大的地域差异[7-8],并且,很多研究发现补偿物的使用会加重患者的皮肤不良反应[9-11],但是关于补偿物对胸壁皮肤剂量影响的基础性研究却很少[12-13]。因此,本研究针对不同的补偿物厚度和使用次数对靶区、皮肤和正常组织的剂量分布的影响进行了全面和定量的评估,旨在为补偿物的规范化和个性化使用提供参考。
资料与方法1.病例选择:回顾性选取2021年4月至10月于复旦大学附属肿瘤医院接受乳腺癌改良根治术后常规放疗的共50例单侧乳腺癌患者,年龄36~87岁,平均年龄为55岁。其中,左侧乳腺癌25例,右侧乳腺癌25例。本研究经医院医学伦理审查委员会批准(审批号:2108241-22)。
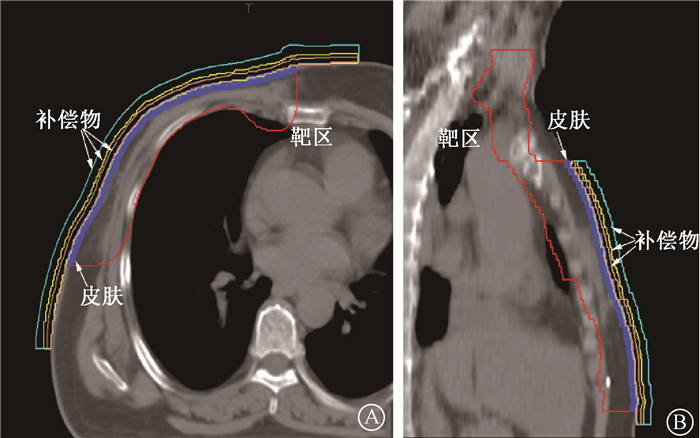
2.靶区勾画:使用荷兰Philips大孔径模拟定位机进行CT扫描,患者采取仰卧位乳腺托架固定,双臂外展上举,无热塑膜。参考图像传至Pinnacle V8.0进行轮廓勾画。临床靶区由资深内科医生依照美国乳腺与肠道外科辅助治疗研究组(NSABP) B-51/美国肿瘤放射治疗协作组织(RTOG) 1304指南进行勾画,包括胸壁、内乳淋巴结、腋窝淋巴结和锁骨上淋巴结4个部分。临床靶区外扩5 mm并去掉与心脏和肺交叠的部分得到计划靶区。胸壁靶区表浅的4 mm勾画为皮肤结构。3个不同厚度的补偿物(3、5、10 mm)交替放置覆盖整个胸壁。补偿物上界到锁骨头的下缘,下界超出靶区最下缘,左右两侧完全覆盖所有照射野的入射路径(图 1)。
|
图 1 补偿物、靶区和皮肤结构分布图 A. 横断位;B. 矢状位 Figure 1 Distributions of boluses, planning target volume and skin A. Transverse plane; B. Sagittal plane |
3.剂量要求:处方剂量为50 Gy/25次,要求覆盖不少于95%的靶区体积,靶区最大剂量(Dmax)<120%的处方剂量(60 Gy)。患侧肺内20 Gy等剂量线覆盖的体积(V20)<35%,5 Gy等剂量线覆盖的体积(V5)<70%。左患侧患者心脏平均剂量(Dmean)<8 Gy,右患侧患者心脏平均剂量(Dmean)<4 Gy。
4.计划设计:使用Monaco V5.11计划系统进行计划设计与评估。每个病例均采用8个常规切线射野加一个0°射野的方式进行照射。对于左侧靶区,8个切向射野在295°~330°和100°~155°的2个角度范围内各4野均分;对于右侧靶区,这两个角度范围为210°~ 260°和30°~ 65°,角度的选择根据靶区形状进行调整且要避免出现角度对穿的情况。照射范围包括胸壁、内乳、腋窝和锁骨上淋巴结4个靶区所在区域。每个病例的3个不同厚度补偿物(3、5、10 mm)的治疗计划(bolus plan)使用完全相同的射野角度和优化条件进行制作,归一条件为处方剂量覆盖95%的靶区体积,以探究补偿物厚度对剂量分布的影响。将上述3个治疗计划的补偿物去掉,保持子野和跳数分布情况不变,直接计算剂量结果,以模拟机器上不使用补偿物时剂量分布的情况(bolus-free plan)。将有无补偿物的治疗计划按不同次数进行组合,得到不同使用次数下的剂量分布结果。
5. 剂量比较:靶区评估参数包括V95%、Dmax、适形指数(CI)和均匀性指数(HI)。其中,CI=(PPTV·PPTV)/(VPTV·Vp); HI=D2%/D98%, PPTV和VP分别为靶区和整个身体内被处方剂量覆盖的体积, Dx%分别为覆盖x%靶区体积的剂量。皮肤的评估参数包括V105%、V110%。正常组织的评估参数包括患侧肺V5、V20和Dmean,以及心脏Dmean。其中,Vx%代表评估结构内x%的处方等剂量线覆盖的体积。
6.统计学处理:使用SPSS 19.0软件,结果采用x±s形式表示,对剂量学参数进行单因素方差分析。P < 0.05为差异有统计学意义。
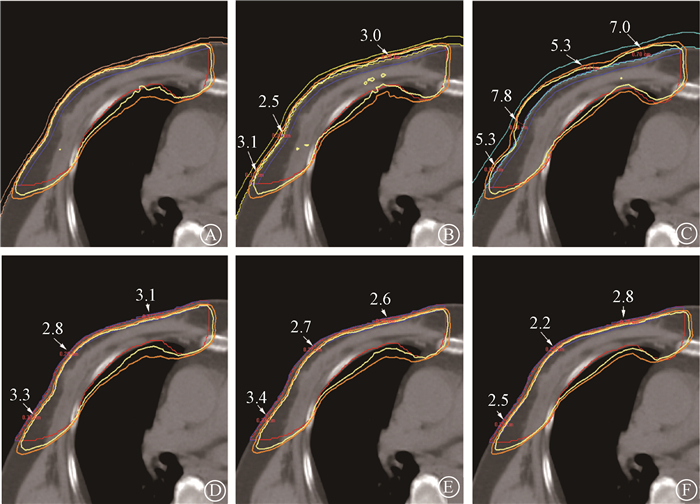
结果1. 靶区处方剂量覆盖情况:如图 2所示,全程使用3 mm补偿物的计划处方剂量完全覆盖胸壁靶区,剂量的适形性最好,使用5和10 mm补偿物计划的处方等剂量线分别溢出皮肤将近3和7 mm,未使用补偿物的计划的处方等剂量线内缩进皮下3 mm左右。
|
注:黄色.处方剂量100%等剂量线分布;橘黄色. 处方剂量95%等剂量线分布;数字代表皮肤表面到95% 处方等剂量线之间的距离,以mm为单位 图 2 乳腺癌患者胸壁靶区的处方剂量分布图 A. 全程使用3 mm补偿物;B. 全程使用5 mm补偿物;C.全程使用10 mm补偿物的计划;D. 去掉3 mm补偿物的计划;E. 去掉5 mm补偿物的计划;F.去掉10 mm补偿物的计划 Figure 2 Prescription dose distributions in chest wall target of breast cancer patients A. The plan applying 3 mm-thick boluses throughout the PM-IMRT; B. The plan applying 5 mm-thick boluses throughout the PM-IMRT; C. The plan applying 10 mm-thick boluses throughout the PM-IMRT; D. The plan removing 3 mm-thick boluses; E. The plan removing 5 mm-thick boluses; F. The plan removing 10 mm-thick boluses |
2. 不同补偿物厚度的剂量学参数对比:表 1对比了使用不同厚度补偿物的计划的各剂量学参数。靶区覆盖方面,使用10 mm补偿物的靶区V95%较使用3、5 mm低(F=3.40, P < 0.05),使用3 mm补偿物的CI最高(F=50.05,P < 0.05),3种计划的Dmax和HI值对比差异无统计学意义(P> 0.05)。皮肤高剂量体积方面,3种计划皮肤V105%和V110%对比差异无统计学意义(P>0.05)。正常组织方面,使用10 mm补偿物的患侧肺V5较使用3、5 mm略高(F=5.54,P < 0.05),但不致引起临床生物效应的改变。
|
|
表 1 使用不同厚度补偿物的乳腺癌根治术后调强放射治疗计划的剂量学参数对比(x±s) Table 1 Comparison of dosimetric parameters of PM-IMRT plans applying boluses with different thicknesses(x±s) |
3. 不同补偿物使用次数的剂量学参数变化情况:靶区V95%和皮肤V105%相对于补偿物使用次数的变化情况由表 2列出。靶区V95%和皮肤V105%均随着补偿物使用次数的减少而降低。补偿物使用次数由25次减少为20次时,靶区V95%的值变化很小(< 1%),而皮肤V105%急剧降低,它们的值降低为初始值的1/2左右。使用次数减少为15次时,靶区V95%满足临床靶区覆盖要求(V95%>95%), 皮肤V105%降低为初始值的1/4左右。可见,可以通过减少补偿物使用次数的方式降低患者的皮肤剂量。
|
|
表 2 乳腺癌根治术后调强放射治疗计划中不同厚度补偿物使用次数的剂量学参数变化情况(x±s) Table 2 Dosimetric parameters varying with different bolus thicknesses and frequencies in PM-IMRT plans(x±s) |
4. 补偿物使用15次的剂量分布:表 3列举了不同厚度补偿物使用15次的计划的剂量学参数。靶区方面,使用3 mm补偿物的靶区Dmax较使用5、10 mm低(F=9.21, P < 0.05),3种计划的V95%、CI和HI对比差异无统计学意义(P>0.05)。皮肤高剂量体积方面,3种计划皮肤V105%和V110%对比差异无统计学意义(P>0.05)。正常组织方面,使用10 mm补偿物的患侧肺V5较使用3、5 mm高(F=4.77, P < 0.05),且与表 1对比,心脏和患侧肺的剂量分布改变很小,不致引起临床生物效应的改变。
|
|
表 3 不同厚度补偿物使用15次的乳腺癌根治术后调强放射治疗计划的剂量学参数对比(x±s) Table 3 Comparison of dosimetric parameters of PM-IMRT plans applying boluses with different thicknesses at a frequency of 15(x±s) |
讨论
胸壁是乳腺癌根治术后放疗中极易复发的部位,可以通过在胸壁皮肤表面覆盖补偿物来降低复发的风险[3-4]。大量研究表明,补偿物的使用会加重患者的皮肤反应,并且关于补偿物的使用策略对皮肤剂量影响的研究却很少[9-11]。因此,本研究综合地评估了不同补偿物厚度和使用次数的剂量学影响。结果显示,在乳腺癌根治术后调强计划中,补偿物的使用次数是决定靶区覆盖和皮肤剂量的重要影响因素,补偿物的厚度对此的影响不大。另外,补偿物的厚度和使用次数对心脏和肺的剂量分布影响不大。而且,在25次的放疗进程中,补偿物需至少使用15次才可以在保证足够的临床靶区覆盖率的同时,最大限度地降低皮肤剂量。
关于临床使用的补偿物厚度,本研究表明,不同厚度的补偿物可以为胸壁表层提供相似的剂量建成效果,3 mm厚度的补偿物就能够为胸壁提供足够的处方剂量覆盖。这一结果与Kaidar-Person等[13]的文献调研结果一致,认为3~5 mm厚度的补偿物可以为胸壁表层提供可接受的剂量。另外,Das等[14]也通过在体测量在不同能量和照射方式的情况下,使用2 mm厚度的补偿物的患者的胸壁皮肤接受到的确切剂量,得到2 mm厚度的补偿物就可以为胸壁提供足够的剂量建成且不会造成严重的皮肤反应的结论。本研究为临床补偿物厚度的选择提供了数据支持,并进一步证明了3 mm厚度的补偿物对于胸壁靶区的剂量建成是足够的。
关于补偿物使用次数的分析,本研究表明,补偿物的使用次数直接决定了靶区的覆盖情况和胸壁皮肤的剂量多少,对于全程25次的乳腺癌根治术后调强计划的放疗进程,其中15次使用补偿物可以很好地平衡靶区和皮肤剂量。Andic等[15]的研究也报道了相同的结论,不过只对比了使用1 cm厚度的补偿物的三维适形放疗(3D-CRT),而且只是评估了靶区和皮肤的最大、最小和平均值。另外,15次的结论是结合靶区V95%>95%临床要求而确定的使用次数。这个次数可以根据具体的要求和具体的病例而得到调整。
本研究的局限性在于,所有的病例计划均由同一位物理师完成,这样虽然保证了比较的同一性,但是却缺少了样本的多变性,不同物理师之间经验的差别是否会对计划的结果产生影响尚不确定。本次研究只选择了处方为50 Gy/25次,能量为6 MV的光子线照射,临床适应范围较小。因此,之后的研究将放在多物理师、多医疗机构之间和不同能量,不同的处方剂量、不同照射方式的补偿物使用的数据研究。
综上所述,在乳腺癌根治术后调强计划中,不同补偿物厚度对靶区、皮肤、心脏和肺的剂量影响很小。补偿物的使用次数是决定靶区覆盖和皮肤剂量的重要因素。对于敏感皮肤患者,可以通过减少补偿物使用次数的方法来降低皮肤剂量。但是,对于全程25次的放疗进程,补偿物需要至少使用15次来保证临床可接受的靶区覆盖率。
利益冲突 所有作者宣称没有任何利益冲突,未接受任何不当职务或财务利益
作者贡献声明 杨翠负责文献阅读和论文撰写;杨昭志、胡伟刚负责课题拟定;彭佳元负责论文修改
| [1] |
Jagsi R, Raad RA, Goldberg S, et al. Locoregional recurrence rates and prognostic factors for failure in node-negative patients treated with mastectomy: implications for postmastectomy radiation[J]. Int J Radiat Oncol Biol Phys, 2005, 62(4): 1035-1039. DOI:10.1016/j.ijrobp.2004.12.014 |
| [2] |
杨继明, 程杭, 马敏, 等. 左侧乳腺癌患者根治术后常规调强计划与电子束适形联合调强计划的剂量比较[J]. 中华放射医学与防护杂志, 2022, 42(4): 262-268. Yang JM, Cheng H, Ma M, et al. Dosimetric comparison between conventional IMRT and EBCRT combined with IMRT for postmastectomy left-sided breast cancer patients[J]. Chin J Radiol Med Prot, 2022, 42(4): 262-268. DOI:10.3760/cma.j.cn112271-20211209-00477 |
| [3] |
Panoff JE, Takita C, Hurley J, et al. Higher chest wall dose results in improved locoregional outcome in patients receiving postmastectomy radiation[J]. Int J Radiat Oncol Biol Phys, 2012, 82(3): 1192-1199. DOI:10.1016/j.ijrobp.2011.02.045 |
| [4] |
Wong G, Lam E, Bosnic S, et al. Quantitative effect of bolus on skin dose in postmastectomy radiation therapy[J]. J Med Imaging Radiat Sci, 2020, 51(3): 462-469. DOI:10.1016/j.jmir.2020.06.006 |
| [5] |
Shiba S, Okamoto M, Kiyohara H, et al. Clinical advantage of chest-wall post-mastectomy radiation therapy without bolus[J]. In Vivo, 2018, 32(4): 961-965. DOI:10.21873/invivo.11335 |
| [6] |
Turner JY, Zeniou A, Williams A, et al. Technique and outcome of post-mastectomy adjuvant chest wall radiotherapy-the role of tissue-equivalent bolus in reducing risk of local recurrence[J]. Br J Radiol, 2016, 89(1064): 20160060. DOI:10.1259/bjr.20160060 |
| [7] |
Yap ML, Tieu M, Sappiatzer J, et al. Outcomes in patients treated with post-mastectomy chest wall radiotherapy without the routine use of bolus[J]. Clin Oncol (R Coll Radiol), 2018, 30(7): 427-432. DOI:10.1016/j.clon.2018.03.005 |
| [8] |
Nuzzo M, Ursini LA, Patani F, et al. Using the bolus in post-mastectomy radiation therapy (PMRT): a national survey on behalf of the Italian Association of Radiotherapy and Clinical Oncology (AIRO) breast cancer group[J]. Anticancer Res, 2020, 40(11): 6505-6511. DOI:10.21873/anticanres.14673 |
| [9] |
Nakamura N, Arahira S, Zenda S, et al. Post-mastectomy radiation therapy without usage of a bolus may be a reasonable option[J]. J Radiat Res, 2017, 58(1): 66-70. DOI:10.1093/jrr/rrw055 |
| [10] |
Parekh A, Dholakia AD, Zabranksy DJ, et al. Predictors of radiation-induced acute skin toxicity in breast cancer at a single institution: role of fractionation and treatment volume[J]. Adv Radiat Oncol, 2018, 3(1): 8-15. DOI:10.1016/j.adro.2017.10.007 |
| [11] |
Drost L, Li N, Vesprini D, et al. Prospective study of breast radiation dermatitis[J]. Clin Breast Cancer, 2018, 18(5): e789-e795. DOI:10.1016/j.clbc.2018.03.008 |
| [12] |
Dahn HM, Boersma LJ, de Ruysscher D, et al. The use of bolus in postmastectomy radiation therapy for breast cancer: a systematic review[J]. Crit Rev Oncol Hematol, 2021, 163: 103391. DOI:10.1016/j.critrevonc.2021.103391 |
| [13] |
Kaidar-Person O, Dahn HM, Nichol AM, et al. A delphi study and international consensus recommendations: the use of bolus in the setting of postmastectomy radiation therapy for early breast cancer[J]. Radiother Oncol, 2021, 164: 115-121. DOI:10.1016/j.radonc.2021.09.012 |
| [14] |
Das LC, Golden DW, Perevalova E, et al. A feasibility study of 2 mm bolus for postmastectomy radiation therapy[J]. Pract Radiat Oncol, 2017, 7(3): 161-166. DOI:10.1016/j.prro.2016.10.015 |
| [15] |
Andic F, Ors Y, Davutoglu R, et al. Evaluation of skin dose associated with different frequencies of bolus applications in post-mastectomy three-dimensional conformal radiotherapy[J]. J Exp Clin Cancer Res, 2009, 28: 41. DOI:10.1186/1756-9966-28-41 |
 2023, Vol. 43
2023, Vol. 43


