放射治疗是肿瘤治疗中的重要手段之一[1-2]。皮肤属于中度辐射敏感组织,易受电离辐射的损害,电离辐射使细胞产生大量的活性氧自由基、损伤蛋白质、脂质和核酸等生物大分子,引起炎症反应,抑制基底细胞的分裂分化,破坏基底细胞及新生血管,细胞功能紊乱甚至凋亡,导致皮肤损伤[3-5]。严重者不仅给其带来额外的痛苦,还可能推迟放疗进程,影响患者的肿瘤治疗效果。尽管目前临床上采用含硫化合物、激素类、细胞因子类和中草药等可预防和治疗放射性皮肤损伤[5-6],但获益受限。由于缺乏有效的防治手段,以及对放射性皮肤损伤的机制并不明确,放射性皮肤损伤仍是临床上亟待解决的重要问题。脂肪酸结合蛋白5(fatty acid-binding protein 5,FABP5)是脂肪酸结合蛋白家族成员之一,是具有参与脂肪酸运输代谢、细胞内信号转导、调控细胞因子产生、细胞分化等多种作用的脂质载体[7]。前期研究已证实在辐射诱导的皮肤损伤中FABP5表达水平增加[8]。本研究通过构建下调FABP5的HaCaT细胞,旨在观察其对皮肤放射损伤的影响,探索其可能存在的机制。
材料与方法1. 实验材料:人永生化角质形成细胞株HaCaT购自国家生物医学实验细胞资源库;胎牛血清、MEM培养基、磷酸盐缓冲液(PBS)、胰酶购自美国GIBCO公司;RNAiso、反转录试剂盒、实时荧光定量聚合酶链式反应(qPCR)试剂盒(日本TaKaRa公司);聚腺苷二磷酸核糖聚合酶(PARP)、γ-H2AX、脂肪酸结合蛋白5(FABP5)、蛋白激酶B(AKT)、磷酸化-蛋白激酶B(p-AKT)抗体(美国CST公司);CCK-8试剂盒(美国APExBIO公司);流式凋亡试剂盒(南京凯基生物公司);聚偏氟乙烯(PVDF)膜购于美国Millipore公司;结晶紫染料、二喹啉甲酸(BCA)蛋白浓度测定试剂盒、RIPA裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液(5×)、SDS-PAGE凝胶超快速配制试剂盒、一抗稀释液、二抗稀释液均购自上海碧云天公司;GAPDH Mouse mAb、辣根过氧化物酶标记山羊抗兔二抗、辣根过氧化物酶标记山羊抗鼠二抗购于北京锐抗公司,超敏发光液购于美国Advansta公司。
2. 细胞培养和照射条件:采用含10%胎牛血清的MEM培养基在37℃,5%CO2恒温培养箱培养HaCaT细胞,细胞贴壁生长,每2~3天传代1次。将细胞分为空白对照组、下调FABP5组、单纯照射组和下调FABP5+照射组。使用直线加速器(LINAC 2300EX, ,美国Varian公司)6 MV X射线照射,照射野20 cm×20 cm,吸收剂量率5 Gy/min,源靶距100 cm,细胞培养瓶或细胞培养板置于1 cm的组织补充物之下,机架角度0°进行照射。
3.构建FABP5稳定下调细胞系:分别用购于上海汉恒公司的空载病毒载体和下调FABP5的病毒载体转染HaCaT细胞。取对数生长期的HaCaT细胞(细胞数约为3×104)接种于24孔板中,待细胞融合度约达30%。根据病毒转染感染复数(MOI)值为10,将适量的病毒(滴度为108 TU/ml) 以及聚凝胶浓度为5 μg/ml加入无血清的培养基中,对HaCaT细胞进行转染,转染24 h后用3 μg/ml嘌呤霉素筛选。将嘌呤霉素筛选后的HaCaT细胞按有限稀释法接种于96孔板,显微镜下观察,标记出单细胞培养孔,继续培养3周,挑取单克隆扩增。
4. qPCR检测和Western blot法检验FABP5下调效率:收集慢病毒转染后的细胞,采用RNAiso提取细胞RNA,使用超微量核酸测定仪测定RNA浓度和纯度,将其反转录为cDNA,按照说明书使用实时荧光定量PCR仪检验FABP5敲除效率,内参引物和目的引物合成均由上海生工公司提供。提取下调FABP5细胞的蛋白用Western blot法检验FABP5敲除蛋白表达效率。
5. CCK-8测定细胞增殖活力:取对数生长期的4组细胞(8×103)接种于96孔板中。培养24 h后,将各组细胞分别给予0和8 Gy的X射线照射。分别在受照后0、24、48和72 h,每孔加入10 μl CCK-8溶液,避光孵育2 h后,用酶标仪检测450 nm处的吸光度(A)值,经空白孔调零后,分析细胞存活率变化。细胞存活率(%)= [(实验孔-空白孔)/(对照孔-空白孔)]×100%
6. 划痕实验检测细胞迁移能力:用直尺在6孔板背面标记3条平行线,取对数生长期的各组细胞(60×104)接种于6孔板,培养至融合度95%以上。用1 ml移液枪吸头于细胞表面垂直于先前的平行线划线,构成3个交叉点,换液,加入无血清培养基,在0和8 Gy照射后0、24和48 h,观察每一个交叉点处的细胞迁移情况。Leica倒置显微镜(50 ×视野)采集图片,用Image J软件计算不同时间点的划痕处面积,得到细胞迁移率。迁移率(%)=(0 h的面积-照射后不同时间点的面积)/0 h的面积× 100%。
7. 流式细胞术测定细胞凋亡:采集各组细胞,用PBS洗涤细胞2次,加入500 μl结合缓冲液(binding buffer)重悬细胞,加入5 μl Annexin V-APC和5 μl 7-AAD染液混匀,室温、避光反应5~15 min,用流式细胞仪分析细胞凋亡变化。
8. 克隆形成实验:将处于对数生长期的各组细胞分别以200、400、800、1 600、3 200/孔接种于6孔板,24 h后相应照射0、2、4、6和8 Gy,继续培养14 d,形成肉眼可见的克隆。甲醇固定,0.5%结晶紫染色,镜下观察计数每孔内克隆数(克隆﹥50个细胞数,则计数1个克隆)。用GraphPad Prism 9 Demo拟合存活曲线,根据单击多靶模型参数值(D0、Dq、N、SF2、k)计算放射增敏比(SER)。克隆形成率(PE)=(克隆形成数目/接种细胞数目)×100%;细胞存活分数(SF)=照射细胞克隆数目/(接种细胞数目×未照射细胞克隆形成率)。
9. Western blot检测细胞PARP1、γ-H2AX、AKT、p-AKT的表达水平:将各组细胞根据分组进行0和8 Gy照射后,在不同时间点提取蛋白,用BCA试剂盒进行蛋白浓度定量,按照1∶4的体积比添加5×上样缓冲液,离心半径为7.5 cm,12 000 r/min,离心15 min后混匀,100℃变性5 min。取30 μg蛋白,分别于8%和15%的SDS-PAGE凝胶中进行电泳分离,并将蛋白转移到PVDF膜上。用5%的脱脂牛奶室温封闭2~3 h后按说明书比例稀释对应的一抗,4℃孵育过夜,加入按比例稀释的二抗,室温孵育1 h,最后用化学发光法(ECL)进行曝光。用Image J软件分析条带灰度,内参为GAPDH,分析各蛋白的相对表达量。
10.统计学处理:采用SPSS 26.0软件进行统计学分析,数据符合正态分布,用x±s表示。组间比较使用两独立样本t检验。P<0.05为差异具有统计学意义。
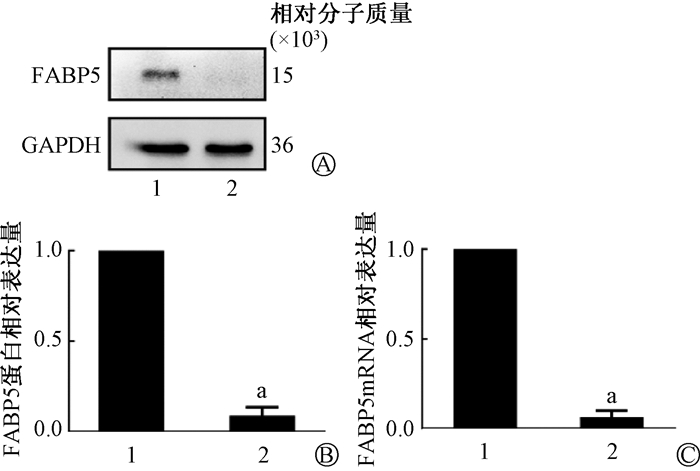
结果1. 成功构建FABP5稳定敲低细胞系:细胞均成功转染。从RNA水平(0.06±0.06,t=25.14,P<0.05)和蛋白水平(0.09±0.08,t=20.06,P<0.05)进一步验证了FABP5的表达水平(图 1),成功构建了下调FABP5的皮肤HaCaT细胞系。
|
注:1.空白对照组;2.下调FABP5组;a与空白对照组相比,t=20.06、25.14,P<0.05 图 1 蛋白及RNA水平验证FABP5的转染效率 A.电泳图;B.蛋白相对表达量;C.mRNA相对表达水平 Figure 1 Protein and RNA levels verified transfection efficiency of FABP5 A.Electrophoretogram; B.Relative expression level of protein; C.Relative expression level of mRNA |
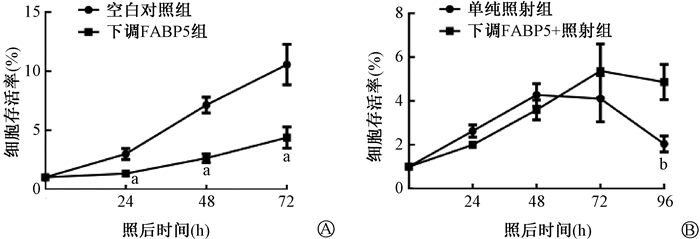
2. 下调FABP5抑制皮肤细胞增殖:结果示于图 2。未照射时,下调FABP5组的增殖速度显著降低,差异具有统计学意义(t=3.55、5.88、3.18,P < 0.05)。下调FABP5+照射组在8 Gy照射后48 h内细胞增殖速度显著增加,但24~72 h与单纯照射组差异无统计学意义(P>0.05),该结果提示照后72 h内,X射线对下调FABP5的增殖无明显影响,在96 h两者差异具有统计学意义(t=-3.19,P<0.05)。
|
注:a与空白对照组相比,t=3.55、5.88、3.18,P<0.05;b与单纯照射组相比,t=-3.19,P<0.05 图 2 下调FABP5对皮肤细胞增殖的影响 A. 0 Gy;B. 8 Gy Figure 2 Effect of FABP5 down-regulation on skin cell proliferation A. 0 Gy; B. 8 Gy |
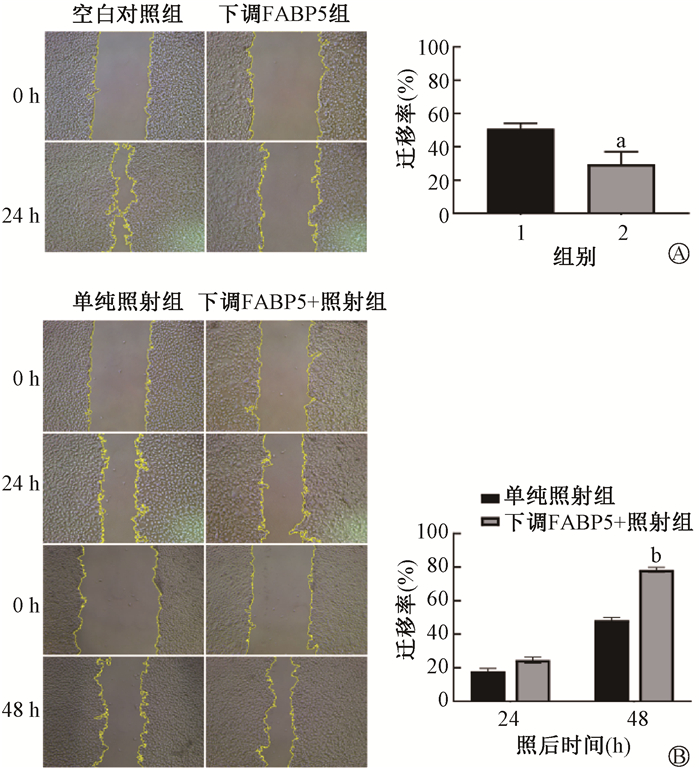
3. 下调FABP5抑制皮肤细胞迁移:结果示于图 3。未照射时,下调FABP5组在24 h的迁移率显著低于空白对照组(t=15.44,P<0.05),提示下调FABP5抑制皮肤细胞的迁移;而经过8 Gy照射后,下调FABP5 + 照射组的细胞48 h的迁移率高于单纯照射组(t=-24.28,P<0.05),提示下调FABP5能降低X射线对细胞迁移的影响,提高辐射抗性。
|
注:1. 空白对照组;2.下调FABP5组;a与空白对照组相比,t=15.44,P<0.05;b与单纯对照组相比,t=-24.28,P<0.05 图 3 下调FABP5对皮肤细胞迁移的影响×50 A.0 Gy;B.8 Gy Figure 3 Effect of FABP5 down-regulation on skin cell migration ×50 A. 0 Gy; B.8 Gy |
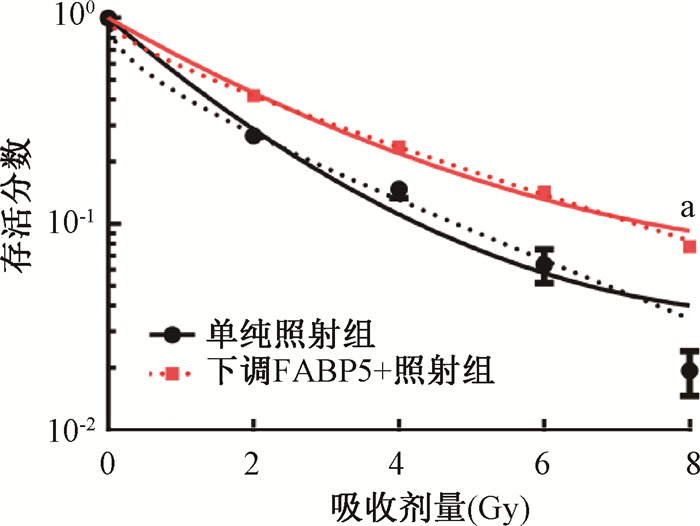
4. 下调FABP5降低皮肤细胞的放射敏感性:下调FABP5+照射组和单纯照射组的细胞存活分数均随着照射剂量的增加而下降(图 4),下调FABP5+照射组的下降程度较单纯照射组有明显减小(t=4.55,P<0.05)。根据单击多靶模型计算,下调FABP5对皮肤细胞的SER为0.782。
|
注:a与单纯照射组相比,t=4.55,P<0.05 图 4 下调FABP5后受照皮肤细胞存活曲线 Figure 4 Effect of FABP5 down-regulation on cell survival after irradiation |
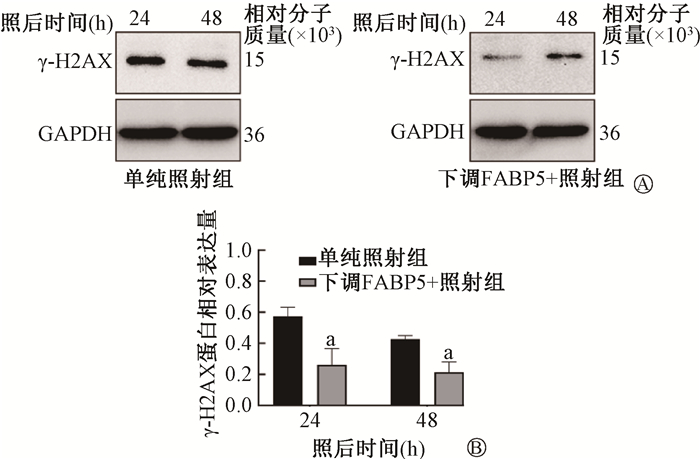
5. 下调FABP5联合照射降低皮肤细胞γ-H2AX蛋白表达:8 Gy照射后24和48 h,下调FABP5+照射组的γ-H2AX蛋白表达水平分别为0.26±0.11和0.22±0.07,明显低于单纯照射组的0.57±0.06和0.43±0.02(t=4.50、5.33,P<0.05),见图 5。
|
注:a与单纯照射组相比,t=4.50、5.33,P<0.05 图 5 下调FABP5联合8 Gy X射线照射后皮肤细胞γ-H2AX蛋白表达水平变化 A.电泳图;B.相对表达量 Figure 5 Changes of protein expression of γ-H2AX in skin cells after FABP5 down-regulation and 8 Gy irradiation A. Electrophoretogram; B. Relative expression level |
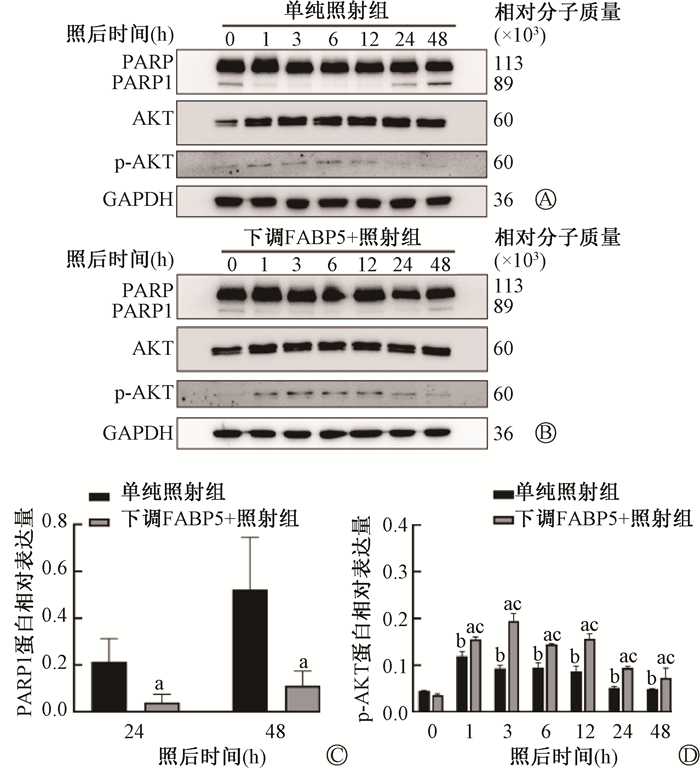
6. 下调FABP5联合照射对皮肤细胞的凋亡和PARP1、p-AKT蛋白表达水平的影响:未照射时,下调FABP5组与空白对照组的差异无统计学意义(P>0.05),8 Gy照射后,下调FABP5+照射组的凋亡率明显低于单纯照射组[(9.82±1.45)% vs.(22.05±6.71)%,t=3.08,P<0.05,图 6]。照射后24和48 h,下调FABP5+照射组的凋亡蛋白水平分别为0.04±0.04和0.11±0.06,明显低于单纯照射组的0.21±0.10和0.52±0.22(t=2.83、3.07,P<0.05),说明下调FABP5能抑制照射对皮肤细胞的凋亡。照射后的两组细胞p-AKT蛋白水平均升高(t=-65.66~-2.98,P<0.05),且下调FABP5+照射组的p-AKT蛋白水平高于单纯照射组(t=-16.24~3.02,P<0.05),见图 7。

|
图 6 下调FABP5和8 Gy X射线对皮肤细胞凋亡的影响 A.空白对照组;B.单纯照射组;C.下调FABP5组;D.下调FABP5+照射组 Figure 6 Effects of FABP5 down-regulation and 8 Gy irradiation on apoptosis induction of skin cells A. Blank control group; B. IR group; C. FABP5 down-regulation group; D. FABP5+IR group |
|
注:a与单纯照射组相比,t=2.83、3.07、-5.29、-9.71、-7.60、-7.91、-16.24、3.02,P<0.05;b与单纯照射组0 h相比,t=-12.03、-12.11、-7.51、-6.46、-3.91、-4.50,P<0.05;c与下调FABP5+ 照射组0 h相比,t=-34.38、-16.16、-65.66、-19.36、-26.26、-2.98,P<0.05 图 7 下调FABP5和8 Gy X射线照射后皮肤细胞PARP1、p-AKT蛋白表达水平变化 A.单纯照射组电泳图;B.下调FABP5+照射组电泳图;C. PARP1相对表达量;D. p-AKT相对表达量 Figure 7 Effects of FABP5 down-regulation and 8 Gy irradiation on the protein expressions of PARP1 and p-AKT in skin cells A. Electrophoretogram of IR group; B. Electrophoretogram of FABP5+IR group; C. Relative expression level of PARP1; D. Relative expression level of p-AKT |
讨论
放射性皮肤损伤是放疗中常见的并发症。在接受放疗的肿瘤患者中超过90%会发生皮肤放射损伤[9],通常在照射后数小时至数周内出现急性早期损伤,包括皮肤红斑、水肿、脱屑、瘙痒、脱屑、溃疡[5, 10];晚期损伤是在治疗结束后6个月至数年后,包括萎缩、纤维化、毛细血管扩张和色素异常沉着[10-11]。临床上通常采用放射防护剂如半渗透辅料、含硫化合物、激素类、细胞因子类和中草药如姜黄素、Zoi等[12]预防和治疗放射性皮肤损伤[6],但其治疗效果不佳,患者获益有限[13],因此探究放射性皮肤损伤的机制并为临床提供新的治疗思路已成为一个亟需解决的问题。
FABPs是相对分子质量为(14~15)×103的蛋白质,具有参与脂肪酸运输代谢、细胞内信号转导、调控细胞因子产生、细胞分化等多种作用[7]。近来许多研究发现FABP5在多种肿瘤细胞中呈高表达[14],且促进肿瘤细胞增殖[15],如皮肤黑色素瘤[16]、肝细胞癌[17]、肾透明细胞癌[18]等。Guo等[19]指出过表达FABP5可影响人皮肤角质形成细胞的增殖,但其在皮肤辐射损伤的作用尚未明确,值得进一步研究。
前期研究已经明确在辐射诱导的皮肤损伤组织中FABP5为高表达[8]。因此,本实验构建下调FABP5的人永生化角质形成细胞株,CCK-8实验和划痕实验结果发现,未照射时下调FABP5可明显抑制皮肤细胞增殖及迁移。这与Zhao等[20]的研究发现下调FABP5基因能抑制人SGC-7901胃癌细胞的增殖是相同的。而经8 Gy照射后,下调FABP5+照射组在照后96 h细胞增殖活力及照后48 h的细胞迁移率均高于单纯照射组。这提示下调FABP5能够降低辐射对皮肤细胞的增殖和迁移的影响,据此推测下调FABP5能够减轻皮肤的放射损伤。为进一步明确下调FABP5能否影响皮肤细胞放射敏感性,进行克隆形成实验,结果显示,下调FABP5+照射组的细胞存活率显著高于单纯照射组,提示下调FABP5可增强皮肤细胞的放射抵抗性,从而对受照皮肤起保护作用。细胞凋亡和DNA损伤是辐射损伤的重要因素之一,而下调FABP5能够提高皮肤细胞放射抵抗,是否与此相关,本文就此做了进一步探讨。
细胞凋亡和DNA损伤是放射造成皮肤损伤的重要原因之一[4]。辐射后细胞凋亡和DNA损伤修复与细胞放射敏感性有密切关系[21-22]。PARP是DNA修复酶,PARP剪切被认为是细胞凋亡的一个重要指标[23];γ-H2AX蛋白被证明是DNA损伤的指标[24]。本研究通过Western blot法检测PARP1和γ-H2AX蛋白表达情况,结果显示,辐射后24和48 h下调FABP5组的PARP1蛋白均明显低于单纯照射组,该结果与流式结果相符;辐射后24和48 h下调FABP5组的γ-H2AX蛋白也低于单纯照射组。由此可知,经照射后,下调FABP5+照射组的PARP1、γ-H2AX均明显低于单纯照射组。据此推测下调FABP5能够提高皮肤细胞放射抵抗,与细胞凋亡、DNA损伤有着密切关系。
有研究表明,PI3K/AKT信号通路与调控细胞增殖、凋亡、肿瘤细胞放射敏感性有着密切关系[25],AKT通路上调可减少辐射引起的细胞凋亡并诱导细胞再增殖,增加肿瘤放射抵抗性[26]。本研究发现辐射可引起p-AKT的蛋白表达升高,且下调FABP5组的p-AKT蛋白表达水平较对照组有所升高,下调FABP5可能激活PI3K/AKT信号通路,减少了辐射引起的皮肤细胞凋亡和DNA损伤,增加皮肤细胞的放射抵抗性,从而对皮肤辐射损伤起保护作用。本研究为体外实验,FABP5的体内研究将是课题组未来的研究方向。
综上所述,本研究初步发现下调FABP5是通过激活PI3K/AKT信号通路以减轻放射性皮肤损伤,从而起到保护皮肤细胞的作用,为研发治疗和预防皮肤辐射损伤药物提供了新的思路。
利益冲突 无
作者贡献声明 管鸿丹负责实验操作和论文撰写;郑榕、官秉洁负责研究过程指导和数据分析;林玉萍、王弼思协助实验完成;徐本华负责提出修改意见;宋建元指导实验设计和论文修改
| [1] |
Miller KD, Nogueira L, Mariotto AB, et al. Cancer treatment and survivorship statistics, 2019[J]. CA Cancer J Clin, 2019, 69(5): 363-385. DOI:10.3322/caac.21565 |
| [2] |
De Ruysscher D, Niedermann G, Burnet NG, et al. Radiotherapy toxicity[J]. Nat Rev Dis Primers, 2019, 5(1): 13. DOI:10.1038/s41572-019-0064-5 |
| [3] |
Ryan JL. Ionizing radiation: the good, the bad, and the ugly[J]. J Invest Dermatol, 2012, 132(3 Pt 2): 985-993. DOI:10.1038/jid.2011.411 |
| [4] |
Radvansky LJ, Pace MB, Siddiqui A. Prevention and management of radiation-induced dermatitis, mucositis, and xerostomia[J]. Am J Health Syst Pharm, 2013, 70(12): 1025-1032. DOI:10.2146/ajhp120467 |
| [5] |
Singh M, Alavi A, Wong R, et al. Radiodermatitis: a review of our current understanding[J]. Am J Clin Dermatol, 2016, 17(3): 277-292. DOI:10.1007/s40257-016-0186-4 |
| [6] |
Gosselin T, Ginex PK, Backler C, et al. ONS Guidelines for cancer treatment-related radiodermatitis[J]. Oncol Nurs Forum, 2020, 47(6): 654-670. DOI:10.1188/20.ONF.654-670 |
| [7] |
Dallaglio K, Marconi A, Truzzi F, et al. E-FABP induces differentiation in normal human keratinocytes and modulates the differentiation process in psoriatic keratinocytes in vitro[J]. Exp Dermatol, 2013, 22(4): 255-261. DOI:10.1111/exd.12111 |
| [8] |
Song J, Zhang H, Wang Z, et al. The role of FABP5 in radiation-induced human skin fibrosis[J]. Radiat Res, 2018, 189(2): 177-186. DOI:10.1667/RR14901.1 |
| [9] |
Borrelli MR, Patel RA, Sokol J, et al. Fat chance: the rejuvenation of irradiated skin[J]. Plast Reconstr Surg Glob Open, 2019, 7(2): e2092. DOI:10.1097/GOX.0000000000002092 |
| [10] |
Fallah M, Viklund E, Bäckman A, et al. Plasminogen is a master regulator and a potential drug candidate for the healing of radiation wounds[J]. Cell Death Dis, 2020, 11(3): 201. DOI:10.1038/s41419-020-2397-0 |
| [11] |
Kole AJ, Kole L, Moran MS. Acute radiation dermatitis in breast cancer patients: challenges and solutions[J]. Breast Cancer (Dove Med Press), 2017, 9: 313-323. DOI:10.2147/BCTT.S109763 |
| [12] |
Zoi V, Galani V, Tsekeris P, et al. Radiosensitization and radioprotection by curcumin in glioblastoma and other cancers[J]. Biomedicines, 2022, 10(2): 312. DOI:10.3390/biomedicines10020312 |
| [13] |
Kim JH, Kolozsvary AJ, Jenrow KA, et al. Mechanisms of radiation-induced skin injury and implications for future clinical trials[J]. Int J Radiat Biol, 2013, 89(5): 311-318. DOI:10.3109/09553002.2013.765055 |
| [14] |
Alshalalfa M, Bismar TA, Alhajj R. Detecting cancer outlier genes with potential rearrangement using gene expression data and biological networks[J]. Adv Bioinformatics, 2012, 2012: 373506. DOI:10.1155/2012/373506 |
| [15] |
Levi L, Lobo G, Doud MK, et al. Genetic ablation of the fatty acid-binding protein FABP5 suppresses HER2-induced mammary tumorigenesis[J]. Cancer Res, 2013, 73(15): 4770-4780. DOI:10.1158/0008-5472.CAN-13-0384 |
| [16] |
Yan G, Li L, Zhu S, et al. Single-cell transcriptomic analysis reveals the critical molecular pattern of UV-induced cutaneous squamous cell carcinoma[J]. Cell Death Dis, 2021, 13(1): 23. DOI:10.1038/s41419-021-04477-y |
| [17] |
Seo J, Jeong DW, Park JW, et al. Fatty-acid-induced FABP5/HIF-1 reprograms lipid metabolism and enhances the proliferation of liver cancer cells[J]. Commun Biol, 2020, 3(1): 638. DOI:10.1038/s42003-020-01367-5 |
| [18] |
Lv Q, Wang G, Zhang Y, et al. FABP5 regulates the proliferation of clear cell renal cell carcinoma cells via the PI3K/AKT signaling pathway[J]. Int J Oncol, 2019, 54(4): 1221-1232. DOI:10.3892/ijo.2019.4721 |
| [19] |
Guo Z, Hu Q, Tian J, et al. Proteomic profiling reveals candidate markers for arsenic-induced skin keratosis[J]. Environ Pollut, 2016, 218: 34-38. DOI:10.1016/j.envpol.2016.08.035 |
| [20] |
Zhao G, Wu M, Wang X, et al. Effect of FABP5 gene silencing on the proliferation, apoptosis and invasion of human gastric SGC-7901 cancer cells[J]. Oncol Lett, 2017, 14(4): 4772-4778. DOI:10.3892/ol.2017.6748 |
| [21] |
Yang J, Yu F, Guan J, et al. Knockdown of RNF2 enhances the radiosensitivity of squamous cell carcinoma in lung[J]. Biochem Cell Biol, 2019, 97(5): 589-599. DOI:10.1139/bcb-2018-0252 |
| [22] |
Liu HM, Wu Q, Cao JQ, et al. A phenanthroline derivative enhances radiosensitivity of hepatocellular carcinoma cells by inducing mitochondria-dependent apoptosis[J]. Eur J Pharmacol, 2019, 843: 285-291. DOI:10.1016/j.ejphar.2018.10.031 |
| [23] |
Meza-Sosa KF, Miao R, Navarro F, et al. SPARCLE, a p53-induced lncRNA, controls apoptosis after genotoxic stress by promoting PARP-1 cleavage[J]. Mol Cell, 2022, 82(4): 785-802. DOI:10.1016/j.molcel.2022.01.001 |
| [24] |
Lowndes NF, Toh GW. DNA repair: the importance of phosphorylating histone H2AX[J]. Curr Biol, 2005, 15(3): R99-R102. DOI:10.1016/j.cub.2005.01.029 |
| [25] |
Pan S, Sun Y, Sui D, et al. Lobaplatin promotes radiosensitivity, induces apoptosis, attenuates cancer stemness and inhibits proliferation through PI3K/AKT pathway in esophageal squamous cell carcinoma[J]. Biomed Pharmacother, 2018, 102: 567-574. DOI:10.1016/j.biopha.2018.03.109 |
| [26] |
Ettl T, Viale-Bouroncle S, Hautmann MG, et al. AKT and MET signalling mediates antiapoptotic radioresistance in head neck cancer cell lines[J]. Oral Oncol, 2015, 51(2): 158-163. DOI:10.1016/j.oraloncology.2014.11.005 |
 2023, Vol. 43
2023, Vol. 43


