2. 国家卫生健康委员会核技术医学转化重点实验室 绵阳市中心医院, 绵阳 621099
2. NHC Key Laboratory of Nuclear Technology Medical Transformation, Mianyang Central Hospital, Mianyang 621099, China
近年来,皮肤肿瘤的发病率呈逐步上升态势;皮肤黑色素瘤患者约占新发皮肤肿瘤的20%[1]。放射治疗对于皮肤基底细胞癌等皮肤肿瘤具有较好疗效,但皮肤黑色素瘤细胞普遍存在放射抵抗,放疗效果不甚理想[2-3]。因此,亟需探索皮肤黑色素瘤的放射增敏新策略,以提高其疗效。
干扰素激活基因刺激物(stimulator of interferon gene,STING)是一个位于内质网上相对分子质量为37×103的跨膜蛋白,可结合由病原体外源DNA诱导生成的环二核苷酸,激活下游的干扰素调节因子3(IRF3)等,促进干扰素转录[4]。研究表明,在多种肿瘤组织中存在STING的基因突变、空间构象改变以及表达量下降等特征[5-6]。即在肿瘤细胞中存在STING抑制的情况,提示活化STING可能是一种抑制肿瘤增殖和肿瘤放射增敏的策略。
研究表明,STING激动剂cGAMP、AUS-100和diABZI等具有抗肿瘤活性[7-9],其中diABZI已被证实可通过抑制DNA损伤修复促进对非小细胞肺癌的放射增敏[10]。但STING激动剂能否增加皮肤黑色素瘤的放射敏感性目前尚未见文献报道。基于已有的研究,本实验选用STING激动剂环二腺苷酸(c-di-AMP)探究激活STING对皮肤黑色素瘤细胞放射敏感性的影响。
材料与方法1. 实验试剂:DMEM培养基、胎牛血清、胰酶和青霉素-链霉素双抗溶液均购自美国VivoCell公司,c-di-AMP(HY-12326A)购自美国MCE公司,二甲基亚砜(DMSO)购于北京索莱宝公司,CCK-8试剂盒、乳酸脱氢酶(LDH)检测试剂盒和辣根过氧化物酶(HRP)标记山羊抗兔IgG购自上海碧云天公司,Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海翌圣公司,GAPDH、Caspase-3、剪切体Caspase-3、PARP、MLKL和磷酸化MLKL抗体购自美国Cell Signaling公司,FACL4、GPX4、STING、IRF3、磷酸化IRF3、TBK1和磷酸化TBK1抗体购自英国Abcam公司。
2. 细胞培养和照射条件:人皮肤黑色素瘤A375细胞购自武汉普诺赛公司,并由本实验室保存。采用含10%胎牛血清的DMEM培养基(含青霉素100 U/ml和链霉素100 μg/ml)在37℃、含5%CO2饱和湿度的培养箱中培养。本实验将细胞分为空白对照组、c-di-AMP组、X射线照射组、照射+c-di-AMP组。采用KUBTEC XCELL320生物辐照仪(美国KUBTEC公司)对A375细胞进行X射线照射,源靶距为50 cm,吸收剂量率为1.50 Gy/min。
3. 细胞存活检测:选择对数生长期的A375细胞,调整其浓度为5×104/ml,以100 μl/孔接种于96孔板中,每组设6平行复孔,分别给予0、5、10和15 Gy X射线照射,于照射后24和48 h进行检测。另在照射前12 h加入不同浓度的c-di-AMP(1、2、5、10和20 μmol/L),经10 Gy的X射线处理后48 h进行检测。按照CCK-8试剂盒说明书操作,全波长酶标仪测定各孔450 nm波长下吸光度(A)值,计算细胞存活率。细胞存活率(%)= (实验孔吸光度A-空白孔吸光度A)/(空白对照组吸光度A-空白孔吸光度A)×100%。
4. LDH释放检测:选择对数生长期的A375细胞,调整其浓度为1×105/ml,以100 μl/孔接种于96孔板中,每组设4个平行复孔,分别给予0、5、10或15 Gy X射线照射,照射后立即更换培养基为无血清培养基,于照射后24、48 h进行检测。或在照射前12 h加入不同浓度的c-di-AMP(1、2、5、10和20 μmol/L),经10 Gy的X射线照射处理,照射后立即更换培养基为无血清培养基,处理48 h后进行检测。按照LDH释放检测试剂盒说明书操作,全波长酶标仪测定各孔490 nm波长下吸光度(A)值。LDH释放率(%)=(实验孔吸光度A-空白孔吸光度A)/(最大酶活性孔吸光度A-空白孔吸光度A)×100%。
5. 细胞凋亡水平检测:选择对数生长期的A375细胞,调整其浓度为1×105/ml,以1 ml/孔接种于12孔板中,然后将培养板置于培养箱中孵育24 h后弃原液,分别加入含0和10 μmol/L c-di-AMP的培养基(每组设置3个平行孔),并在经0或10 Gy的X射线照射后48 h弃去原培养基,并用胰酶进行消化,在4℃、800×g的条件下离心3 min后,使用Annexin V-FITC/PE试剂盒对细胞进行染色,并使用流式细胞仪通过PE和FITC通道检测细胞凋亡水平。使用FlowJo软件对数据进行分析并统计FITC+/PE-(早期凋亡细胞)和FITC+/PE+(晚期凋亡细胞)细胞比例。
6. 平板克隆存活实验:选择对数生长期的A375细胞。调整细胞为合适的浓度并接种于6孔板中(0、2、4、6和8 Gy对应细胞数分别为400、400、800、2 000和4 000/孔),然后将培养板置于培养箱中。孵育24 h后去掉原培养液,并分别加入含有0和10 μmol/L c-di-AMP的培养基,每组设置3个复孔,培养24 h后分别给予0、2、4、6、8 Gy的X射线照射,继续培养14 d。每2~3天换液,直至在培养板中出现肉眼可见细胞克隆,终止培养,使用4%多聚甲醛固定细胞15 min,结晶紫染色30 min后洗去染色液,计数≥ 50个细胞的克隆数。使用Graphpad Prism 8.0软件,并依据单击多靶模型对实验数据进行拟合分析,拟合公式为存活分数SF=1-(1- e-kD)N。并依据该公式计算平均致死量D0(D0=1/k)、准阈剂量Dq(Dq=lnN×D0),以及放射增敏比SER(SER=X射线照射组D0/c-di-AMP组D0)。
7. Western blot检测:提取处理后的各组蛋白,于12%的十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)中进行分离,并将蛋白转移到聚偏氟乙烯(PVDF)膜上,用5%的脱脂奶粉室温封闭2 h后加入按说明书比例稀释的一抗,4℃孵育过夜。用3-羟甲基-氨基甲烷-盐酸缓冲盐溶液(TBST)洗膜3次,加入按比例稀释的HRP标记的二抗溶液,室温孵育2 h后用TBST洗膜3次。最后用电化学发光(ECL)试剂盒在暗室曝光,以GAPDH为内参,采用Image J软件分析目的蛋白表达水平。
8. 统计学处理:采用SPSS 24.0软件进行统计学分析。数据符合正态分布,以x±s表示。两组间比较采用独立样本t检验。P < 0.05为差异具有统计学意义。
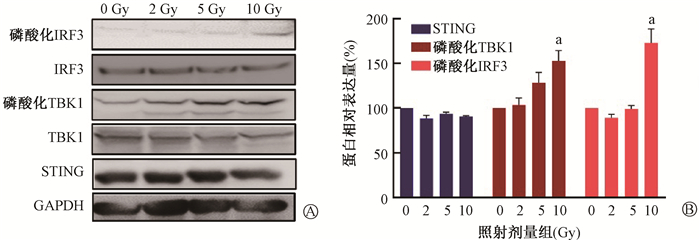
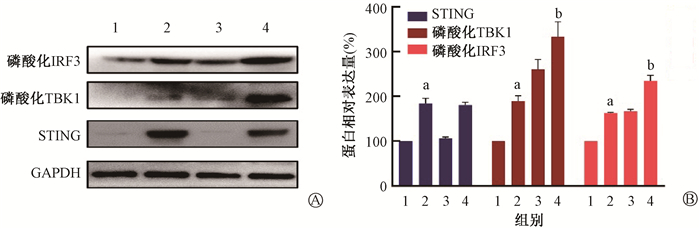
结果1. 电离辐射与c-di-AMP对皮肤黑色素瘤细胞内STING及其下游通路的影响:与空白对照组相比,10 Gy X射线照射后48 h,可在一定程度上激活A375细胞内的STING-TBK1-IRF3信号通路,差异具有统计学意义(t=5.67、6.85,P < 0.05),而STING表达量未见明显差异(图 1)。而在10 μmol/L c-di-AMP作用24 h后,A375细胞内的STING-TBK1-IRF3信号通路被激活,STING表达增加,在联合10 Gy X射线照射后STING表达量未见明显下降(图 2A)。且c-di-AMP激活磷酸化IRF3的强度与10 Gy X射线基本一致;10 Gy电离辐射联合c-di-AMP可进一步激活STING-TBK1-IRF3信号通路,差异具有统计学意义(t=7.89、4.41,P < 0.05)(图 2B)。可见,10 μmol/L的c-di-AMP可激活A375细胞内的STING-TBK1-IRF3途径,且可与电离辐射形成协同效应。
|
注:a与同组0 Gy相比,t=5.67、6.85,P < 0.05 图 1 电离辐射对A375细胞对STING-TBK1-IRF3的影响 A. X射线照射对STING-TBK1-IRF3及其下游通路的影响;B. 不同剂量的X射线对A375细胞STING、磷酸化TBK1、磷酸化IRF3的蛋白含量影响 Figure 1 Effect of ionizing radiation on the STING-TBK1-IRF3 signaling pathway A. 10 Gy X-Rays activated STING-TBK1-IRF3 signaling pathway; B. Effect of X-rays on the expressions of STING, phosphorylated TBK1 and phosphorylated IRF3 in A375 cells |
|
注:1. 空白对照组;2. c-di-AMP组;3. 10 Gy X射线照射组;4. 照射+ c-di-AMP组。a与空白对照组相比,t=12.52、12.37、7.53,P < 0.05;b与10 Gy X射线照射组相比,t=7.89、4.41,P < 0.05 图 2 c-di-AMP联合电离辐射对STING-TBK1-IRF3信号通路的影响 A. c-di-AMP可激活STING-TBK1-IRF3信号通路并与10 Gy X射线产生协同效应;B. STING的激活方式对A375细胞STING、磷酸化TBK1、磷酸化IRF3的蛋白含量影响 Figure 2 Effect of c-di-AMP combined with ionizing radiation on the STING-TBK1-IRF3 signaling pathway A. c-di-AMP and radiation synergistically activated STING-TBK1-IRF3 signaling pathway; B. Effect of c-di-AMP and irradiation on the expression of STING, phosphorylated TBK1 and phosphorylated IRF3 in A375 cells |
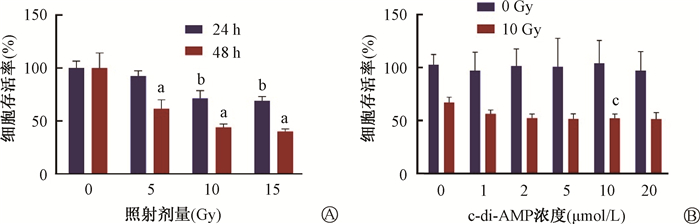
2. c-di-AMP联合电离辐射对皮肤黑色素瘤细胞存活的影响:以c-di-AMP与电离辐射可协同激活A375细胞内的STING-TBK1-IRF3信号通路为实验基础,为检测c-di-AMP与电离辐射对A375细胞生存的影响,选用CCK-8法对细胞活性进行分析。与空白对照组相比,在分别给予10和15 Gy X射线照射后24 h,A375细胞的存活率明显降低(t=5.06、6.30,P < 0.05),并随着照射后时间延长,细胞存活率进一步降低(t=4.00、6.58、7.12,P < 0.05,图 3A。而在用10 μmol/L的c-di-AMP进行处理后,10 Gy X射线照射联合c-di-AMP组的细胞存活率明显低于10 Gy X射线照射组,其差异具有统计学意义(t=5.11,P < 0.05)(图 3B)。说明c-di-AMP的处理能够降低X射线照射后A375细胞的存活率,体现出一定的放射增敏效果。并且10 μmol/L的c-di-AMP在各实验组中体现出较好的增敏效果。
|
注:a与空白对照组比较,t=4.00、6.58、7.12,P < 0.05;b与空白对照组比较,t=5.06、6.30,P < 0.05;c与10 Gy X射线照射组比较,t=5.11,P < 0.05 图 3 c-di-AMP联合电离辐射对A375细胞存活的影响 A. 不同剂量X射线照射后24和48 h A375细胞的存活率;B. 不同浓度c-di-AMP处理联合10 Gy X射线照射后48 h细胞的存活率 Figure 3 Effect of c-di-AMP with ionizing radiation on A375 cell viability A. Cell viability of A375 cells at 24 and 48 h after different doses of X-ray irradiation; B. Cell viability of A375 cells at 48 h after different concentrations of c-di-AMP treatment combined with 10 Gy X-ray irradiation |
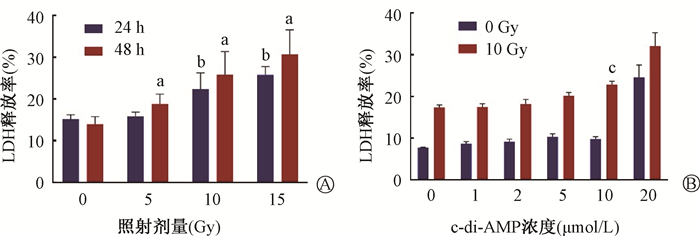
3. c-di-AMP联合电离辐射对皮肤黑色素瘤细胞毒性的影响:与空白对照组相比,在分别给予10和15 Gy的X射线照射后,A375细胞LDH的释放量明显增加,差异具有统计学意义(t=4.95、13.17,P < 0.05)(图 4A),并随着照射后时间延长,细胞LDH释放量进一步增加(t=4.65、5.67、7.69,P < 0.05)(图 4A)。而在用10 μmol/L的c-di-AMP进行处理后,10 Gy X射线联合c-di-AMP组的细胞LDH的释放量明显高于10 Gy X射线照射组,差异具有统计学意义(t=10.15,P < 0.05,图 4B)。说明c-di-AMP处理后的A375细胞对于X射线更为敏感,并且在10 μmol/L处可见较好的放射增敏效果。
|
注:a与空白对照组比较,t= 4.65、5.67、7.69,P < 0.05;b与同剂量照射后24 h比较,t=4.95、13.17,P < 0.05;c与10 Gy X射线照射组比较,t=10.15,P < 0.05 图 4 c-di-AMP联合电离辐射对A375细胞毒性的影响 A. 不同剂量X射线照射后24和48 h细胞的存活率;B. 不同浓度c-di-AMP处理联合10 Gy X射线照射后48 h细胞的存活率 Figure 4 The cytotoxicity of A375 after X-ray irradiation with c-di-AMP treatment A. LDH release rate of A375 cells at 24 h and 48 h after different doses of X-ray irradiation; B. Pre-treated with different concentrations of c-di-AMP, the LDH release rate of A375 cells at 48 h after 10 Gy X-ray irradiation |
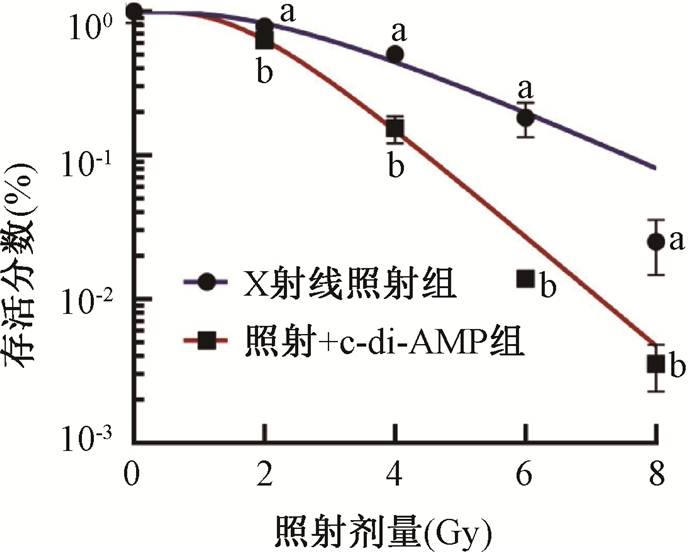
4. c-di-AMP联合电离辐射对皮肤黑色素瘤克隆形成能力的影响:随着辐射剂量的增加,A375细胞的克隆形成能力逐渐减弱(t=19.07、25.62、27.68、27.92,P < 0.05),且c-di-AMP处理后的A375细胞克隆形成能力弱于X射线照射组(t=6.30、3.55、5.45、3.55,P < 0.05)。依据单击多靶模型拟合细胞存活分数曲线图(图 5),获得平均致死量D0、准阈剂量Dq以及放射增敏比SER(表 1)。与X射线照射组相比,照射+c-di-AMP组的D0、Dq的值均减小,差异具有统计学意义(t=3.69、4.61,P < 0.05),SER值为1.88。上述结果表明c-di-AMP显著增加皮肤黑色素细胞的放射敏感性。
|
注:a与0 Gy比较,t=19.07、25.62、27.68、27.92,P < 0.05;b与同一剂量X射线照射组比较,t=6.30、3.55、5.45、3.55,P < 0.05 图 5 照射+c-di-AMP组及X射线照射组的A375细胞存活分数曲线 Figure 5 The survival curves of radiation plus c-di-AMP group and X-ray irradiation group of A375 cells |
|
|
表 1 两组A375细胞的放射增敏参数与增敏比(x±s) Table 1 The radiosensitization parameters and radiosensitization ratios of A375 cells after c-di-AMP treatment (x±s) |
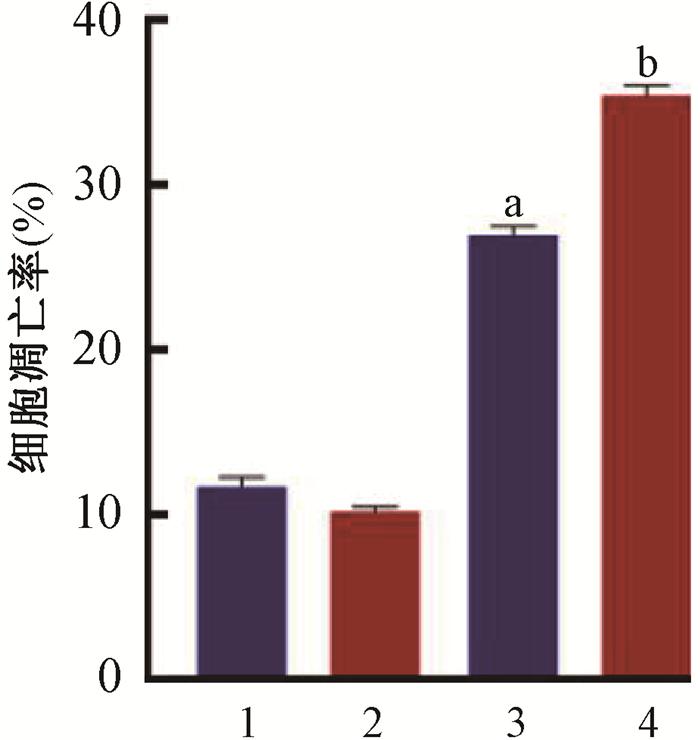
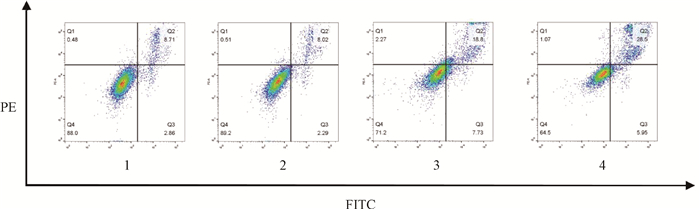
5. c-di-AMP联合电离辐射对皮肤黑色素瘤细胞凋亡水平的影响:与空白对照组(11.68±0.56)%的凋亡率相比,在给予10 Gy的X射线照射后,A375细胞的凋亡水平升高至(26.91±0.54)% (t=7.90,P < 0.05)。而在10 μmol/L的c-di-AMP处理后进行照射,照射联合c-di-AMP组的细胞凋亡水平为(35.37±0.65)%,明显高于单纯10 Gy X射线照射组,其差异具有统计学意义(t=4.41,P < 0.05),见图 6,7。这一结果表明c-di-AMP可促进受照射皮肤黑色素瘤细胞的凋亡。
|
注:1.空白对照组;2.c-di-AMP组;3.10 Gy X射线照射组;4.照射+c-di-AMP组。a与空白对照组比较,t= 7.90,P < 0.05;b与10 Gy X射线照射组比较,t=4.41,P < 0.05 图 6 10 Gy照射后48 h各组A375细胞凋亡率的比较 Figure 6 Comparison of cell apoptosis rate of different groups 48 h after X-ray irradiation |
|
注:1.空白对照组;2.c-di-AMP组;3.10 Gy X射线照射组;4.照射+c-di-AMP组 图 7 X射线照射和c-di-AMP作用A375细胞流式细胞图 Figure 7 The flow cytometry scatter plot of A375 cells after treatment of X-ray irradiation and c-di-AMP |
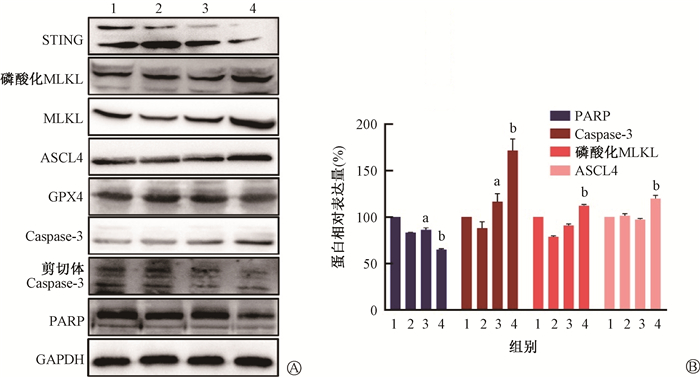
6. c-di-AMP联合电离辐射对皮肤黑色素瘤细胞死亡相关信号通路调控的影响:A375细胞在经过10 Gy X射线照射后48 h,STING蛋白表达量未见明显改变,而PARP的表达量略下降(t=5.31,P < 0.05),Caspase-3表达量略上升(t=9.91,P < 0.05)。在结合10 μmol/L c-di-AMP处理后,PARP表达量进一步下降(t=5.54,P < 0.05),而Caspase-3、MLKL、磷酸化MLKL、ASCL4表达量出现明显增加,差异具有统计学意义(t=5.14、6.06、5.64、5.15,P < 0.05),见图 8。说明c-di- AMP可通过促进细胞凋亡、坏死、铁死亡等多种作用方式促进受照射A375细胞的死亡。
|
注:1. 空白对照组;2. c-di-AMP组;3. 10 Gy X射线照射组;4. 照射+ c-di-AMP组。a与空白对照组相比,t=5.31、9.91,P < 0.05;b与10 Gy X射线照射组相比,t=5.14、6.06、5.64、5.15,P < 0.05 图 8 c-di-AMP联合10 Gy X射线照射48 h后对A375细胞死亡相关蛋白表达的影响 A. c-di-AMP联合10 Gy X射线照射对A375细胞死亡相关蛋白表达的影响;B. c-di-AMP联合10 Gy X射线处理后PARP、Caspase-3、磷酸化MLKL、ASCL4蛋白含量改变 Figure 8 Expressions of cell death-related proteins in A375 cells at 48 h after c-di-AMP treatment and X-ray radiation A. Effect of c-di-AMP combined with 10 Gy X-ray irradiation on the expression of death related proteins in A375 cells; B. The expression levels of PARP, Caspase-3, phosphorylated MLKL and ASCL4 were changed after c-di-AMP combined with 10 Gy X-ray irradiation |
讨论
相较于皮肤基底细胞癌等皮肤肿瘤,目前皮肤黑色素瘤的治疗仍然以手术切除为主,丝氨酸-苏氨酸蛋白激酶(BRAF)抑制剂等也适用于部分黑色素瘤患者。皮肤黑色素瘤细胞的程序性死亡受体1(PD-1)与mTOR信号通路的过度激活是黑色素瘤细胞放疗抵抗的重要原因[11],限制了放射治疗在皮肤黑色素瘤治疗中的应用。已有的对于黑色素瘤的放射增敏机制研究主要围绕抑制DNA损伤修复,如BRAF抑制剂威罗菲尼、CTC1端粒酶抑制剂等[12-13]。对于其他方式能否增加皮肤黑色素瘤的放射敏感性,目前鲜见文献报道。
现有的研究表明,在放射治疗中,电离辐射可致使细胞核DNA、线粒体DNA等释放到细胞质内,被环腺苷酸-鸟苷酸合酶(cyclic GMP-AMP synthase,cGAS)识别,生成环二核苷酸(哺乳动物体内产物为环腺鸟苷酸),并与内质网上的STING结合,诱导干扰素生成[14-16],这一过程与病原体感染类似[17]。但在肿瘤细胞内,STING的活性受到显著抑制[5-6]。提示活化STING可诱导肿瘤细胞死亡。已有的研究证实STING激动剂cGAMP、ADU-S100和diABZI等可通过诱导细胞凋亡、坏死等方式引起肿瘤细胞死亡[7-9]。
此外,目前发现STING激动剂diABZI可实现非小细胞肺癌的放射增敏[9],但对diABZI放射增敏机制的探究仍围绕细胞DNA损伤修复,并未对其他潜在的细胞凋亡、坏死、细胞焦亡等途径进行深入研究。本研究通过一系列实验证实STING激动剂c-di-AMP可实现对皮肤黑色素瘤的放射增敏,并进一步证实激活STING后的放射增敏效应除了干扰DNA损伤修复与促进细胞凋亡外,细胞坏死与细胞铁代谢紊乱所致铁死亡等也参与激活STING后的放射增敏作用。但细胞坏死、细胞铁死亡等途径如何参与STING激活后的放射增敏效应仍需进一步研究。
综上所述,本研究从激活STING的角度对提高黑色素瘤放射治疗疗效提供了新的理论依据。
利益冲突 全体作者无利益冲突,排名无争议,未因进行该研究而接受任何不正当的职务和财务利益
作者贡献声明 唐绍凯负责实验操作、撰写论文;陈建辉、耿凤豪负责数据分析;杨婷仪、李晓倩负责课题设计与部分实验操作;杜小波参与实验设计;张舒羽负责课题设计、指导论文修改
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. DOI:10.3322/caac.21708 |
| [2] |
Hendrickx A, Cozzio A, Plasswilm L, et al. Radiotherapy for lentigo maligna and lentigo maligna melanoma-a systematic review[J]. Radiat Oncol, 2020, 15(1): 174. DOI:10.1186/s13014-020-01615-2 |
| [3] |
Wang Y, Deng W, Li N, et al. Combining immunotherapy and radiotherapy for cancer treatment: current challenges and future directions[J]. Front Pharmacol, 2018, 9: 185. DOI:10.3389/fphar.2018.00185 |
| [4] |
Ishikawa H, Barber GN. STING is an endoplasmic reticulum adaptor that facilitates innate immune signalling[J]. Nature, 2008, 455(7213): 674-678. DOI:10.1038/nature07317 |
| [5] |
Baird JR, Friedman D, Cottam B, et al. Radiotherapy combined with novel STING-targeting oligonucleotides results in regression of established tumors[J]. Cancer Res, 2016, 76(1): 50-61. DOI:10.1158/0008-5472.CAN-14-3619 |
| [6] |
Song S, Peng P, Tang Z, et al. Decreased expression of STING predicts poor prognosis in patients with gastric cancer[J]. Sci Rep, 2017, 7: 39858. DOI:10.1038/srep39858 |
| [7] |
Jeong SH, Yang MJ, Choi S, et al. Refractoriness of STING therapy is relieved by AKT inhibitor through effective vascular disruption in tumour[J]. Nat Commun, 2021, 12(1): 4405. DOI:10.1038/s41467-021-24603-w |
| [8] |
Sivick KE, Desbien AL, Glickman LH, et al. Magnitude of therapeutic STING activation determines CD8+ T cell-mediated anti-tumor immunity[J]. Cell Rep, 2018, 25(11): 3074-3085. DOI:10.1016/j.celrep.2018.11.047 |
| [9] |
Shi J, Liu C, Luo S, et al. STING agonist and IDO inhibitor combination therapy inhibits tumor progression in murine models of colorectal cancer[J]. Cell Immunol, 2021, 366: 104384. DOI:10.1016/j.cellimm.2021.104384 |
| [10] |
Xue A, Shang Y, Jiao P, et al. Increased activation of cGAS-STING pathway enhances radiosensitivity of non-small cell lung cancer cells[J]. Thorac Cancer, 2022, 13(9): 1361-1368. DOI:10.1111/1759-7714.14400 |
| [11] |
Kleffel S, Posch C, Barthel SR, et al. Melanoma cell-intrinsic PD-1 receptor functions promote tumor growth[J]. Cell, 2015, 162(6): 1242-1256. DOI:10.1016/j.cell.2015.08.052 |
| [12] |
Boussemart L, Boivin C, Claveau J, et al. Vemurafenib and radiosensitization[J]. JAMA Dermatol, 2013, 149(7): 855-857. DOI:10.1001/jamadermatol.2013.4200 |
| [13] |
Luo YM, Xia NX, Yang L, et al. CTC1 increases the radioresistance of human melanoma cells by inhibiting telomere shortening and apoptosis[J]. Int J Mol Med, 2014, 33(6): 1484-1490. DOI:10.3892/ijmm.2014.1721 |
| [14] |
Lio CW, McDonald B, Takahashi M, et al. cGAS-STING signaling regulates initial innate control of cytomegalovirus infection[J]. J Virol, 2016, 90(17): 7789-7797. DOI:10.1128/JVI.01040-16 |
| [15] |
Li N, Zhou H, Wu H, et al. STING-IRF3 contributes to lipopolysaccharide-induced cardiac dysfunction, inflammation, apoptosis and pyroptosis by activating NLRP3[J]. Redox Biol, 2019, 24: 101215. DOI:10.1016/j.redox.2019.101215 |
| [16] |
Paijo J, Döring M, Spanier J, et al. cGAS senses human cytomegalovirus and induces type Ⅰ interferon responses in human monocyte-derived cells[J]. PLoS Pathog, 2016, 12(4): e1005546. DOI:10.1371/journal.ppat.1005546 |
| [17] |
Geng F, Chen J, Tang S, et al. Additional eidence for commonalities between COVID-19 and radiation injury: novel insight into COVID-19 candidate drugs[J]. Radiat Res, 2022, 198(3): 306-317. DOI:10.1667/RADE-22-00058.1 |
 2023, Vol. 43
2023, Vol. 43


