2. 苏州市中医医院,苏州 215007;
3. 苏州大学放射医学与防护学院 放射医学与辐射防护国家重点实验室,苏州 215123
2. Suzhou Hospital of Traditional Chinese Medicine, Suzhou 215007, China;
3. School of Radiation Medicine and Protection, State Key Laboratory of Radiation Medicine and Protection, Soochow University, Suzhou 215123, China
放疗是大肠癌综合治疗的重要组成部分,肿瘤细胞的放射敏感性直接影响治疗效果,因此,如何提高大肠癌细胞的放射敏感性意义重大[1]。肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)是肿瘤微环境中浸润数量最多的炎症细胞,其表型和功能类似于M2型巨噬细胞,与肿瘤实质细胞的增殖、转移、放化疗抵抗等生物学行为密切相关[2-3]。
研究发现,放疗后肿瘤细胞自噬可被激活,通过降解变性蛋白和受损细胞器,并循环利用,为细胞提供营养和能量,使肿瘤细胞产生放射抵抗,最终得以存活[4-5]。本研究旨在通过建立大肠癌移植瘤裸鼠模型,利用自噬激活的M2巨噬细胞培养基上清液作为干预手段,观察16 Gy局部外照射后,大肠癌移植瘤放射敏感性的变化,为M2巨噬细胞作为大肠癌临床放疗中的治疗靶点提供参考。
材料与方法1. 试剂:雷帕霉素(rapamycin,RAP)、巴弗洛霉素(bafilomycin A1,BAF A1)、鼠抗人GAPDH抗体、兔抗人β-肌动蛋白抗体购自美国Santa Cruz公司,兔抗人Beclin-1抗体、兔抗人Survivin抗体购自美国Cell Signaling公司,兔抗人LC3(-Ⅰ/Ⅱ)抗体购自德国Sigma-Aldrich公司,鼠抗人Livin抗体购自英国Biorbyt公司,兔抗人CD34抗体、羊抗兔二抗购自英国Abcam公司,羊抗鼠二抗购自上海碧云天公司,MolPureⓇ细胞RNA试剂盒购自上海野森生物科技有限公司,人重组白细胞介素IL-4购自美国Peprotech公司,佛波酯(PMA)购自北京四正柏生物科技公司,通用SP试剂盒购自美国Solarbio公司,原位缺口末端标记法(TUNEL)细胞凋亡检测试剂盒购自美国Ronch公司。
2. M2巨噬细胞的诱导与鉴定:人单核细胞白血病细胞(THP-1)购自中国科学院上海细胞研究所,依据参考文献[6]将THP-1细胞(4×106)在含30 nmol/L PMA的培养基中培养48 h,使细胞分化为M0巨噬细胞。M0巨噬细胞在含60 ng IL-4的培养基中继续培养48 h,诱导为M2巨噬细胞。利用MolPureⓇ细胞RNA试剂盒分别从THP-1、M0、M2中提取总RNA,根据说明使用RT系统试剂盒合成cDNA。随后,按照说明使用QuantiNova SYBR Green PCR试剂盒进行定量聚合酶链反应(qPCR)。Arg-1正向引物:5'G T G G A A A C T T G C A T G G A C A A C 3',反向引物:5'A A T C C T G G C A C A T C G G G A A T C 3'。CCL22正向引物:5'A G C G T C T G C T G C C G T G A 3',反向引物:5'A G T C T G A G G T C C A G T A G A A G T G T T T 3'。GAPDH正向引物:5'C A T G A G A A G T A T G A C A A C A G C C T 3',反向引物:5'A G T C C T T C C A C G A T A C C A A A G T 3'。反应完成后,以THP-1为对照,对实验数据以2-ΔΔCt法计算出目的基因mRNA表达水平的相对变化。
3. 免疫荧光检测自噬标记物Lc3b:取诱导成功的M2巨噬细胞按1×105/孔密度接种于预先在底部铺有经脱脂灭菌处理小玻璃片的24孔板中,待细胞贴壁后,分为M2自噬未激活组[M2+磷酸盐缓冲液(PBS),M2-MS组]和M2自噬激活组[M2+400 nmol/L RAP,RAP-M2-MS组]。48 h后中止培养,用PBS冲洗两遍后,4%多聚甲醇固定,用牛血清蛋白(BSA)封闭液37℃封闭1 h,然后与稀释好的Lc3b一抗4℃孵育过夜;加入稀释好的二抗室温避光孵育1 h;封片,4℃保存。共聚焦显微镜下观察。另设M2自噬激活后下调组:M2(400 nmol/L RAP)+50 nmol/L (BAF-A1-RAP-M2-MS组),培养48 h后同法检测。
4. Trans-well非接触共培养:人结肠癌细胞(LoVo)购自美国模式培养物集存库(ATCC),由本实验室保存。分为M2+LoVo组、自噬激活的M2 (400 nmol/L RAP, 48 h)+LoVo组、M2(400 nmol/L RAP, 48 h+50 nmol/L BAF A1, 48 h)+LoVo组。将M2制成细胞悬液,以2×105/ml的密度接种于半透膜孔径为0.4 μm(Costar 3450)的Trans-well上室chamber中;待M2贴壁后,将chamber加入预先接种密度为1×105/ml LoVo的6孔板中,构建非接触共培养体系(此时M2位于上室,LoVo位于下室)。共培养体系中细胞均在含10%胎牛血清的RPMI 1640培养液中生长,37℃、5%CO2培养。48 h后,收集M2上清液,离心去除死细胞后保存,用于后续裸鼠成瘤实验。
5. 裸鼠大肠癌移植瘤模型的建立:BALB/c-nu/nu裸鼠购于苏州大学实验动物中心,4~6周龄,体重(20±2) g,雌性。按无特定病原体(SPF)级管理,饲养于苏州大学动物中心屏障系统内。将含4×106单独培养的人大肠癌LoVo细胞悬液接种于BALB/c-nu/nu裸小鼠背部皮下。接种1周后观察到肉眼可见的瘤体,接种后10 d,当瘤体直径达到10 mm时,将荷瘤裸鼠按照随机数字表法分为5组,每组6只。阴性对照组:瘤周注射0.9%氯化钠溶液0.2 ml/次;M2自噬未激活组(M2-MS):瘤周注射自噬未激活的M2上清液0.2 ml/次;M2自噬激活组(RAP-M2-MS):瘤周注射自噬激活的M2上清液0.2 ml/次;M2自噬激活后下调组(BAF-A1-RAP-M2-MS):瘤周注射BAF-A1下调自噬已被激活的M2上清液0.2 ml/次。上述4组均为每24小时注射1次,并接受照射。另设空白对照组:瘤周注射0.9%氯化钠溶液0.2 ml/次,每24小时注射1次,不接受照射。
6. 动物照射与观测:阴性对照组与M2巨噬细胞上清液干预组均在首次瘤周注射后的第2天予以第1次局部照射:采用德国西门子公司PRIMUS-H型医用电子直线加速器照射,6 MV X射线,射野2 cm×2 cm,源皮距(SSD)=100 cm,照射剂量为8 Gy,输出剂量率300 MU/min;首次瘤周注射后的第13天,同法进行第2次8 Gy局部照射。照射后隔日测量肿瘤长径(L)和与其垂直的短径(W),肿瘤体积大小的估算公式采用V=LW2/2,依据肿瘤体积按如下公式计算抑瘤率:抑瘤率(%)=(1-实验组平均瘤体积/对照组平均瘤体积)×100%。
7. 瘤体石蜡切片苏木精-伊红(HE)染色:第2次照射后10 d,处死裸鼠,取出瘤体,测定质量与体积。瘤体经处理后进行切片HE染色,显微镜下观察。
8. 免疫组织化学链霉素抗生物素蛋白-过氧化物酶(SP)法检测CD34的表达,观察微血管形成情况:对瘤体石蜡切片进行显色反应后共聚焦显微镜下观察拍照,CD34染色标记血管内皮细胞,淡黄色或棕色均可判定为染色阳性。
9. TUNEL法检测瘤体细胞凋亡:参考凋亡检测试剂盒说明书操作,对瘤体石蜡切片进行显色反应后共聚焦显微镜下观察。
10. 免疫印迹实验:瘤体组织经生理盐水清洗后剪碎,用PBS洗3次,3 000 r /min,离心半径6 cm,离心3 min,弃上清,随后加入适量细胞裂解液,冰上裂解15~20 min,12 000 r /min,离心半径6 cm,离心10 min,取上清,用BCA法沉淀蛋白浓度。加入5×十二烷基硫酸钠(SDS)上样缓冲液(loading buffer)沸水中煮10 min。每孔按40 μg的蛋白进行凝胶电泳,随后转移至硝酸纤维素膜(NC)膜上,用牛奶室温封闭1 h,然后与配好的一抗4℃孵育过夜。次日,等渗盐溶液加Tris-HCl缓冲液(TBST)清洗3次后,加入相应二抗,室温孵育1 h,TBST清洗3次,显影液按1∶1的比例配制,显影,观察结果。此实验用于检测Beclin-1、LC3-Ⅰ、LC3-Ⅱ、Livin、Survivin的表达。
11. 染色阳性细胞计数与评分:使用软件Image J对TUNEL法检测凋亡和SP法免疫组织化学结果进行分析,包括利用Trainable Weka Segmentation对阳性细胞进行计数,以及利用IHC Profiler对样本的染色情况进行自动化评分。
12. 统计学处理:采用SPSS 24.0软件进行分析,数据符合正态分布,计量资料以x±s表示。两组间比较采用独立样本t检验。计数资料采用百分率表示,组间比较采用χ2检验。P < 0.05为差异有统计学意义。
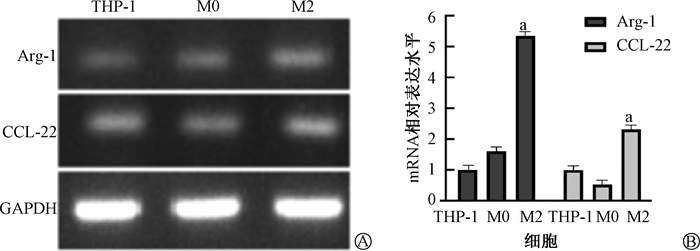
结果1. THP-1细胞经PMA、IL-4诱导分化为M2型巨噬细胞:PMA作用48 h后,THP-1由类球型变为不规则,由悬浮生长变为贴壁生长。IL-4继续作用48 h后,M2中Arg-1、CCL-22的mRNA表达量为5.35±0.07和2.37±0.04,较仅由PMA诱导所得的M0(1.56±0.03、0.49±0.03)显著提高(t=78.77、60.02,P<0.05),见图 1。
|
注:a与M0型细胞同一细胞标志物比较,t=78.77、60.02,P<0.05 图 1 THP-1细胞经PMA、IL-4作用后Arg-1和CCL-22 mRNA表达水平变化 A.电泳图;B.相对表达量 Figure 1 The changes of mRNA expressions of Arg-1, CCL-22 in THP-1 after treatment with PMA and IL-4 A. Electrophoretogram; B. Relative expression level |
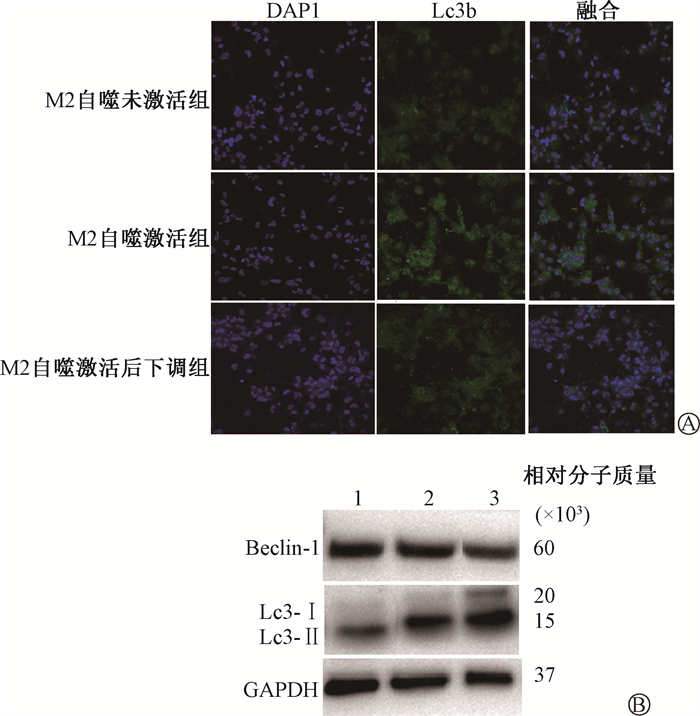
2. RAP和BAF A1对M2型巨噬细胞自噬的影响:结果见图 2。在相对封闭环境中培养M2,由于pH值的改变和营养物质的消耗可引起低水平的自噬。M2自噬未激活组Lc3b荧光阳性细胞比例为(27.07±2.63)%。400 nmol/L RAP处理48 h后,比例增加至(80.47±2.49)% (t= 25.49,P<0.05)。M2自噬未激活组Beclin-1、Lc3-Ⅰ、Ⅱ蛋白相对表达量分别为0.64±0.07、0.11±0.02、0.40±0.03,在M2自噬激活组中分别为0.85±0.05、0.26±0.03、1.13±0.16,RAP作用后,自噬相关蛋白表达显著提高(t=4.85、8.25、9.08,P<0.05)。M2自噬未激活组Lc3-Ⅱ/Ⅰ为3.37±0.57,M2自噬激活组为4.97±0.78,RAP激活了M2的自噬流(t=3.32,P<0.05)。利用BAF A1下调自噬已被激活的M2,Lc3b阳性细胞比例下降为(51.63±2.18)%,Beclin-1和Lc3- Ⅰ、Ⅱ相对表达量分别为0.49±0.03、1.33±0.10、3.12±0.07,Lc3-Ⅱ/Ⅰ下降为2.35±0.16,表明BAF A1通过抑制Lc3-Ⅱ的降解,使Lc3-Ⅱ蓄积,下调了M2已被激活的自噬流。
|
注:1. M2自噬未激活组;2. M2自噬激活组;3. M2自噬激活后下调组;蓝色为DAPI标记的活细胞;绿色为CY3-Lc3b标记的自噬小体 图 2 RAP、BAF A1分别作用于M2巨噬细胞后自噬的改变A. DAPI、CY3-Lc3b双染观察Lc3b荧光阳性细胞 免疫荧光染色 ×20;B. 自噬相关蛋白Beclin-1、Lc3-Ⅰ、Lc3-Ⅱ表达情况 Figure 2 Changes of autophagy in M2 macrophages treated with rapamycin and bafilomycin A1, respectively A. DAPI and CY3-Lc3b double staining were used to observe Lc3b fluorescence positive cellsImmunofluorescence staining×20;B. Expression of autophagy related proteins Beclin-1, Lc3-Ⅰ and Lc3-Ⅱ |
3. 激活M2巨噬细胞自噬对大肠癌移植瘤生长的影响:分组干预1周后,空白对照组肿瘤体积增大最为显著,M2-MS组肿瘤体积增速次之,RAP-M2-MS组肿瘤生长最为缓慢。阴性对照组肿瘤质量和体积均小于M2-MS组(t=20.07、14.56,P<0.05),抑瘤率高于M2-MS组(t=11.26,P<0.05);而RAP-M2-MS组中肿瘤体积与重量显著低于M2-MS组(t=44.37、40.32,P<0.05)。RAP-M2-MS组抑瘤率为54.53%,显著高于M2-MS组的21.61%(t=27.72, P<0.05)。当下调M2被激活的自噬后,抑瘤率降为49.76%(t=3.75, P<0.05),瘤体重量与体积有所增加(t=4.67、13.79,P<0.05),见表 1。
|
|
表 1 第2次照射后10 d各组中大肠癌移植瘤重量、体积、抑瘤率情况(x±s) Table 1 At 10 d after irradiation, the weight, volume and tumor inhibition rate of colorectal cancer xenograft in each group (x±s) |
4. 瘤体组织病理学检验:HE染色发现,空白对照组中肿瘤细胞生长旺盛,未见典型坏死区域。与阴性对照组相比,M2-MS组、RAP-M2-MS组和BAF-A1-RAP-M2-MS组3组中的间充质细胞和癌巢样结构更加丰富,形态更为典型。16 Gy X射线照射后,4组瘤体组织中均观察到细胞核浓染与固缩,以及程度不同的坏死,组间病理学改变无明显差异。
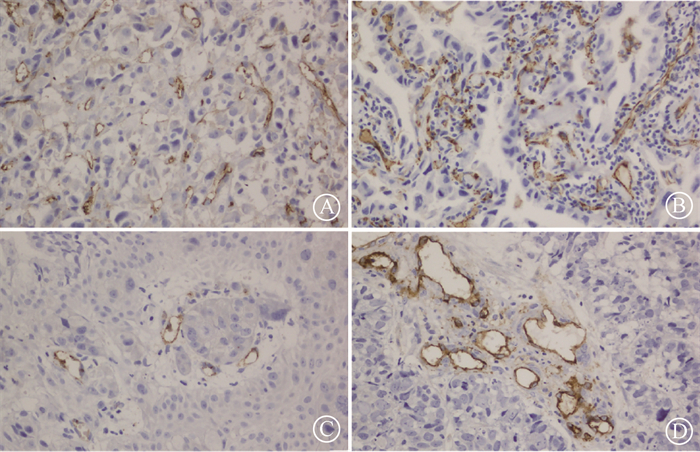
5. 激活M2巨噬细胞自噬对大肠癌转移瘤中微血管密度(micro-vessel density,MVD)的影响:瘤周注射M2上清液,各组间MVD差异有统计学意义,见图 3。MVD由阴性对照组中的25.69±1.34提高至36.37±1.04(t=10.92,P<0.05);当RAP激活M2自噬后,MVD出现了显著下降,降至13.60±1.52(t=21.43,P<0.05);BAF A1下调M2已被激活的自噬后,MVD回升至21.06±1.41(t=6.23,P<0.05)。
|
图 3 M2巨噬细胞自噬调控对各组大肠癌移植瘤微血管形成的影响 免疫组织化学染色 ×20 A.阴性对照组;B. M2-自噬未激活组;C. M2自噬激活组;D. M2自噬激活后下调组 Figure 3 Effect of M2 macrophage autophagy on MVD of colorectal cancer xenograft of each group Immunohistochemical staining×20 A. Negative control group; B. M2-MS group; C. RAP-M2-MS group; D. BAF-A1-RAP-M2-MS group |
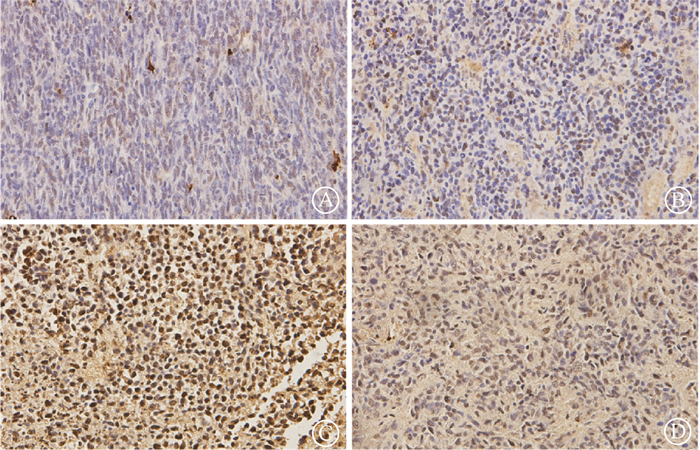
6. 自噬激活的M2巨噬细胞诱导大肠癌移植瘤放疗后凋亡的发生:16 Gy X射线照射后,4组移植瘤均发生了凋亡,M2-MS组较阴性对照组有所提高[(21.74±4.83)% vs. (14.75±1.82)%,t=2.707,P<0.05];RAP激活M2自噬后,凋亡比例提高至(67.70±5.05)%(t=13.13,P<0.05);BAF A1下调M2已被激活的自噬后,凋亡细胞比例下降至(50.58±2.32)%(t=6.153,P<0.05),见图 4。
|
图 4 各组移植瘤中细胞凋亡比例免疫组织化学染色 ×20 A.阴性对照组;B. M2自噬未激活组;C. M2自噬激活组;D. M2自噬激活后下调组 Figure 4 Apoptotic cells in each group Immunohistochemical staining×20 A. Negative control group; B. M2-MS group; C. RAP-M2-MS group; D. BAF-A1-RAP-M2-MS group |
7. M2巨噬细胞抑制大肠癌移植瘤中Livin和Survivin的表达:M2-MS组中,Livin和Survivin的表达量低于阴性对照组(t=2.64、7.90,P<0.05)。当RAP激活M2自噬后,二者表达均受到抑制,Livin和Survivin表达量均出现显著下降(t=5.43、9.39,P<0.05);BAF A1下调M2已被激活的自噬后,Livin和Survivin表达量均有所回升(t=2.80、3.17,P<0.05),见图 5。
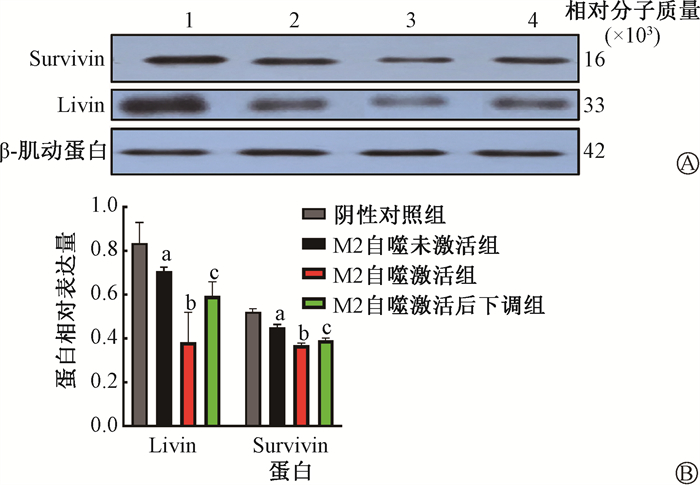
|
注:a与同一蛋白阴性对照组比较,t=2.64、7.90,P<0.05; b与同一蛋白M2-自噬未激活组比较,t=5.43、9.39,P<0.05; c与同一蛋白M2自噬激活后下调组比较,t=2.80、3.17,P<0.05 图 5 各组移植瘤中Livin和Survivin蛋白相对表达量 A.电泳图;B.相对表达量 Figure 5 Protein expression levels of Livin and Survivin in each group A. Electrophoretogram; B. Relative expression level |
讨论
研究者们已经认识到,巨噬细胞的表型在肿瘤微环境的作用下会发生定向改变,极化为M2型巨噬细胞,能够分泌IL-1、IL-6、血小板衍生生长因子(PDGF)等细胞因子,诱导肿瘤微血管形成,促进肿瘤生长[7]。Rahal等[8]发现通过逆转巨噬细胞的M2表型,可提高炎性乳腺癌的放射敏感性。在本实验中,接受总剂量为16 Gy X射线照射后,通过观察大肠癌移植瘤质量与体积发现,与LoVo细胞单独成瘤相比,M2上清液的持续作用能显著促进大肠癌移植瘤的生长。在M2上清液的持续作用下,大肠癌移植瘤的MVD较阴性对照组显著提高。综上分析,同样接受总剂量为16 Gy X射线照射,M2能够促进大肠癌移植瘤微血管的形成,这是造成阴性对照组与M2-MS组之间瘤体质量与体积存在差异有统计学意义的原因之一,与前期体外集落形成实验结果相符[9]。
目前,自噬研究大多集中在肿瘤细胞本身,而肿瘤间质细胞自噬激活后对肿瘤生物学行为的影响则报道甚少。因此,利用RAP激活M2巨噬细胞自噬,观察其对大肠癌移植瘤放射敏感性的影响。结果发现,M2自噬激活组的瘤体质量与体积较M2自噬未激活组出现显著下降,抑瘤率则显著提高。基于以上结果,初步推断:激活M2自噬抑制了其促进大肠癌移植瘤生长的作用。对瘤体进行病理检查后发现,与空白对照组相比,16 Gy X射线照射后,在4组瘤体中均观察到细胞核浓染与固缩,以及程度不同的坏死,而4组间病理学改变无明显差异。
诱导凋亡是放疗杀伤肿瘤细胞的重要途径之一[10-11],放疗后凋亡的发生与肿瘤放射敏感性有着密切关系[12]。凋亡检测结果显示,M2自噬未激活组中凋亡比例较阴性对照组有所提升;当M2巨噬细胞自噬被RAP激活后,凋亡细胞比例出现了显著提高。
Survivin和Livin作为凋亡抑制蛋白因子(inhibitors of apoptosis proteins,IAPs)家族中的重要成员,均可使肿瘤细胞逃避细胞周期检测点从而实现异常增殖[13-15]。另外,Survivin还参与了微血管形成、抑制肿瘤自发凋亡、抑制放疗所诱导的凋亡[16-17]。Western blot结果显示,M2-MS组中Survivin与Livin相对表达量较阴性对照组有所降低,该结果与TUNEL检测凋亡细胞比例结果相符。当M2自噬被RAP激活后,大肠癌移植瘤体中凋亡抑制基因Survivin和Livin表达显著降低,这与凋亡细胞比例检测结果也相符。
为进一步确定激活M2自噬是否能对大肠癌移植瘤的放射敏感性产生影响,利用BAF A1下调自噬已被激活的M2,结果发现,瘤体质量与体积较M2自噬激活组有所增加, 抑瘤率也出现了一定程度的下降,MVD显著提高。对上述两组中瘤体Livin和Survivin相对表达量和凋亡细胞比例进行检测发现,M2已被RAP激活的自噬经BAF A1下调后,凋亡抑制基因Survivin和Livin表达量则有所提高,凋亡细胞比例出现了下降,二者相互佐证。因此,通过反向调控M2自噬,证明了激活M2自噬对大肠癌移植瘤的微血管形成和照射后凋亡的发生产生了影响。
综上,M2巨噬细胞可通过诱导瘤体微血管形成,从而促进大肠癌移植瘤的生长,这是肿瘤相关巨噬细胞参与大肠癌放疗抵抗的机制之一。利用RAP激活M2自噬,可以抑制M2这种促肿瘤生长的能力。激活M2自噬还可通过下调瘤体组织中Livin与Survivin表达,诱导大肠癌移植瘤放疗后凋亡的发生。当然,M2型巨噬细胞与大肠癌细胞间的相互作用是极其复杂的,在今后的工作中需进一步分析M2上清液中的具体成分,并对其进行甄选,从而能够准确地解释现有结果,为后续探明所涉及的信号通路打下基础,最终期望能够为大肠癌放疗增敏提供新的思路。
利益冲突 无
作者贡献声明 邵乐宁负责实验操作、撰写论文;朱宝松、杨晓东协助实验操作;曹建平、邢春根指导课题设计和修改论文
| [1] |
Benson KRK, Sandhu N, Zhang C, et al. Local recurrence outcomes of colorectal cancer oligometastases treated with stereotactic ablative radiotherapy[J]. Am J Clin Oncol, 2021, 44(11): 559-564. DOI:10.1097/COC.0000000000000864 |
| [2] |
Li J, Li L, Li Y, et al. Tumor-associated macrophage infiltration and prognosis in colorectal cancer: systematic review and meta-analysis[J]. Int J Colorectal Dis, 2020, 35(7): 1203-1210. DOI:10.1007/s00384-020-03593-z |
| [3] |
Wang Z, Yang Y, Cui Y, et al. Tumor-associated macrophages regulate gastric cancer cell invasion and metastasis through TGFβ2/NF-κB/Kindlin-2 axis[J]. Chin J Cancer Res, 2020, 32(1): 72-88. DOI:10.21147/j.issn.1000-9604.2020.01.09 |
| [4] |
Lorenzo G, José Manuel BP, Sandra D, et al. Activating autophagy to potentiate immunogenic chemotherapy and radiation therapy[J]. Nat Rev Clin Oncol, 2017, 14(4): 247-258. DOI:10.1038/nrclinonc.2016.183 |
| [5] |
Patel NH, Bloukh S, Alwohosh E, et al. Autophagy and senescence in cancer therapy[J]. Adv Cancer Res, 2021, 150: 1-74. DOI:10.1016/bs.acr.2021.01.002 |
| [6] |
Qin Z. The use of THP-1 cells as a model for mimicking the function and regulation of monocytes and macrophages in the vasculature[J]. Atherosclerosis, 2012, 221: 2-11. DOI:10.1016/j.atherosclerosis.2011.09.003 |
| [7] |
Badawi MA, Abouel DM, EI-Sharkawy SL, et al. Tumor-associated macrophage and angiogenesis in human colon carcinoma[J]. Open Access Maced J Med, 2015, 3(2): 209-214. DOI:10.3889/oamjms.2015.044 |
| [8] |
Rahal OM, Wolfe AR, Mandal PK, et al. Blocking interleukin(IL)-4 and IL-13 mediated phosphorylation of STAT6(Tyr641) decreases M2 polarization of macrophages and protects against macrophage-mediated radioresistance of inflammatory breast cancer[J]. Int J Radiat Oncol Biol Phys, 2018, 100(4): 1034-1043. DOI:10.1016/j.ijrobp.2017.11.043 |
| [9] |
Shao LN, Zhu BS, Xing CG, et al. Effects of autophagy regulation of tumorassociated macrophages on radiosensitivity of colorectal cancer cells[J]. Mol Med Rep, 2016, 13: 2661-2670. DOI:10.3892/mmr.2016.4820 |
| [10] |
Fang D, Wang H, Li M, et al. ɑ-bisabolol enhances radiotherapy-induced apoptosis in endometrial cancer cells by reducing the effect of XIAP on inhibiting caspase-3[J]. Biosci Rep, 2019, 39(6): BSR20190696. DOI:10.1042/BSR20190696 |
| [11] |
Fhoghlú MN, Barrett S. A review of radiation-induced lymphocyte apoptosis as a predictor of late toxicity after breast radiotherapy[J]. J Med Imaging Radiat Sci, 2019, 50(2): 337-344. DOI:10.1016/j.jmir.2019.02.004 |
| [12] |
Liu HM, Wu Q, Cao JQ, et al. A phenanthroline derivative enhances radiosensitivity of hepatocellular carcinoma cells by inducing mitochondria-dependent apoptosis[J]. Eur J Pharmacol, 2019, 843: 285-291. DOI:10.1016/j.ejphar.2018.10.031 |
| [13] |
Wu SQ, Xu QB, Sheng WY, et al. A novel role for Livin in the response to ultraviolet B radiation and pterygium development[J]. Int J Mol Med, 2020, 45(4): 1103-1111. DOI:10.3892/ijmm.2020.4481 |
| [14] |
Myung DS, Park YL, Chung CY, et al. Expression of Livin in colorectal cancer and its relationship to tumor cell behavior and prognosis[J]. PLoS One, 2013, 8(9): e73262. DOI:10.1371/journal.pone.0073262 |
| [15] |
Shojaei F, Yazdani-Nafchi F, Banitalebi-Dehkordi M, et al. Trace of survivin in cancer[J]. Eur J Cancer Prev, 2019, 28(4): 365-372. DOI:10.1097/CEJ.0000000000000453 |
| [16] |
Ahluwalia A, Patel K, Hoa N, et al. Melatonin ameliorates aging-related impaired angiogenesis in gastric endothelial cells via local actions on mitochondria and VEGF-survivin signaling[J]. Am J Physiol Gastrointest Liver Physiol, 2021, 321(6): G682-G689. DOI:10.1152/ajpgi.00101.2021 |
| [17] |
Fernández JG, Rodríguez DA, Valenzuela M, et al. Survivin expression promotes VEGF-induced tumor angiogenesis via PI3K/Akt enhanced β-catenin/Tcf-Lef dependent transcription[J]. Mol Cancer, 2014, 13: 209. DOI:10.1186/1476-4598-13-209 |
 2022, Vol. 42
2022, Vol. 42


