2. 南京医科大学附属常州市第二人民医院核医学科,常州 213001
2. Department of Nuclear Medicine, Changzhou Second People's Hospital Affiliated to Nanjing Medical University, Changzhou 213001, China
卵巢癌是常见的妇科恶性肿瘤,因其发病隐匿和早期症状不典型导致多数患者确诊时已为晚期[1],常伴有广泛腹膜转移和腹水,5年总生存率仅为30%左右[2]。目前,以铂类为基础的联合化疗是晚期卵巢癌腹膜转移的一线治疗方案,但70%的患者会在3年内治疗失败[3-4]。研究表明,卵巢癌是一种放射敏感性肿瘤,将放射性药物进行腹腔注射内照射放疗,可以发挥类似于腹腔化疗局部药物高浓度的优势,从而减少复发,带来生存获益[5-7]。如能通过改进放射性药物载体进一步增强疗效,减少不良反应,对于完善卵巢癌综合治疗和解决复发难题具有重要意义。本研究以叶酸受体(folate receptor,FR)为靶向分子,可生物降解材料聚乳酸共聚物(PLGA)为载体基质,制备镥-177标记叶酸-二乙烯三胺五乙酸-聚乙二醇-聚乳酸共聚物(177Lu-FA-DOTA-PEG-PLGA)纳米粒子,初步评价其靶向效应和腹腔注射后对荷瘤小鼠卵巢癌腹腔转移瘤及腹水的疗效。
材料与方法1. 纳米载体结构表征和177Lu标记:纳米载体FA-DOTA-PEG-PLGA由南京东纳生物科技有限公司制备。使用透射电子显微镜(日本JEOL公司,JEM-2100型) 和动态激光光散射仪器(DLS)测定纳米粒的形态和粒径。177Lu(北京原子高科股份有限公司)50 μl和FA-DOTA-PEG-PLGA 50 μl旋涡混匀10 s,40℃加热60 min,装载入超滤管12 000 r/min离心5 min,离心半径50 cm,超滤3次,标记和获得177Lu-FA-DOTA-PEG-PLGA纳米粒子。测定177Lu-FA-DOTA-PEG-PLGA标记率和放化纯度。
2. 纳米粒子肿瘤靶向性研究:SKOV3人卵巢癌移植瘤荷瘤鼠(江苏南京云桥璞瑞生物科技有限公司提供)5只,体重20~22 g,尾静脉注射177Lu-FA-DOTA-PEG-PLGA纳米粒子7.4 MBq,分别于4、24、72 h和7 d行微型单光子发射计算机断层成像(micro-SPECT/CT)(荷兰MIlab公司,U-SPECT/CT),通过瑞士PMOD软件进行小鼠肿瘤、肌肉等脏器的摄取定量分析,计算肿瘤肌肉摄取比值(T/M),T/M=肿瘤放射性计数/肌肉放射性计数。
3. 纳米粒子腹腔注射后组织分布研究:取12只健康裸鼠(江苏常熟华景分子影像与药物研究院有限公司提供),随机抽签法分为4组,每组3只。腹腔注射177Lu-FA-DOTA-PEG-PLGA纳米粒子18.5 MBq,分别于4、24、72 h、7 d后麻醉处死,取主要脏器测量质量和放射性计数(美国Capintec公司,CRC-55tR型放射性活度计),衰变校正后计算每克组织百分注射剂量率(ID%/g)。
4. 纳米粒子腹腔灌注治疗卵巢癌腹膜转移疗效评价:①分组:另取12只腹腔转移瘤荷瘤鼠,体重20~22 g,(南京云桥璞瑞生物科技有限公司提供)随机抽签法分为3组:阴性对照组(NaCl生理盐水0.2 ml)、化疗组(顺铂3 mg/kg,2次/周[8])、粒子组(纳米粒子18.5 MBq)[9],每组4只。②腹腔肿瘤生长情况:分别于给药前和给药7 d后行荧光活体成像,美国PerkinElmer影像软件分析,比较腹部肿瘤荧光强度,计算相对肿瘤抑制率(tumor growth inhibition, TGI),TGI(%)= (1-T/C) × 100%。式中,T和C分别为治疗(化疗或粒子)组和阴性对照组某一时间点的相对肿瘤荧光强度。③TUNEL法检测肿瘤细胞凋亡:每只裸鼠肿瘤组织取3张切片,每张切片随机取10个200倍镜视野,每个视野计数不少于100个细胞。凋亡阳性细胞在荧光镜下呈棕黄色,细胞凋亡率(AI,%)=阳性细胞数/计数细胞总数×100%。④免疫组织化学法检测Ki67增殖指数:细胞核中出现棕色颗粒为阳性,阅片同TUNEL,Ki67增殖指数(%)=阳性细胞数/计数细胞总数×100%。⑤测量腹水:裸鼠处死后取腹水比较体积。
5. 纳米粒子治疗安全性评价:对粒子组荷瘤鼠进行血常规、肝功能检测以及肝、脾、结肠、小肠HE染色病理观察。
6. 统计学处理:采用GrandPad Prism 9.0件进行统计分析。符合正态分布的定量资料采用x±s表示,多组间均数比较符合方差齐性,采用单因素方差分析,两两比较采用Tukey法多重检验。P < 0.05为差异有统计学意义。
结果1. 纳米载体结构表征和放射性理化特性:透射电镜显示,FA-DOTA-PEG-PLGA纳米载体呈球形,直径约为20~60 nm,DLS测试的Zeta平均电位为-15 mV,载体稳定性较好。177Lu-FA-DOTA-PEG-PLGA纳米粒子的标记率为97%~98%,放化纯为96%~98%。
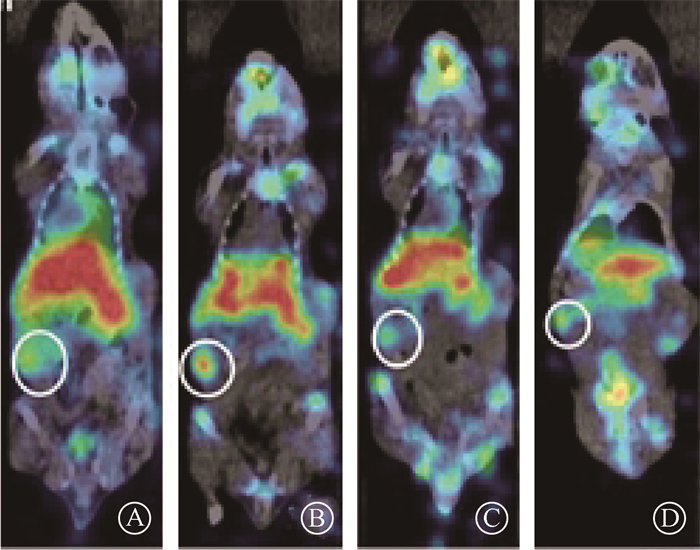
2. 纳米粒子肿瘤靶向性研究:移植瘤荷瘤鼠Micro-SPECT/CT显像中,4、24、72 h和7 d 4个时间点均见右下肢移植瘤团块状放射性浓聚,肿瘤肌肉摄取比值(T/M)分别为2.18±0.26、2.81±0.49、1.84±0.31和1.65±0.27,其中24 h为最高峰值。右下肢皮下移植瘤见放射性浓聚,见图 1。
|
注:白圈内为右下肢皮下移植瘤 图 1 移植瘤荷瘤鼠模型尾静脉注射177Lu-DOTA-mFA- PEG-PLGA后不同时间micro-SPECT/CT显像A.4 h;B.24 h;C.72 h;D.7 d Figure 1 Micro-SPECT/CT imaging at different times after 177 Lu-DOTA-mFA-PEG-PLGA injection via tail vein of the transplanted tumor bearing mouse A. 4 h; B. 24 h; C. 72 h; D.7 d |
3. 纳米粒子腹腔注射后组织分布:血液放射性摄取4 h时最高,24和72 h有少量放射性摄取,7 d时血液放射性摄取呈本底水平,基本清除。7 d内,肝脏、脾脏的放射性摄取呈缓慢增长;肾脏放射性摄取逐渐下降,24、72 h和7 d的放射性摄取分别为4 h放射性摄取的58%、42%和26%。各重要脏器组织放射性分布如表 1所示。
|
|
表 1 腹腔注射177Lu-DOTA-mFA-PEG-PLGA后不同时间裸鼠组织内分布(ID %/g,x±s) Table 1 Tissue distribution of 177Lu-DOTA-mFA-PEG-PLGA particles in mouse tissues at different time points after intraperitoneal injection (ID %/g, x±s) |
4. 腹膜转移瘤和腹水疗效评价
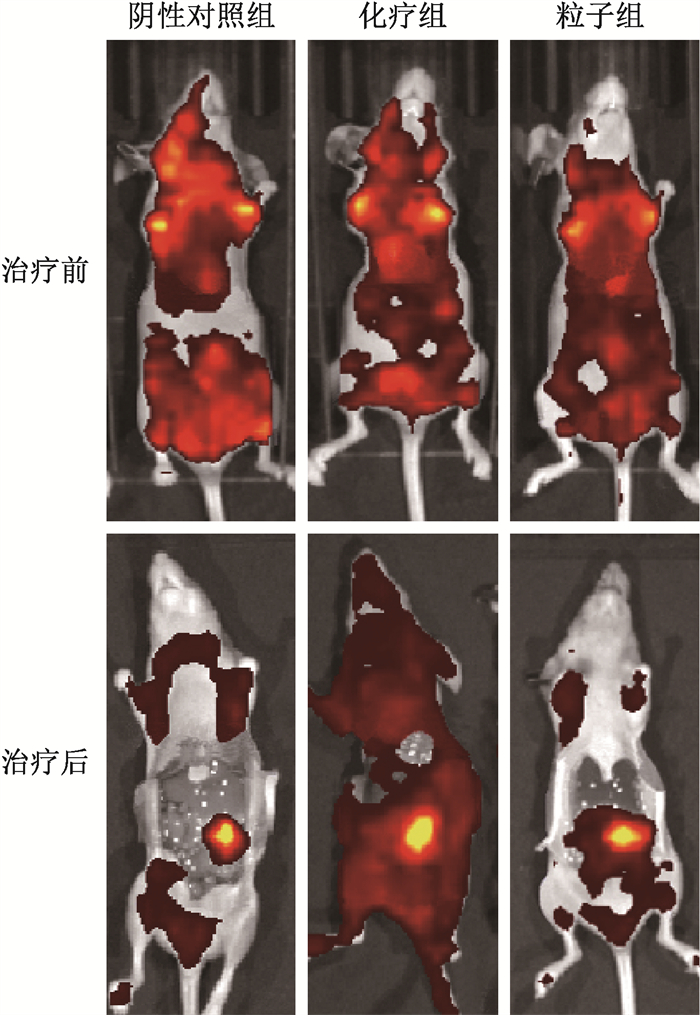
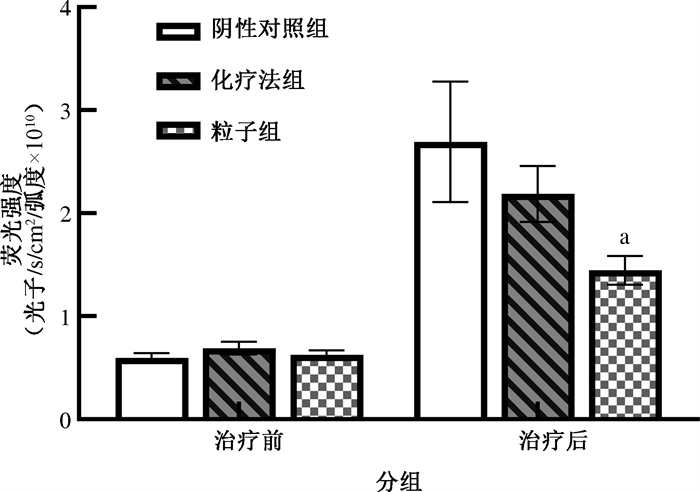
(1) 荧光强度分析:腹腔灌注治疗后粒子组、化疗组和阴性对照组的腹膜转移瘤荧光强度分别为(1.45±0.19)×1010、(2.21±0.36)×1010和(2.63±0.79)×1010,3组比较差异有统计学意义(F=6.09,P=0.029),阴性对照组荧光强度大于粒子组(P=0.025)。3组卵巢癌腹膜转移治疗前后荧光成像见图 2。粒子组和化疗组的TGI分别为35.6%和18.6%。
|
图 2 卵巢癌腹膜转移瘤荷瘤鼠荧光显像 Figure 2 Fluorescence imaging of peritoneal metastasis of ovarian cancer in tumor bearing mice |
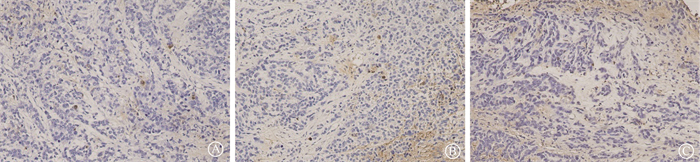
(2) 细胞凋亡率比较:粒子组、化疗组和阴性对照组的肿瘤细胞细胞凋亡率分别为(14.07±6.99)%、(11.97±3.63)%和(1.40±0.88)%,3组比较差异有统计学意义,粒子组和化疗组的AI均高于阴性对照组(F= 9.96,P= 0.009),见图 3。
|
图 3 各组荷瘤鼠腹膜转移瘤细胞凋亡情况 TUNEL染色 ×200 A.阴性对照组;B.化疗组;C.粒子组 Figure 3 Apoptosis of peritoneal metastatic tumor cells in tumor bearing mice in each group TUNEL staining ×200 A. Negative control group; B. Chemotherapy group; C. Particle group |
(3) Ki67指数比较:粒子组、化疗组和阴性对照组的Ki67指数分别为17.39±7.94、20.09±8.10和32.19±8.63,3组比较差异有统计学意义,粒子组和化疗组的Ki67指数均低于阴性对照组(F= 9.93,P= 0.013),见图 4。
|
图 4 各组荷瘤鼠腹膜转移瘤细胞Ki67增殖情况 免疫组织化学法染色 ×200 A.阴性对照组;B.化疗组;C.粒子组 Figure 4 Proliferation of peritoneal metastatic tumor cells Ki67 in tumor bearing mice in each group Immunohistochemistry staining ×200 A. Negative control group; B. Chemotherapy group; C. Particle group |
(4) 腹水体积:粒子组、化疗组和阴性对照组给药治疗后后腹水体积分别为(0.34±0.11)、(0.31±0.14)和(0.77±0.09)ml,3组比较差异有统计学意义,粒子组和化疗组腹水体积均小于阴性对照组(F= 13.43,P= 0.006)。
5.安全性评价:粒子组的血常规和肝功能无明显异常,肝脏、脾脏、小肠和结肠的HE病理检测均未见明显异常。
讨论腹腔注射放射性药物治疗卵巢癌腹膜转移和腹水已有近50年的历史。早期的32P胶体不溶于体液,注射后可以附着于体腔内壁或脏器表面进行放射性治疗,但缺乏靶向效应使其最大剂量受限[5-6]。后续研究的核素标记抗体类药物可以靶向治疗,但在腹腔内停留和作用时间较短,不易体现局部治疗优势[10-11]。基于上述思考,本研究制备了具有靶向性、同时可在腹腔环境中滞留和降解吸收的177Lu-FA-DOTA-PEG-PLGA纳米粒子,并进行腹腔灌注治疗卵巢癌腹膜转移灶和腹水的体内实验探索。
FR是一种糖基磷脂酰肌醇耦联蛋白,主要包括α、β、γ和δ 4种亚型。由于90%的卵巢癌肿瘤细胞表面FRα受体数量、叶酸(folate acid,FA)耦联物亲和性及受体活性远超正常细胞[12],FR已经成为卵巢癌靶向显像及治疗的良好靶点[13-14]。基于PEG可共价结合叶酸配体及其类似物[15]的特性,本研究以共价连接方式制备了FA-DOTA-PEG-PLGA纳米载体,以此增加粒子在肿瘤的靶向聚集和滞留。本研究中,micro-SPECT/CT显像可见静脉给药后4 h卵巢癌移植瘤出现放射性高摄取,24 h到达高峰,表明粒子入血后快速进入肿瘤,不仅具有明显的主动靶向效应,较短的入瘤时间也使得放射性核素可以更好地发挥作用。因此,相较于传统的非靶向性放射性胶体,177Lu-FA-DOTA-PEG-PLGA纳米粒子可以更为有效地进入腹腔转移病灶进行治疗,少部分脱离腹腔的药物还可以靶向进入其他组织肿瘤病灶进行二次治疗,在获得循环再利用同时减少不良反应。
腹腔腹膜是一种双向半透性膜,含有丰富的毛细血管和淋巴管,仅允许水、电解质和一些小分子物质通过。177Lu-FA-DOTA-PEG-PLGA纳米粒子最初进入腹腔时呈大分子物质状态(粒径20~80 nm),不可通过腹膜进入体内其他组织,但随着粒子基质PLGA结构逐渐溶蚀分解[16],粒子降解为小分子片段,随后腹膜毛细血管和淋巴管对其进行吸收,部分片段在主动或被动靶向效应引导下进入肿瘤,其余则通过肾脏尿液排出体外。本研究中,粒子离开腹腔后首先进入血液循环,因此,血液放射性分布可以间接反映粒子的吸收交换情况,组织分布显示血液第24和72小时持续放射性摄取,而至第7天出现清除现象,表明粒子至少在72 h内持续入血,腹腔内停留时间亦大于该时间段。另外,肾脏的放射性摄取逐渐下降,提示粒子的清除速度稳定。基于上述分析,本研究粒子的降解吸收过程不仅保证了充分的腹腔内停留时间,还提供了较为平稳的代谢清除速度。
进一步的腹腔注射177Lu-FA-DOTA-PEG-PLGA纳米粒子治疗腹膜转移瘤和腹水结果显示,粒子组和化疗组均不同程度的抑制肿瘤生长,其中粒子组疗效更为显著。TUNEL法检测结果表明粒子组和化疗组均能诱导肿瘤细胞发生凋亡。Ki67指数反映了肿瘤细胞的增殖活性,与卵巢癌的预后密切相关,免疫组织化学检测提示粒子组和化疗组均可抑制肿瘤增殖。值得注意的是,尽管粒子组的AI和Ki67指数与化疗组比较差异无统计学意义,但均呈现更为有利的数值趋势,如能提高放射性药物剂量,粒子组可能会体现更好的诱导凋亡和抑制肿瘤增殖效应。另外,粒子治疗还表现出与化疗类似的腹水治疗效果,这对改善症状和减少复发具有重要价值。
除了前述的靶向和腹腔内滞留特性,177Lu-FA-DOTA-PEG-PLGA纳米粒子可能还具有其他一些治疗优势:①177Lu的β射线射程为2 mm,具有一定作用范围和穿透性(软组织内约0.2~0.3 mm),在腹腔等密闭狭小环境,尤其一些隐匿部位,更易发挥放射线的“交叉效应”。例如肝脏和脾脏包膜是卵巢癌腹膜种植转移好发区域,但是由于位置较高和腔道深窄,不易形成局部药物高浓度。纳米粒子注射后,除了腹腔内药物照射治疗,肝脾摄取的纳米粒子也可以对肝脾包膜及邻近区域进行肿瘤杀伤。②纳米粒子表面的聚乙二醇(PEG)长链吸附大量水分子,并维持小粒径、单分散、稳定存在的状态,进而增加肿瘤部位的被动靶向聚集,同时PEG使粒子进入肿瘤细胞后不易脱离,从而长期滞留在细胞内[17]。
综上所述,本研究纳米粒子进入腹腔后滞留并缓慢降解释放,靶向效应促其进入肿瘤细胞并增加腹腔外组织所含药物的再利用,从而加强疗效并减少不良反应。目前,基于靶向受体设计的腹膜转移瘤放射性纳米粒子灌注治疗国内外鲜有报道,该模式为卵巢癌腹膜转移和腹水诊疗一体化提供了新思路和新方法。实验工作仍有一些问题亟待解决,包括全身和腹腔联合给药、最佳剂量、多次给药的长期疗效和安全性问题,纳米载体的缓慢和可控释放,后续将进一步开展研究。
利益冲突 所有作者均声明不存在利益冲突,在此对研究的独立性和科学性予以保证
作者贡献声明 王坚负责实验数据整理分析和论文审阅;何敏、彭鸣亚、赵曼负责实验操作及论文撰写;赵骏负责论文的设计和实验指导
| [1] |
Webb PM, Jordan SJ. Epidemiology of epithelial ovarian cancer[J]. Best Pract Res Clin Obstet Gynaecol, 2017, 41: 3-14. DOI:10.1016/j.bpobgyn.2016.08.006 |
| [2] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [3] |
孔德娟, 刘晓冬, 梁冰, 等. 分割剂量电离辐射对卵巢癌细胞多药耐药的影响[J]. 中华放射医学与防护杂志, 2012, 32(1): 35-39. Kong DJ, Liu XD, Liang B, et al. Effect of fractionated radiation on multidrug resistance in human ovarian cancer[J]. Chin J Radiol Med Prot, 2012, 32(1): 35-39. DOI:10.3760/cma.j.issn.0254-5098.2012.01.008 |
| [4] |
Pignata S, Cecere SC, Du Bois A, et al. Treatment of recurrent ovarian cancer[J]. Ann Oncol, 2017, 28(suppl 8): ⅷ51-ⅷ56. DOI:10.1093/annonc/mdx441 |
| [5] |
Flores-Balcázar CH, Urías-Arce DM. Radiotherapy in women with epithelial ovarian cancer: historical role, current advances, and indications[J]. Chin Clin Oncol, 2020, 9(4): 49. DOI:10.21037/cco-20-10 |
| [6] |
Boye E, Lindegaard MW, Paus E, et al. Whole-body distribution of radioactivity after intraperitoneal administration of 32P colloids[J]. Br J Radiol, 1984, 57(677): 395-402. DOI:10.1259/0007-1285-57-677-395 |
| [7] |
Young RC, Brady MF, Nieberg RK, et al. Adjuvant treatment for early ovarian cancer: a randomized phase Ⅲ trial of intraperitoneal 32P or intravenous cyclophosphamide and cisplatin--a gynecologic oncology group study[J]. J Clin Oncol, 2003, 21(23): 4350-4355. DOI:10.1200/JCO.2003.02.154 |
| [8] |
冯晓玲, 孙佳宁, 赵小萱. 红景天苷联合顺铂对人卵巢癌SKOV-3裸鼠移植瘤生长影响及其机制研究[J]. 中华中医药杂志, 2021, 36(7): 3851-3855. Feng XL, Sun JN, Zhao XX. Effects of salidroside combined with cisplatin on growth of ovarian cancer cell SKOV-3 in nude mice and its mechanism[J]. Chin J Tradit Chin Med Pharm, 2021, 36(7): 3851-3855. |
| [9] |
曾成润, 夏雨霄, 傅文会, 等. 177Lu-NOTATATE的制备及初步生物学评价[J]. 中华核医学与分子影像杂志, 2021, 41(11): 670-675. Zeng CR, Xia YX, Fu WH, et al. Preparation and preliminary biological evaluation of 177Lu-NOTATATE[J]. Chin J Nucl Med Mol Imaging, 2021, 41(11): 670-675. DOI:10.3760/cma.j.cn321828-20200617-00234 |
| [10] |
Alvarez RD, Huh WK, Khazaeli MB, et al. A phase I study of combined modality 90Y-CC49 intraperitoneal radioimmunotherapy for ovarian cancer[J]. Clin Cancer Res, 2002, 8(9): 2806-2811. DOI:10.1159/000063870 |
| [11] |
Buchsbaum DJ, Khazaeli MB, Axworthy DB, et al. Intraperitoneal pretarget radioimmunotherapy with CC49 fusion protein[J]. Clin Cancer Res, 2005, 11(22): 8180-8185. DOI:10.1158/1078-0432.CCR-05-0607 |
| [12] |
Kalli KR, Oberg AL, Keeney GL, et al. Folate receptor alpha as a tumor target in epithelial ovarian cancer[J]. Gynecol Oncol, 2008, 108(3): 619-626. DOI:10.1016/j.ygyno.2007.11.020 |
| [13] |
Kelemen LE. The role of folate receptor alpha in cancer development, progression and treatment: cause, consequence or innocent bystander?[J]. Int J Cancer, 2006, 119(2): 243-250. DOI:10.1002/ijc.21712 |
| [14] |
He ZY, Deng F, Wei XW, et al. Ovarian cancer treatment with a tumor-targeting and gene expression-controllable lipoplex[J]. Sci Rep, 2016, 6: 23764. DOI:10.1038/srep23764 |
| [15] |
Rangger C, Helbok A, von Guggenberg E, et al. Influence of PEGylation and RGD loading on the targeting properties of radiolabeled liposomal nanoparticles[J]. Int J Nanomedicine, 2012, 7: 5889-5900. DOI:10.2147/IJN.S36847 |
| [16] |
Arora G, Shukla J, Ghosh S, et al. PLGA nanoparticles for peptide receptor radionuclide therapy of neuroendocrine tumors: a novel approach towards reduction of renal radiation dose[J]. PLoS One, 2012, 7(3): e34019. DOI:10.1371/journal.pone.0034019 |
| [17] |
Hong RL, Huang CJ, Tseng YL, et al. Direct comparison of liposomal doxorubicin with or without polyethylene glycol coating in C-26 tumor-bearing mice: is surface coating with polyethylene glycol beneficial?[J]. Clin Cancer Res, 1999, 5(11): 3645-3652. |
 2022, Vol. 42
2022, Vol. 42


