2. 中山大学肿瘤防治中心放疗科 华南肿瘤学国家重点实验室 肿瘤医学协同创新中心, 广州 510060;
3. 广州医科大学附属肿瘤医院放疗中心, 广州 510095;
4. 中国科学技术大学核医学物理研究所, 合肥 210027
2. State Key Laboratory of Oncology in South China, Collaborative Innovation Center for Cancer Medicine, Department of Radiation Oncology of Sun Yat-sen University Cancer Center, Guangzhou 510060, China;
3. Radiotherapy Center, Affiliated Tumor Hospital of Guangzhou Medical University, Guangzhou 510095, China;
4. Nuclear Medical Physics Institute, University of Science and Technology of China, Hefei 210027, China
鼻咽癌(nasopharyngeal carcinoma, NPC)是我国华南地区常见恶性肿瘤之一[1-4]。放射治疗是NPC治疗的重要手段[5]。而调强放射治疗(intensity modulated radiation therapy, IMRT)已经成为NPC治疗中的主流技术[6-10]。考虑到鼻咽癌计划复杂,IMRT对精度要求较高,因此质量保证显得尤为重要[11-14]。为确保治疗计划的安全性、准确性和有效性,需完成剂量验证等质量保证(quality assurance,QA)工作[15-16]。目前计划验证的常用方法,一种是基于测量的剂量验证,如使用电离室、胶片或二维平板探测器阵列,以及用三维点阵探测器或凝胶剂量计测量三维体积剂量。该方法需将计划移植到模体CT上,且需人工摆位,可能引入摆位误差,而均质的模体无法反映患者实际解剖结构。另一种是基于计算的独立验证,利用治疗计划或加速器日志文件,搭配独立剂量算法重新计算患者CT上的三维剂量分布。现有的独立验算软件有SciMoCa、MIM SureCalc、Mobius 3D、CloudMC、Dose CHECK、Compass、3-DVH等,这些软件多存在计算时间长、剂量算法条件受限等弊端[17-20]。ArcherQA是一套新型蒙特卡罗剂量验证系统,基于图形处理器(GPU)平台,具有耗时短、精准度高等优点。考虑到NPC患者数量多,机器负荷重,使用ArcherQA可作为临床计划验证的一种新手段。目前国内关于ArcherQA这一新型独立验算系统的应用研究较少,尤其在NPC方面。因此,本研究将针对鼻咽癌放疗计划,应用ArcherQA实现IMRT计划的独立三维剂量验证。
资料与方法1. 患者资料:回顾性选取2021年6月至10月在中山大学肿瘤防治中心接受治疗的105例鼻咽癌患者,男女性别比例为26 ∶9,年龄19~81岁,平均年龄47岁,<30岁的有8例,31~70岁的有94例,>70岁的有3例。
2. 治疗计划设计:所有患者的放疗计划均在Varian Eclipse(V15.6.8)计划系统中设计,其中89例为旋转容积调强放疗(VMAT)计划,16例为动态调强放疗(DMLC)计划,均采用各向异性解析剂量算法(AAA),能量选为6 MV模式,其中IMRT计划射野布置为9野均分。对于VMAT计划,靶区剂量为:大体肿瘤体积(GTV)6 996~7 000 cGy/33次;左侧转移的区域淋巴结(GTVnd-L)6 996 cGy/33次或6 600 cGy/33次;右侧转移的区域淋巴结(GTVnd-R)6 996 cGy/33次或6 600 cGy/33次;原发灶周围及阳性淋巴结引流区(CTV1)6 006 cGy/33次;预防照射的淋巴引流区(CTV2)5 400 cGy/33次。外扩3 mm作为相应的计划靶体积(PTV)。对于DMLC计划,大部分与VMAT计划处方一致,但其中有7例DMLC计划为分段推量计划,计划大体肿瘤体积(PGTV)的处方为6 216 cGy/28次+888 cGy/4次。根据临床实践指南与经验、美国医学物理师协会(AAPM)报告,危及器官的限值为:眼晶状体Dmax<800 cGy,眼球Dmean<3 500 cGy,视神经Dmax<5 400 cGy,视交叉Dmax<5 400 cGy,海马Dmax<2 000 cGy,Dmean<1 000 cGy,脑干Dmax<5 400 cGy,脊髓Dmax<4 500 cGy,腮腺Dmean<3 000 cGy,甲状腺Dmean<4 500 cGy或V50<70%,气管Dmean<4 500 cGy。
3. 治疗设备与验证软件:所有病例均在美国Varian公司的VitalBeam直线加速器上完成放疗。所有治疗计划均通过Portal Dosimetry(PD)执行治疗前测量验证。PD主要利用电子射野影像系统(EPID)模块采集射野图像,借助射野剂量图像预测算法来重建出二维剂量分布,并将其叠加后的结果与Eclipse系统计算结果进行比较,通过γ分析来评估患者IMRT计划的剂量准确性。PD测量验证过程中无需用到模体,也没有涉及到患者的解剖结构,仅用于射野剂量预测和评价。
独立验算软件ArcherQA由中国科学技术大学核医学物理研究所与安徽慧软公司合作研发,采用了基于GPU平台的高精度的蒙特卡罗剂量计算引擎[21]。蒙特卡罗算法是辐射剂量计算中的金标准,在计算患者治疗计划时需要模拟大量的粒子,非常耗时。ArcherQA充分利用了GPU高性能计算平台,对蒙特卡罗算法进行GPU加速,针对人体内输运,ArcherQA采用NVIDIA 1080Ti GPU比使用i7-8700K CPU的计算速度快3.3倍[21]。该软件可以实现基于患者的CT数据,重新计算患者体内的三维剂量分布,并给出独立验算结果与计划剂量之间的总体γ通过率、选定感兴趣区域的三维γ通过率、剂量-体积直方图(DVH)对比等结果,并给出完整的临床评估报告。
4. 研究方法
(1) 基于PD测量的射野验证:在Eclipse计划系统里创建QA计划,验证模式选择Portal Dose Prediction,默认设置EPID的测量位置的源皮距(SSD)为100 cm,调用PD预测算法计算射野的剂量分布。然后通过MOSAIQ网络传输系统打开患者治疗计划,在QA模式下执行,同时将EPID伸出到SSD=100 cm的位置,在计划执行端为每个照射野添加Integrated image,选择MV模式,治疗出束中采集射野剂量。测量完成后,将采集的图像数据导入Eclipse计划系统,在对应的QA计划中每个射野下添加采集的射野图像,然后在Portal Dosimetry模块中产生合成剂量图像。将PD获取的剂量图像与Eclipse计算的结果进行自动配准,并执行二维的γ分析,设置条件为3 mm/3%,阈值为10%[22],绝对剂量模式,计算γ通过率。
(2) 基于ArcherQA软件的独立验证:首先,在Eclipse计划系统中将患者的CT影像数据和计划数据以DICOM文件形式传输至ArcherQA软件服务器端,然后将数据导入ArcherQA的患者数据库中,打开对应的患者病例,核对患者信息,确认无误后,点击计划核查按钮,软件会根据原始计划参数自动调用蒙特卡罗计算引擎完成计划的独立验算,双弧VMAT计划的计算时间为33 s左右,9野DMLC计划的计算时间在20 s以内。计算完成后,软件界面中会显示独立验算后的各种结果信息,包括验算的三维剂量分布、计划参数比较、整体γ通过率(3 mm/3%,阈值为10%)、感兴趣区域ROI的γ通过率、DVH曲线、各靶区覆盖信息、射束信息、临床目标等,最后可创建QA报告。
根据PD测量和ArcherQA计算得到的结果数据,分析比较二者整体γ通过率的差异、ArcherQA与Eclipse计划系统在靶区和危及器官剂量学上的差异、靶区与危及器官的三维γ通过率。ArcherQA计算结果与TPS计算值之间的剂量差异采用式(1)进行计算:
| $ \begin{array}{l} \;\;\;\;\;\;\;\;\;\;剂量差异\left( \% \right) = \\ \left( {{\rm{Dos}}{{\rm{e}}_{{\rm{\_ArcherQA }}}} - {\rm{Dos}}{{\rm{e}}_{{\rm{\_TPS}}}}} \right)/{D_{\max }} \times 100\% \end{array} $ | (1) |
5. 统计学处理:采用SPSS 25.0软件进行均值分析,所选DVH指标符合正态分布,用x±s表示。采用配对样本t检验,P<0.05为差异具有统计学意义。
结果1. 两种验证方式γ通过率的差异:图 1为105例NPC患者的整体γ通过率情况,3 mm/3%标准下,采用PD测量分析出的平均γ通过率为(99.49±0.78)%,最小值为94.1%;ArcherQA计算得到的平均γ通过率为(99.04±1.01)%,除几例分段DMLC计划的通过率较低外(93%~95%),VMAT计划γ通过率均在95%以上。二者γ通过率差异具有统计学意义(t=-3.35,P<0.05)。第80例患者γ通过率最低,为93%,分析ArcherQA中γ通过率断层CT图可知,误差较大点位于气管、口腔、皮肤表面等空气介质较多的部位。
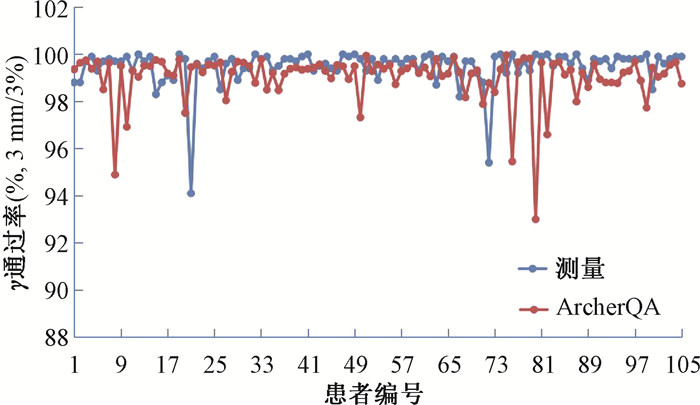
|
图 1 基于ArcherQA独立验算和PD测量的整体γ通过率对比 Figure 1 Comparison of the overall gamma passing rates between ArcherQA independent verification and PD measurements |
2. 靶区剂量差异:图 2显示了ArcherQA与TPS计算结果在靶区GTV内的剂量学差异,GTV Dmean的平均差异为(0.57±0.48)%,D90%的平均差异为(0.65±0.56)%,D90%的差异略高于Dmean的差异,因为靶区中平均剂量要比90%体积覆盖剂量要高,偏差以计划参考剂量(Dmax)为对比,所以实际D90%的差异更大。对于平均剂量,ArcherQA得出的剂量总体上要比TPS给出的剂量高;而对于D90%,情况则相反,ArcherQA计算的剂量低于TPS给出的值。
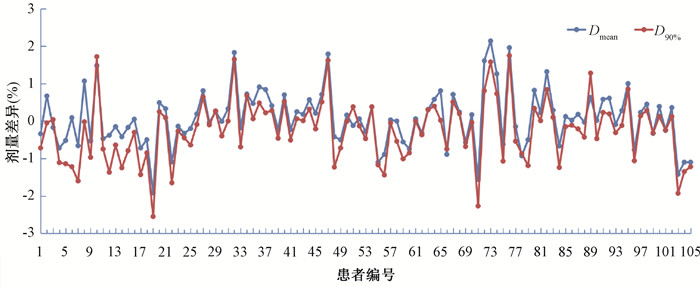
|
图 2 ArcherQA与Eclipse计算结果中关于GTV的Dmean和D90%剂量差异 Figure 2 Dosimetric differences in GTV (Dmean and D90%) between ArcherQA and Eclipse |
对于各靶区γ通过率,其中CTV1的平均γ通过率最高,为(97.88±2.44)%;CTV2最低,为(96.64±4.32)%,其余分别为GTV(97.67±3.43)%,GTVnd-L(97.80±4.35)%,GTVnd-R(97.82±4.07)%,均高于97.5%。对应的CTV1的Dmean平均差异值最小为(0.57±0.46)%;CTV2的Dmean平均差异值最大为(0.88±0.52)%。
各靶区平均剂量差异分别为CTV1(0.57±0.46)%,GTVnd-L(0.85±0.55)%,GTVnd-R(0.73±0.55)%,CTV2(0.88±0.52)%。从剂量差异曲线来看,GTV变化幅度最小,最稳定,依次为GTVnd-L、GTVnd-R、CTV1,CTV2稳定性最差;这与各靶区位置分布有一定关系,内层靶区结构位置相对稳定,外层靶区范围大,更容易出现波动。
3. 危及器官剂量差异:表 1列出了ArcherQA与Eclipse计算结果之间各危及器官的平均γ通过率以及平均剂量差异情况,从各器官整体γ通过率来看,除气管为(87.86±10.42)%以外,其余各器官通过率均在99%以上,绝大多数超过了99.5%,左、右眼晶状体和左侧海马的γ通过率均为(100±0)%,脑干、左眼球、右侧海马、左侧腮腺、右侧腮腺通过率均在99.9%以上,气管的通过率最低且差异很大,这可能跟TPS的AAA解析算法与ArcherQA的蒙特卡罗算法的差异有关,二者在处理空气等密度较低的结构区域时存在较大差异,解析算法将其等效成水来处理,而蒙特卡罗算法模拟实际粒子与空气介质的相互作用,从而导致在不同患者气管内的剂量分布也会存在明显差异,且气管剂量差异二者具有统计学意义(t=-13.09,P<0.05)。通过对各器官Dmean差异值的分析可知,对于脑干、视交叉、右侧视神经ArcherQA得出的剂量值整体上要低于TPS值(t=4.01、4.82、2.83,P<0.05);对于眼球、眼晶状体、左侧腮腺、脊髓、甲状腺、气管来说,TPS值要低于ArcherQA得到的剂量值(t=-8.82、-6.46、-4.34、-14.62、-12.92、-13.09,P<0.05);对于右侧海马、左侧视神经和右侧腮腺,TPS与ArcherQA二者剂量值无明显高低差异(P>0.05)。从这些差异值上,可以给临床计划设计提供一个参考,即危及器官脑干等的剂量限值可以适当放宽一点,而脊髓等器官要比临床剂量限制更严格一点,从而相应提高靶区剂量覆盖和减小危及器官风险。
|
|
表 1 Eclipse TPS与ArcherQA计算各危及器官γ通过率与剂量差异(%,x±s) Table 1 Differences of Dmean and γ passing rates for OARs calculated by the Eclipse TPS and ArcherQA (%, x±s) |
讨论
基于均匀模体的测量验证依然是IMRT计划剂量验证的主要方式,但测量过程比较繁琐,需要占用较多的机时,而且无法反映患者体内照射的剂量分布情况。因此,有必要研发快速、精准且能考虑患者解剖信息的剂量验证方法。独立验证软件可以基于治疗计划为患者提供独立的三维剂量验证,操作更简便,节省机时,不会引入人为操作的误差。基于蒙特卡罗算法的ArcherQA独立验证软件相比于其他软件具有独特的优势,在算法方面,Mobius 3D采用卷积叠加算法,DoseCHECK采用筒串卷积算法,而ArcherQA采用蒙特卡罗算法[18-21]。对比SciMoCa软件,ArcherQA的通用蒙特卡罗算法不受材料属性、截止能量、最小输运尺寸的限制;相比于MIM SureCalc软件的5 min与CloudMC软件的20 min,ArcherQA不到40 s的计算速度具有很大优势;耗时是蒙特卡罗算法在临床应用中的最大弊端,而ArcherQA利用GPU进行加速,运算速度大幅提高,随着硬件更新升级,双弧VMAT计划计算时间在33 s左右,9野DMLC计划计算时间在20 s以内。相对于TPS计划系统,蒙特卡罗(MC)算法只需几分钟到十几分钟,节约不少时间,提高了计算效率。ArcherQA可以与治疗计划系统建立端口连接,TPS上做完计划后可传输到ArcherQA端进行计划的独立验证计算。对于临床工作量大的科室,为保证计划质量,ArcherQA为患者治疗前剂量验证提供了一个好的选择,同时不占用加速器治疗时间,能够降低加速器的工作负荷,为患者节约出更多的治疗时间。
在算法模型方面,ArcherQA软件也有其独到之处,对于加速器机头中次级准直器以上的部件,使用了虚拟源替代,主要包括初级、次级光子源和污染电子源。采用相空间环的方式,将相空间压缩描述为虚拟源的相关参数,用一系列函数进行解析定义,能够有效生成粒子,各参数也方便调试且具有较好的鲁棒性,非常适合不同医用加速器的模型构建和调试。同时其所采用的通用型蒙特卡罗算法,完整考虑了光子与物质相互作用的3种方式:光电效应、康普顿散射、电子对生成,保证了剂量计算的精准度。
徐遥等[21]对VarianTrueBeam机型和Elekta Axesse机型做了相关建模研究,模拟了水中剂量参数,其侧重点主要集中在软件优化上,涉及到的患者病例很少且没有针对性。而本研究侧重于软件的临床应用,并选择大量NPC患者。目前,临床上广泛采用的剂量验证方式为二维剂量验证,三维验证很困难,而ArcherQA是可以实现基于患者真实解剖结构的三维剂量验证,可作为一种辅助的验证工具,是二维剂量验证的一种补充。本研究比较了二者的γ通过率结果。对于患者计划验证的整体γ通过率,ArcherQA独立验算结果与PD二维测量结果进行了比较,总体上差异在5%以内,绝大部分在3%以内,ArcherQA独立验算的通过率普遍要低一点,这与独立验算的算法有关,它充分考虑了人体解剖结构的各向异性,而PD测量仅为二维平面剂量的比较,相对来说,ArcherQA的比较更为全面,也更能真实反映患者体内剂量分布情况。另外,ArcherQA与Eclipse的算法本质上存在差异,ArcherQA使用了蒙特卡罗算法,而Eclipse则采用了AAA解析算法,在处理人体非均匀介质时差别较大,鼻咽癌计划解剖结构非常复杂,包含大量的空腔和骨性结构区域,非均匀性程度很高,因此在计算γ通过率时也会相对偏低。对于DMLC治疗方式的通过率要比VMAT治疗方式通过率低一点,这可能与Eclipse TPS AAA解析算法对VMAT与IMRT不同治疗方式存在处理差异有关。最低通过率为80号病例的93%,该病例TPS计划为9野DMLC计划,通过分析ArcherQAγ通过率CT图像可知,误差主要集中在气管、口腔、皮肤表面等空气介质区域,进一步表明解析算法与蒙卡算法对于空气等低密度介质交界面存在差异,但总体剂量结果也能够满足临床要求。通过对比ArcherQA与TPS各ROI数据结果可知,各靶区γ通过率越高对应平均剂量差异越小。ArcherQA能对各危及器官给出相应的γ通过率和剂量差异,为临床评估各危及器官的风险提供了参考。即使对于小体积的危及器官,也能给出较好的通过率结果,比如左右眼晶状体的平均γ通过率为100%。危及器官中气管的通过率最低,这主要是因为气管中气体比较多,而AAA解析算法与MC算法对空气介质的等效处理方面存在显著差异,从而导致剂量差异比较明显。相比较而言,ArcherQA中采用的通用型蒙特卡罗算法,更为精准地模拟了粒子与空气的相互作用,因此相比于TPS,ArcherQA能够提供更为准确的气管内剂量分布结果,为临床上带来更为真实的评估参考。
由于国内各医疗中心诊疗情况有很大差异,故建议对于一些患者数量多、工作负荷重的中心,在IMRT治疗实施前开展独立验算,这样不占用机时,又可以作为一种有效的验证手段。对于普通IMRT计划,可以每个都做独立验算,等机器空闲时,再挑选一部分补充测量验证,这样有利于提高工作效率。
总之,ArcherQA独立验证系统可以为鼻咽癌放疗计划的剂量验证提供一个精准、高效、便捷的选择,能在提高工作效率的同时,提供三维剂量分布及γ通过率,还能给出体内各感兴趣区域的γ通过率和DVH对比,可以作为一种补充的验证手段,为临床放疗提供准确的质量保证,减少放疗患者治疗前的等待时间,不占用直线加速器的治疗时间,让更多放疗患者受益。
利益冲突 无
志谢 感谢中山大学附属肿瘤医院提供的平台和各位老师的指导
作者贡献声明 王鹏辉负责方案执行、数据分析和论文撰写;宫帅负责课题指导和论文修改;丁寿亮、王勐负责计划设计和论文修改;阳露参与数据处理与论文修改;裴曦参与数据支持与应用指导;黄晓延参与临床质量控制指导;刘红冬负责课题构思、流程指导以及论文修改
| [1] |
崔念基, 卢泰祥, 邓小武, 等. 第二届全国鼻咽癌放射治疗学术会议纪要[J]. 中华放射肿瘤学杂志, 2003, 12(1): 71-72. Cui NJ, Lu TX, Deng XW, et al. Summary of the Second National Academic Conference on radiotherapy for nasopharyngeal carcinoma[J]. Chin J Radiat Oncol, 2003, 12(1): 71-72. DOI:10.3760/j.issn.1004-4221.2003.01.026 |
| [2] |
Tang LL, Huang CL, Zhang N, et al. Elective upper-neck versus whole-neck irradiation of the uninvolved neck in patients with nasopharyngeal carcinoma: an open-label, non-inferiority, multicentre, randomised phase 3 trial[J]. Lancet Oncol, 2022, 23(4): 479-490. DOI:10.1016/S1470-2045(22)00058-4 |
| [3] |
Yu CL, Fielding R, Chan CL, et al. Chinese nasopharyngeal carcinoma patients treated with radiotherapy: association between satisfaction with information provided and quality of life[J]. Cancer, 2001, 92(8): 2126-2135. DOI:10.1002/cncr.1554 |
| [4] |
Zhang Y, Chen L, Hu GQ, et al. Gemcitabine and cisplatin induction chemotherapy in nasopharyngeal carcinoma[J]. N Engl J Med, 2019, 381(12): 1124-1135. DOI:10.1056/NEJMoa1905287 |
| [5] |
徐国镇, 罗京伟. 鼻咽癌治疗的进展[J]. 中华耳鼻咽喉科杂志, 2004, 39(8): 509-512. Xu GZ, Luo JW. Advances in the treatment of nasopharyngeal carcinoma[J]. Chin J Otolaryngol, 2004, 39(8): 509-512. DOI:10.3760/j.issn.1673-0860.2004.08.028 |
| [6] |
Hendee WR, Herman MG. Improving patient safety in radiation oncology[J]. Pract Radiat Oncol, 2011, 1(1): 16-21. DOI:10.1016/j.prro.2010.11.003 |
| [7] |
胡逸民. 肿瘤放射物理学[M]. 北京: 原子能出版社, 1999. Hu YM. Radiation oncology physics[M]. Beijing: Atomic Energy Press, 1999. |
| [8] |
Masi L, Casamassima F, Doro R, et al. Quality assurance of volumetric modulated arc therapy: evaluation and comparison of different dosimetric systems[J]. Med Phys, 2011, 38(2): 612-621. DOI:10.1118/1.3533900 |
| [9] |
Emami B, Sethi A, Petruzzelli GJ. Influence of MRI on target volume delineation and IMRT planning in nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys, 2003, 57(2): 481-488. DOI:10.1016/s0360-3016(03)00570-4 |
| [10] |
Teh BS, Woo SY, Butler EB. Intensity modulated radiation therapy(IMRT): a new promissing technology in radiation oncology[J]. Oncologist, 1999, 4(6): 433-442. DOI:10.1634/theoncologist.4-6-433 |
| [11] |
Palta JR, Mackie TR, Chen Z. Intensity-modulated radiation therapy-the state of the art[J]. Med Phys, 2003, 30(12): 3265-3265. DOI:10.1118/1.1628279 |
| [12] |
Otto K. Volumetric modulated arc therapy: IMRT in a single gantry arc[J]. Med Phys, 2008, 35(1): 310-317. DOI:10.1118/1.2818738 |
| [13] |
Wolff D, Stieler F, Welzel G, et al. Volumetric modulated arc therapy (VMAT) vs serial tomotherapy, step-and-shoot IMRT and 3D-conformal RT for treatment of prostate cancer[J]. Radiother Oncol, 2009, 93(2): 226-233. DOI:10.1016/j.radonc.2009.08.011 |
| [14] |
Chen S, Yi BY, Yang X, et al. Optimizing the MLC model parameters for IMRT in the RayStation treatment planning system[J]. J Appl Clin Med Phys, 2015, 16(5): 322-332. DOI:10.1120/jacmp.v16i5.5548 |
| [15] |
Miften M, Olch A, Mihailidis D, et al. Tolerance limits and methodologies for IMRT measurement-based verification QA: Recommendations of AAPM Task Group No. 218[J]. Med Phys, 2018, 45(4): e53-e83. DOI:10.1002/mp.12810 |
| [16] |
Hodapp N. The ICRU Report 83. Prescribing, recording and reporting photon-beam intensity-modulated radiation therapy (IMRT)[J]. Strahlenther Onkol, 2012, 188(1): 97-99. DOI:10.1007/s00066-011-0015-x |
| [17] |
Hoffmann L, Alber M, S hn M, et al. Validation of the Acuros XB dose calculation algorithm versus Monte Carlo for clinical treatment plans[J]. Med Phys, 2018, 45(8): 3909-3915. DOI:10.1002/mp.13053 |
| [18] |
Miras H, Jiménez R, Perales Á, et al. Monte Carlo verification of radiotherapy treatments with CloudMC[J]. Radiat Oncol, 2018, 13(1): 99. DOI:10.1186/s13014-018-1051-9 |
| [19] |
Nakaguchi Y, Nakamura Y, Yotsuji Y. Validation of secondary dose calculation system with manufacturer-provided reference beam data using heterogeneous phantoms[J]. Radiol Phys Technol, 2019, 12(1): 126-135. DOI:10.1007/s12194-019-00499-6 |
| [20] |
Ahmed S, Hunt D, Kapatoes J, et al. Validation of a GPU-Based 3D dose calculator for modulated beams[J]. J Appl Clin Med Phys, 2017, 18(3): 73-82. DOI:10.1002/acm2.12074 |
| [21] |
徐遥, 徐榭, 裴曦. 外照射光子放疗虚拟源建模方法及其在剂量验证中的临床应用[D]. 北京: 中国科学技术大学, 2021. Xu Y, Xu X, Pei X. Method of virtual source modeling for external photon radiotherapy and its clinical application in dose checking[D]. Beijing: University of Science and Technology of China, 2021. |
| [22] |
国家癌症中心/国家肿瘤质控中心. 调强放疗剂量验证实践指南[J]. 中华放射肿瘤学杂志, 2020, 29(12): 1021-1024. DOI: 10.3760/cma.j.cn113030-20200525-00273. National Cancer Center/National Cancer Center for Quality Control. Practice guideline of patient-specific dosimetric verification for intensity-modulated radiotherapy[J]. Chin J Radiat Oncol, 2020, 29(12): 1021-1024. DOI: 10.3760/cma.j.cn113030-20200525-00273. |
 2022, Vol. 42
2022, Vol. 42


