2. 四川省肿瘤医院·研究所放疗科 放射肿瘤学四川省重点实验室, 成都 610041
2. Department of Radiation Oncology, Sichuan Cancer Hospital & Institute, Radiation Oncology Key Laboratory of Sichuan Province, Chengdu 610041, China
在宫颈癌的近距离治疗中,通过步进式机械马达,改变192Ir放射源在施源器内的驻留位置与驻留时间得到相应的三维剂量分布[1-2]。放射源在病灶内自发衰变放出射线破坏肿瘤细胞的蛋白质结构,以达到治疗的效果。因放射源附近剂量分布的特点,肿瘤靶区受到高剂量照射的同时,远离放射源区域剂量能迅速跌落,避免危及器官受到高剂量的照射,提高局部控制率与治疗增益比[3]。与外照射治疗过程相似,患者在接受治疗期间先是由医生在放疗影像上勾画靶区与危及器官,然后物理师利用治疗计划系统(treatment planning system, TPS)设计符合要求的放疗计划。在三维近距离治疗中,单个分次的治疗平均时长为2~3 h,计划设计平均耗时20~40 min,患者因长时间等待器官位移引起施源器移动,导致实际治疗与计划产生差异降低治疗效果。放疗计划是由物理师不断调整优化函数设计得到,设计过程取决于个人经验技巧等主观因素。常用的优化算法包括正向、逆向优化算法以及几何优化算法等[4-6]。目前国内外学者在外照射的自动计划方面已做出较多研究,已部分实现治疗计划的自动化设计[7]。在提升计划质量的同时,大幅缩短设计时间,是未来放疗计划的自动化设计主要发展趋势。
目前,已经有学者将人工智能(artificial intelligence, AI)应用于近距离治疗中,主要包括靶区自动勾画、施源器分割与重建等方向[8-10]。Lei等[11]通过搭建回归网络模型预测前列腺癌近距离治疗中的剂量分布,从而确定插植施源器植入位置与深度,为临床插植提供参考。为实现宫颈癌近距离治疗计划自动化设计,本研究基于3D U-net建立卷积深度学习网络模型,根据患者的CT影像、解剖结构特征实现宫颈癌近距离治疗的3D剂量分布预测,为物理师在计划优化时提供基础,缩短患者等待时间,提高治疗增益比。
材料与方法1. 宫颈癌数据库: 收集2021年4月至9月就诊于四川省肿瘤医院的114例宫颈癌患者的近距离治疗计划组成数据集,按84 ∶11 ∶19划分为互斥的训练集、验证集、测试集,并且保证数据集中数据分布的一致性。数据集的患者按照TNM分期后,T1 ∶T2 ∶T3 ∶T4为13 ∶38 ∶45 ∶18,本研究经四川省肿瘤医院伦理委员会讨论批准,患者均签署了知情同意书。所有治疗均采用核磁施源器(核通part#189.730,医科达AB, 瑞典),CT的分辨率为1 mm × 1 mm × 3 mm。为了保证数据集的一致性,选择了同一病区的患者,并且患者解剖结构由临床经验丰富的放疗医师参考欧洲放射治疗与肿瘤协会(GEC-ESTRO)推荐的方案在CT引导下进行勾画[12]。包括高危临床靶区(high risk clinical target volume, HRCTV)与危及器官(organs at risk, OARs)。OARs包括膀胱、小肠、直肠、乙状结肠,HRCTV处方剂量为6 Gy。放疗计划的设计在Oncentra 4.3计划系统(医科达AB, 瑞典)上进行,采用模拟逆向退火结合图形与驻留时间优化的方式,剂量分布满足GEC-ESTRO建议的宫颈癌近距离放疗标准[13]。放疗计划的审核由主任物理师与主任医生共同完成。
2. 数据集预处理; 使用基于Python 3.8自主开发程序解析含有患者解剖结构和三维剂量分布信息的DICOM文件,并转换为各自的三维矩阵。为减小计算消耗,根据患者解剖结构位置信息,将CT矩阵裁剪为256 × 256 × 64大小的三维矩阵,使患者解剖结构和施源器信息位于矩阵的中心区域。在预处理过程中,用1、0.8、0.6、0.4、0.2分别对HRCTV、膀胱、直肠、小肠、乙状结肠的解剖结构进行标记。为了防止模型过拟合,调用了Pytorch的Albumentations库对训练集进行数据增强,包括旋转、缩放、裁剪与翻转等操作,训练集数据规模达到420 × 256 × 256 × 64。
因核磁施源器材料特性,设置CT值上限为350 HU与下限为-200 HU剔除范围外的CT信息减小深度学习模型计算负担,按照式(1)对CT数据进行归一化处理。归一化处理后,CT矩阵范围为-1到1之间。
| $ C T_{\rm {norm }}=a+\frac{b-a}{\max -\min } \times\left(C T_{\rm {clip }}-\min \right) $ | (1) |
式中,a=-1,b=1;CTnor为归一化的CT信息;CTclip为截断的CT信息;max、min为矩阵最大值、最小值。
与外照射不同,近距离治疗剂量梯度较大,为了让模型很好的学习极端数据特征[14],将剂量信息与CT信息匹配后按照式(2)将剂量矩阵按进行归一化至0到1。
| $ \begin{aligned} &D= \\ & \begin{cases}D_{0}, & D_{0} \leqslant 150 \% \times D_{\rm {prescription }} \\ \left(D_{0}-D_{\rm {prescription }}\right)^{1 / 2}, & D_{0}>150 \% \times D_{\rm {prescription }}\end{cases} \end{aligned} $ | (2) |
式中,D0为初始剂量信息,Dprescription=6 Gy为临床处方剂量。
3. 3D U-net模型及训练:本研究基于Pytorch 1.7.1平台搭建3D U-net深度学习网络模型,模型结构见图 1。
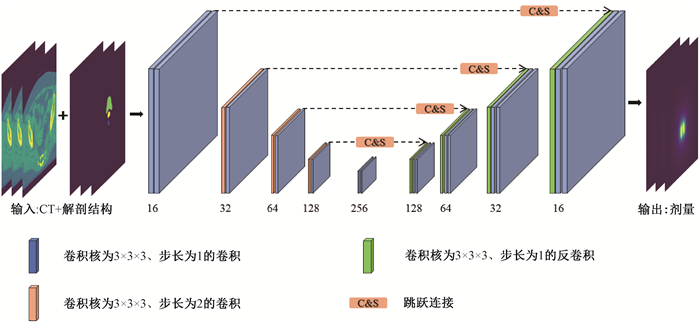
|
图 1 3D U-net剂量预测网络结构示意图 Figure 1 Schematic diagram showing the network structure of the dose prediction based on 3D U-net |
模型由编码器与解码器两部分组成,分别包括4个下采样层和4个上采样层,输入是由CT与解剖结构堆叠而成的2 × 256 × 256 × 64矩阵。下采样过程采用尺寸为3 × 3 × 3的卷积核,以步长为2的方式进行卷积,将模型的输出通道数翻倍。每层采样过程中的填充设置为1,采用ReLU激活函数,且每层都进行实例归一化处理作用于每个输出通道。将每次下采样的输出拼接为上采样的输入,通过跳跃连接将上层与下层信息进行拼接,防止特征信息丢失。最后采用1×1×1的卷积层将结果以1×256 × 256 × 64矩阵输出。
数据集在3个GPU(英伟达特斯拉P100-16 GB) 组成的服务器上进行训练,优化器采用自适应动量评估(adaptive momentum estimation,Adam)优化算法。训练模型时,输入为256 × 256 × 64的三维矩阵,连续训练500次,每次训练设置样本数为6,以均方误差(mean squared error, MSE)作为损失函数,模型每迭代14次后依据损失值保存迭代参数供测试集访问。
4. 剂量预测精确性评估: 将预测结果按照式(2)与逆向转换成剂量矩阵后,输出到DICOM文件。利用测试集中19例病例对训练模型进行评估,评估参数包括平均剂量偏差(mean dose deviation, MDD)与平均绝对剂量偏差(mean absolute dose deviation, MADD)[15]。计算见式(3)、(4):
| $ {\mathrm{MDD}}=\frac{1}{n} \sum{ }_{1}^{n} D_{\mathrm{c}}-D_{\mathrm{p}} $ | (3) |
| $ {\mathrm{MADD}}=\frac{1}{n} \sum\limits_{i}^{n}\left|D_{\rm{c}}-D_{\mathrm{p}}\right| $ | (4) |
式中,Dc为临床体素剂量,Gy;Dp为预测体素剂量,Gy;i为某个体素点;n为结构中总体素点。
采用戴斯相似性系数(Dice similarity coefficients, DSC)评估模型预测剂量与临床剂量相似度,研究1~9 Gy间隔为1 Gy各等剂量面的DSC[9]。DSC的计算如下:
| $ \begin{aligned} &D S C=\frac{2\left(C_{\mathrm{d}} \cap P_{\mathrm{d}}\right)}{C_{\mathrm{d}}+P_{\mathrm{d}}} \\ &d=\{1, 2, \cdots, 9 {\mathrm{~Gy}}\} \end{aligned} $ | (5) |
式中,Cd为临床剂量矩阵中高于d Gy的总体素;Pd为预测剂量矩阵高于d Gy的总体素。
处方剂量的靶区适形度指数(conformal index, CI)由式(6)得到,CI越接近1适形度越高[16]。
| $ C I=\frac{V_{\mathrm{T}, {\mathrm { prescription }}}}{V_{T}} \times \frac{V_{\mathrm{T}}, {\mathrm { prescription }}}{V_{\mathrm {prescription }}} $ | (6) |
式中,VT, prescription为满足HRCTV处方剂量体积,cm3;VT为HRCTV的体积,cm3;Vprescription为处方剂量的体积,cm3。
利用开源的放射学研究计算环境(computational environment for radiological research, CERR)[17]与自主编写的剂量-体积直方图(DVH)Table统计程序,研究比较模型预测剂量与临床治疗计划剂量中HRCTV与OARs的剂量学参数,包括靶区的Dj, j∈{mean, 90},危及器官的Dk, k∈{1 cm3, 2 cm3}。因不同的TPS计算结构边界函数存在差异,导致结构剂量学参数在不同的统计中存在偏差[18]。研究中统一采用DVH Table程序分别计算临床计划与预测结果的HRCTV与OARs剂量学参数。
研究预测结果与临床各参数之间的差异比,按下式进行计算:
| $ \Delta r=\frac{P_{\mathrm{p}}-P_{\mathrm{c}}}{P_{\mathrm{c}}} \times 100 \% $ | (7) |
式中,Δr为预测结果与临床计划参数的差异比;Pp为预测结果的参数;Pc为临床计划的参数。
5. 统计学处理:利用SPSS 22.0软件对各临床参数与预测参数展开统计学评估,结果以x±s表示。对预测结果与临床结果进行配对样本t检验。P < 0.05为差异有统计学意义。
结果模型经过17.5 h训练得到权重参数后,对测试集19例病例进行预测。随机选择1例患者,研究靶区等剂量线分布。横断面、冠状面、矢状面剂量分布如图 2所示,处方剂量(6 Gy)到150%处方剂量(9 Gy)区间分布均匀,预测的结果与临床计划剂量范围基本一致。临床与预测剂量差异分布图 2中显示相差部分比较集中,都分散在靶区中心区域与施源器附近。
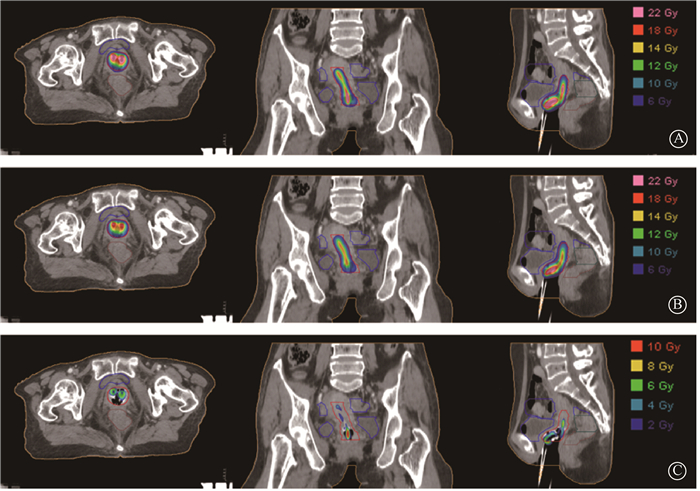
|
图 2 HRCTV的处方剂量分布 A. 临床治疗计划剂量分布;B. 预测剂量分布;C. 治疗计划与预测剂量差异分布 Figure 2 Prescription dose distribution of HRCTVs A. Dose distribution of clinic treatment plan; B. Predicted dose distribution; C. Differences in the dose distribution between the treatment plans and the predicted results |
图 3为该患者临床DVH与预测DVH的比较。预测剂量在DVH上的变化趋势与临床DVH曲线相符。该病例预测结果在90%体积处的剂量与临床剂量几乎持平,整体效果较好。
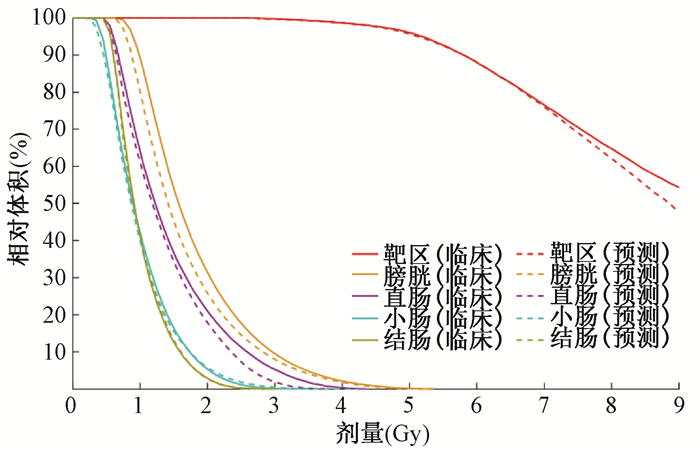
|
图 3 临床治疗计划DVH与预测DVH比较 Figure 3 Comparison between DVH in the clinical treatment plans and predicted DVH |
HRCTV与危及器官(膀胱、直肠、小肠、乙状结肠)的MDD分别为0.50±0.68、-0.05±0.11、-0.06±0.13、-0.04±0.06、(-0.01±0.12)Gy。各结构的MADD分别为1.74±0.30、0.12±0.04、0.14±0.09、0.08±0.03、(0.12±0.05)Gy。总体素的MDD与MADD分别为-0.01±0.03、(0.04±0.01)Gy。等剂量面Dice系数曲线结果显示,模型整体预测效果较好,50%处方剂量的DSC平均为0.94,处方剂量(6 Gy)的DSC为0.92,150%处方剂量DCS为0.89。利用DVH Table工具计算临床与预测各结构剂量学参数如表 1所示,除靶区Dmean (P = 0.01)外,其余各参数差异无统计意义(P>0.05)。
|
|
表 1 测试集中11例患者临床与预测剂量学参数比较(x±s) Table 1 Dosimetric parameters comparison between clinic treatment plans and predicted results of 11 cases in the testing group (x±s) |
讨论
本研究通过卷积神经网络建立3D U-net模型自动学习患者CT影像、解剖结构组与三维剂量分布的特征信息,实现宫颈癌近距离治疗剂量预测,为物理师计划设计提供参考。模型预测结果应用于自动近距离治疗计划,可减少患者治疗等待时间,提升治疗增益比。本研究比较了临床和预测结果的DVH曲线、HRCTV与OARs各剂量学参数以及剂量面包裹靶区体积的DSC值,结果显示模型能较好地预测出靶区的三维剂量分布信息,预测结果的DVH与临床DVH能较好符合。
摒弃传统调节函数权重因子优化的思想,通过模拟患者解剖结构与三维剂量的关键步骤为计划设计提供预测的剂量信息,为物理师提供一个快速优化的基础。Oud等[19]通过建立希望列表方法,用时20.5 s实现宫颈癌腔内与间隙插植计划的快速自适应计划设计。与之相比,使用深度学习方法搭建的剂量预测模型在19例测试集患者中,单个平均耗时2.5 s,大幅度缩短耗时。与Shen等[20]通过基于剂量体积直方图来建立权重优化法则网络(WTPN)相比,该模型直接预测体素中三维剂量矩阵的分布,不仅可研究DVH参数,亦可为物理师做计划时候提供参考。在体素级别上的三维剂量预测,Cortes等[14]搭建3D U-net模型完成了金属施源器的三维剂量预测,预测一个新病例耗时约1 min。与之相比,该研究利用模型自动从HU值截断的CT矩阵中学习核磁施源器的位置信息,完成了核磁施源器的三维剂量预测,且缩短了预测时间。
目前以标准三管式施源器用于术前近距离治疗的方式已经相当成熟,不少研究者通过改进优化函数与优化策略提升效益[21-22],但始终避免不了调整权重参数时间过长的问题。采用本研究方案预测患者的剂量分布,可与逆向剂量优化算法融合,实现宫颈癌近距离治疗自动剂量优化。本研究目前还存在高剂量区域MDD与MADD较大的问题,对核磁施源器的空间位置信息学习的能力不足,拟在后续的研究中提高剂量预测精度。在此基础上,结合该团队前期自动施源器分割重建的工作,可完成基于深度学习的自动近距离治疗计划设计[23]。
本研究基于3D U-net建立的模型实现了宫颈癌三维剂量分布的预测,模型可从CT影像中自动学习核磁施源器位置与组织差异信息,预测空间三维剂量分布。模型对于单个患者的剂量预测平均耗时2.5 s,预测结果可为物理师在临床计划设计中提供参考。模型实现的三维剂量预测可为宫颈癌近距离治疗自动化设计奠定基础。
利益冲突 无
作者贡献声明 罗锐负责内容撰写; 刘明哲、王培、黎杰负责文献校对;温爱萍、晏川钧、罗静月负责文献整理;王先良提供设计方案
| [1] |
中华医学会放射肿瘤治疗分会近距离治疗学组, 中国医师协会放射肿瘤分会妇科肿瘤学组, 中国抗癌协会近距离治疗专委会. 宫颈癌图像引导三维近距离后装治疗中国专家共识[J]. 中华放射肿瘤学杂志, 2020, 29(9): 712-717. The Brachytherapy Group of China Society for Radiation Oncology, The Gynecological Oncology Group of Chinese Association for Therapeutic Radiation Oncologists, The Brachytherapy Special Committee of Chinese Anti-Cancer Association. Chinese expert consensus on three-dimensional image guided brachytherapy for cervical cancer[J]. Chin J Radiat Oncol, 2020, 29(9): 712-717. DOI:10.3760/cma.j.cn113030-20200420-00196 |
| [2] |
郑敏, 王先良, 王捷, 等. 宫颈癌后装放疗时膀胱直肠小肠受照剂量探讨[J]. 中华放射医学与防护杂志, 2015, 35(9): 683-686. Zheng M, Wang XL, Wang J, et al. The analysis of exposure dose for bladder, rectum and small intestine with brachytherapy for cervical cancer[J]. Chin J Radiol Med Prot, 2015, 35(9): 683-686. DOI:10.3760/cma.j.issn.0254-5098.2015.09.010 |
| [3] |
石梅, 魏丽春, 刘隽悦, 等. 局部晚期宫颈癌CT图像引导下192Ir三维腔内后装治疗剂量体积参数与疗效关系[J]. 中华放射肿瘤学杂志, 2011, 20(1): 49-53. Shi M, Wei LC, Liu JY., et al. The correlation between DVH at CT-image based 192Ir intracavitary brachytherapy and effects of complications for patients with locally advanced cervical cancer[J]. Chin J Radiat Oncol, 2011, 20(1): 49-53. DOI:10.3760/cma.j.issn.1004-4221.2021.01.017 |
| [4] |
薛涛, 孙云川, 刘光波, 等. 宫颈癌腔内联合组织间插植近距离后装治疗中IPSA和HIPO逆向优化算法的比较分析[J]. 中华放射医学与防护杂志, 2018, 38(10): 767-770. Xue T, Sun YC, Liu GB, et al. Comparison of IPSA and HIPO inverse planning optimization algorithms for cervical cancer intracavitary/interstitial brachytherapy[J]. Chin J Radiol Med Prot, 2018, 38(10): 767-770. DOI:10.3760/cma.j.issn.0254-5098.2018.10.009 |
| [5] |
Wang X, Wang P, Tang B, et al. An inverse dose optimization algorithm for three-dimensional brachytherapy[J]. Front Oncol, 2020, 10: 2335. DOI:10.3389/fonc.2020.564580 |
| [6] |
陈开强, 游鸿强, 李奇欣, 等. 三种不同优化方法在局部晚期宫颈癌腔内联合组织间插植近距离治疗计划中的剂量学比较[J]. 中华放射医学与防护杂志, 2018, 38(3): 215-219. Chen KQ, You HQ, Li QX, et al. Dosimetric comparison of combined intracavitary/interstitial brachytherapy planning using three different kinds of optimization methods in locally advanced cervical cancer[J]. Chin J Radiol Med Prot, 2018, 38(3): 215-219. DOI:10.3760/cma.j.issn.0254-5098.2018.03.011 |
| [7] |
张麒麟, 张书铭, 王明清, 等. 放疗自动计划研究进展[J]. 中华放射肿瘤学杂志, 2021, 30(3): 316-320. Zhang QL, Zhang SM, Wang MQ, et al. Research progress on automatic treatment planning methods for radiothrapy[J]. Chin J Radiat Oncol, 2021, 30(3): 316-320. DOI:10.3760/cma.j.cn113030-20191202-00497 |
| [8] |
Banerjee S, Goyal S, Mishra S, et al. Artificial intelligence in brachytherapy: a summary of recent developments[J]. Br J Radiol, 2021, 94(1122): 20200842. DOI:10.1259/bjr.20200842 |
| [9] |
Hu H, Yang Q, Li J, et al. Deep learning applications in automatic segmentation and reconstruction in CT-based cervix brachytherapy[J]. J Contemp Brachytherapy, 2021, 13(3): 325. DOI:10.5114/jcb.2021.106118 |
| [10] |
Reza M. Deep learning-based auto-segmentation of organs at risk in high-dose rate brachytherapy of cervical cancer[J]. Radiother Oncol, 2021, 159: 231-240. DOI:10.1016/j.radonc.2021.03.030 |
| [11] |
Lei Y, Fu Y, Wang T, et al. Prostate dose prediction in HDR brachytherapy using unsupervised multi-atlas fusion[C]. On line: Medical Imaging 2021: Image Processing, 2021.
|
| [12] |
Mahantshetty U, Poetter R, Beriwal S, et al. IBS-GEC ESTRO-ABS recommendations for CT based contouring in image guided adaptive brachytherapy for cervical cancer[J]. Radiother Oncol, 2021, 160: 273-284. DOI:10.1016/j.radonc.2021.05.010 |
| [13] |
Jastaniyah N, Yoshida K, Tanderup K, et al. A volumetric analysis of GTVD and CTVHR as defined by the GEC ESTRO recommendations in FIGO stage ⅡB and ⅢB cervical cancer patients treated with IGABT in a prospective multicentric trial (EMBRACE)[J]. Radiother Oncol, 2016, 120(3): 404-411. DOI:10.1016/j.radonc.2016.05.029 |
| [14] |
Cortes KG, Simon A, Kallis K, et al. Knowledge-based three-dimensional dose prediction for tandem-and-ovoid brachytherapy[J]. Brachytherapy, 2022, 21(4): 532-542. DOI:10.1016/j.brachy.2022.03.002 |
| [15] |
Vinh-Hung V, Leduc N, Verellen D, et al. The mean absolute dose deviation-A common metric for the evaluation of dose-volume histograms in radiation therapy[J]. Med Dosim, 2020, 45(2): 186-189. DOI:10.1016/j.meddos.2019.10.004 |
| [16] |
Gaoshu Y. Effect of the dwell time deviation constraint on brachytherapy treatment planning for cervical cancer[J]. J Int Med Res, 2021, 49(8): 3000605211037477. DOI:10.1177/03000605211037477 |
| [17] |
Deasy JO, Blanco AI, Clark VH. CERR: a computational environment for radiotherapy research[J]. Med Phys, 2003, 30(5): 979-985. DOI:10.1118/1.1568978 |
| [18] |
丛秀峰, 陈俊, 张晓亭, 等. Oncentra近距离计划系统和MIM系统间DVH参数差异的分析[J]. 中国继续医学教育, 2021, 13(6): 113-116. Gong XF, Chen J, Zhang XT, et al. Analysis of DVH parameter difference between oncentra brachy planning system and MIM system[J]. China Contin Med Educ, 2021, 13(6): 113-116. DOI:10.3969/j.issn.1674-9308.2021.06.032 |
| [19] |
Oud M, Kolkman-Deurloo IK, Mens JW, et al. Fast and fully-automated multi-criterial treatment planning for adaptive HDR brachytherapy for locally advanced cervical cancer[J]. Radiother Oncol, 2020, 148: 143-150. DOI:10.1016/j.radonc.2020.04.017 |
| [20] |
Shen C, Gonzalez Y, Klages P, et al. Intelligent inverse treatment planning via deep reinforcement learning, a proof-of-principle study in high dose-rate brachytherapy for cervical cancer[J]. Phys Med Biol, 2019, 64(11): 115013. DOI:10.1088/1361-6560/ab18bf |
| [21] |
Guthier CV, Damato AL, Viswanathan AN, et al. A fast multitarget inverse treatment planning strategy optimizing dosimetric measures for high-dose-rate (HDR) brachytherapy[J]. Med Phys, 2017, 44(9): 4452-4462. DOI:10.1002/mp.12410 |
| [22] |
Maree SC, Luong NH, Kooreman ES, et al. Evaluation of bi-objective treatment planning for high-dose-rate prostate brachytherapy-a retrospective observer study[J]. Brachytherapy, 2019, 18(3): 396-403. DOI:10.1016/j.brachy.2018.12.010 |
| [23] |
胡海, 黎杰, 王培, 等. 宫颈癌后装治疗中基于U-net的自动施源器分割[J]. 实用肿瘤学杂志, 2021, 3(35): 248-253. Hu H, Li J, Wang P, et al. Automatic applicator segmentation based on U-net model in the brachytherapy of cervical cancer[J]. Prat Oncol, 2021, 3(35): 248-253. DOI:10.11904/j.issn.1002-3070.2021.03.010 |
 2022, Vol. 42
2022, Vol. 42


