宫颈癌发病率目前占女性恶性肿瘤的第4位,早期宫颈癌的标准治疗模式是根治性子宫切除加盆腔淋巴结清扫术,妇科肿瘤学组(GOG)109临床研究报道早期宫颈癌术后存在高危因素(淋巴结转移、宫旁侵犯、残端阳性)患者推荐治疗方式为同步放化疗,其中宫颈癌术后淋巴结转移是主要预后因素,在GOG 109更新结果显示同步放化疗对淋巴结转移患者获益更多[1-2]。但有研究报道早期宫颈癌术后存在不良因素的患者同步放化疗的疗效并没有显著优于单纯放疗,而这些不良预后因素中淋巴结阳性是其中主要的影响因素之一[3-4]。早期宫颈癌术后淋巴结阳性患者预后相关因素的报道存在分歧。因此,本研究收集2016年1月至2018年12月ⅠB~ⅡA期宫颈癌根治术后存在中/高危因素并接受调强放疗的患者292例,回顾性分析盆腔淋巴结阳性的相关危险因素及预后影响因素,为了解早期宫颈癌术后淋巴结阳性患者的临床特点、术后辅助治疗的选择提供理论依据。
资料与方法1. 病例资料:回顾性分析2016年1月至2018年12月宁夏医科大学总医院放疗科收治的早期宫颈癌术后存在一个或多个中/高危因素(高危因素包括:淋巴结转移、残端阳性、宫旁阳性;中危因素包括:>1/3间质浸润、淋巴脉管浸润(LVSI)、原发肿瘤>4 cm、非鳞癌等特殊病理类型)且接受容积旋转调强放疗(VMAT)的患者292例。平均年龄(49.51±9.05)岁(25~75岁)。手术方式为经腹或腹腔镜下广泛子宫切除术±双侧附件切除术+盆腔淋巴结清扫术。病理类型为鳞癌261例、腺癌和腺鳞癌共31例,国际妇产科协会(FIGO)2009分期为ⅠB~ⅡA期。将其分为无淋巴结转移的淋巴结阴性组239例,淋巴结转移的淋巴结阳性组53例,淋巴结转移患者均为盆腔淋巴结转移,其中淋巴结转移≤3枚者41例,≥4枚者12例,淋巴结转移数目最多的是13枚。两组患者一般资料及复发情况见表 1。
|
|
表 1 292例早期宫颈癌术后患者一般特征和盆腔淋巴结阳性患者复发情况 Table 1 General characteristics of 292 early cervical cancer patients after surgery and recurrence of positive lymph node patients |
2. 治疗方法
(1) 术后放疗:292例患者术后均给予容积旋转调强放疗(VMAT),其中281例患者行盆腔放疗,11例盆腔淋巴结转移比例高和/或髂总淋巴结转移者行延伸野放疗。术后阴道残端愈合开始放疗,放疗开始的中位时间为术后5.8周。靶区勾画采用美国放射肿瘤协作组(RTOG)宫颈癌术后调强放疗靶区勾画指南进行勾画,放疗剂量为45~50.4 Gy/25~28次,5次/周。阴道切缘阳性或近切缘的61例患者外照射后给予阴道上段近距离放疗补量,参考点为阴道黏膜下5 mm,参考点处方剂量为5~5.5 Gy/次,共2~3次。
(2) 同步化疗: 结合患者的危险程度、年龄、一般状况、患者的意愿等选择同步化疗,187例患者行同步放化疗,105例患者单纯放疗。同步化疗方案:盆腔放疗者每周顺铂40 mg/m2,延伸野放疗者每周顺铂25 mg/m2,自放疗第1天开始化疗。
3. 随访:随访时间自放疗结束至2021年1月或患者死亡、失访,随访方法采用电话随访结合复诊时医院数字化信息系统(His)所记录的症状、体格检查、实验室检验、影像资料、病理资料等,电话随访内容包括:患者生存情况;有无复发、复发部位、时间、治疗方案及结果;如果死亡,询问死亡时间及死亡原因;有无治疗并发症等。复发指在宫颈癌术后放疗结束3个月以后出现新的病变。
4. 观察指标:对早期宫颈癌术后淋巴结阳性患者的相关临床、病理等情况进行单因素及多因素分析;盆腔淋巴结阳性患者的3年、5年总生存(overall survival, OS)和无疾病生存(disease-free survival, DFS);进一步亚组分析盆腔淋巴结阳性患者预后相关的单因素和多因素分析。
5. 统计学处理:采用SPSS 19.0软件进行统计学分析,采用χ2检验进行淋巴结相关临床病理的单因素分析,用Logistic Regression进行多因素相关分析。用Kaplan-Meier法进行OS和DFS生存分析,并进行Log rank检验,用Cox回归模型进行淋巴结转移患者DFS相关的多因素分析。P<0.05为差异有统计学意义。
结果1. 盆腔淋巴结阳性的单因素分析:292例患者随访时间为3~60个月,随访率82.9%,早期宫颈癌术后盆腔淋巴结阳性相关的单因素分析结果显示:病变≥4 cm、深间质侵犯、危险因素的个数显著影响盆腔淋巴结转移(χ2=7.11、9.05、90.08,P<0.05),而年龄、病理类型、病理分级、神经侵犯、淋巴血管间隙浸润(LVSI)、残端阳性、宫旁侵犯对盆腔淋巴结转移无显著影响(P>0.05)。
2. 盆腔淋巴结阳性的多因素分析:采用Logistic Regression分析年龄、病变大小、病理类型、病理分级、神经侵犯、LVSI、侵犯深度、残端阳性、宫旁侵犯、危险因素个数与盆腔淋巴结阳性的相关性,结果显示病变≥4 cm、深间质侵犯、危险因素个数是盆腔淋巴结阳性的独立预后因素,见表 2。
|
|
表 2 早期宫颈癌术后患者盆腔淋巴结阳性多因素分析结果 Table 2 Multivariate analysis results of postoperative pelvic lymph node metastasis of early cervical cancer patients |
3. 淋巴结阳性对预后的影响:292例患者截至随访期末共死亡9例:淋巴结阴性组8例,淋巴结阳性组1例;两组共复发47例,其中淋巴结阴性组32例(局部区域复发19例,远外转移13例);淋巴结阳性组15例(局部区域复发6例,远处转移9例)。盆腔淋巴结阴性及淋巴结阳性患者3、5年OS分别为97.0%、95.0%;97.2%、97.2%(P>0.05);3、5年DFS两组分别为87.6%、84.5%;72.5%、69.3%(χ2=8.59,P=0.003),淋巴结阳性患者DFS显著低于淋巴结阴性组。淋巴结阴性和淋巴结阳性患者复发模式对比,无复发、局部区域复发和远处转移3组对比差异有统计学意义(χ2=9.40,P=0.009),亚组分析中,无复发组和远处转移组患者淋巴结转移差异有统计学差异(χ2=8.98,P<0.01),无复发组和局部区域复发组、局部区域复发组和远处转移组间淋巴结转移差异无统计学意义(P>0.05)。失败模式上,淋巴结阳性组以远处转移为主(9/15例),淋巴结阴性组以局部区域复发为主(19/32例),见图 1。
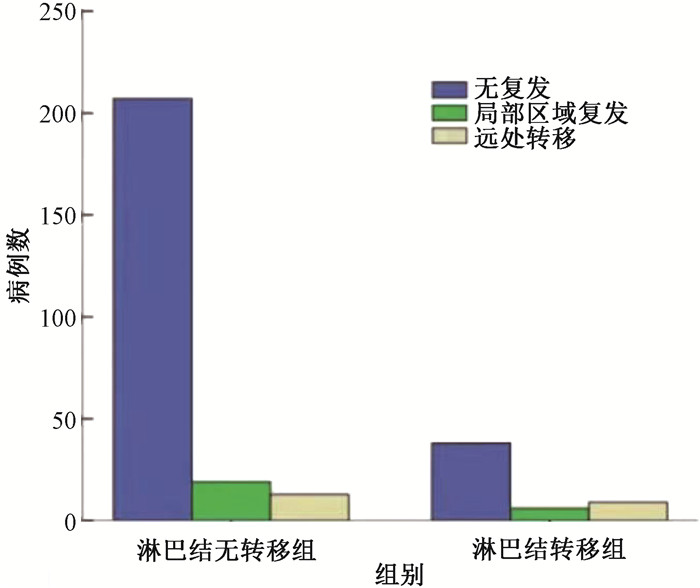
|
图 1 淋巴结阴性及阳性患者复发模式对比 Figure 1 Comparison of recurrence types between patients with negative and positive lymph nodes |
4. 盆腔淋巴结阳性DFS单因素分析:淋巴结阳性53例患者中共15例复发,1例死亡。对DFS相关的情况进行单因素分析,结果显示深间质侵犯患者DFS显著下降(χ2=7.25, P<0.05),年龄、病变大小、病理类型、病理分级、LVSI、宫旁侵犯、残端是否阳性和危险因素个数对DFS的影响差异无统计学意义(P>0.05),见图 2,表 1。
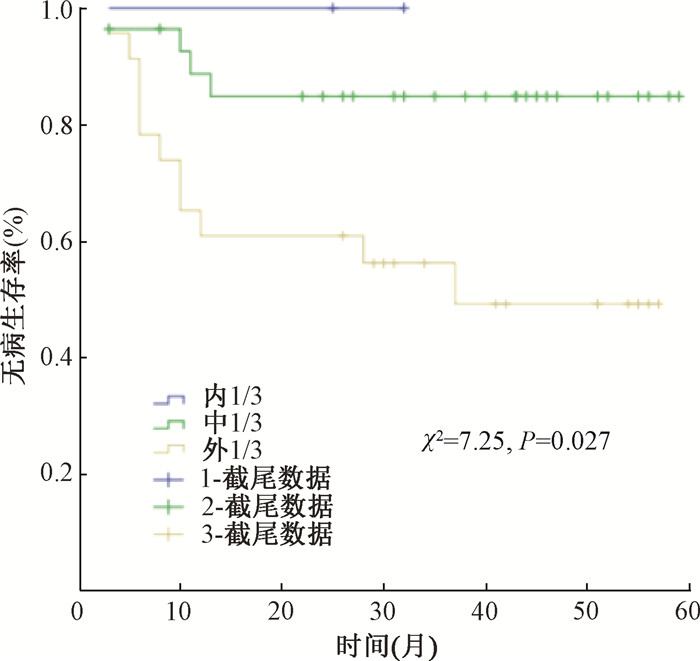
|
图 2 深间质侵犯对淋巴结阳性患者DFS的影响 Figure 2 Effects of deep interstitial invasion on DFS in patients with positive lymph nodes |
5. 盆腔淋巴结阳性患者放疗后DFS多因素分析:将以上单因素分析中的相关情况对早期宫颈癌术后盆腔淋巴结阳性患者放疗后DFS的影响进行多因素分析,结果显示病变>4 cm、残端阳性、侵犯深肌层患者放疗后DFS差异有统计学意义(χ2=4.37、4.69、4.39,P<0.05),见表 3。
|
|
表 3 盆腔淋巴结阳性患者影响DFS的多因素分析结果 Table 3 Results of multivariate analysis of DFS in patients with pelvic lymph node metastasis |
讨论
早期宫颈癌术后5年生存率为87%~92%[1, 5],其中淋巴结转移是其主要的预后因素之一,淋巴结转移患者预后显著下降[6]。早期宫颈癌术后淋巴结转移影响因素的研究报道存在一定的分歧。冯淑瑜等[7]报道早期宫颈癌术后的临床分期、病变侵犯深度是淋巴结转移的独立影响因素;Nanthamongkolkul等[8]报道宫颈深间质侵犯和宫旁侵犯是早期宫颈癌术后淋巴结转移的独立危险因素。刘宁阳[9]报道FIGO分期、淋巴血管间隙侵犯、肿瘤直径≥4 cm是宫颈癌术后淋巴结转移的独立危险因素。Dai等[10]报道肿瘤的FIGO分期、侵犯深度、淋巴脉管癌栓是淋巴结转移的独立危险因素。本研究回顾性分析早期宫颈癌术后淋巴结阳性和淋巴结阴性患者的临床及病理因素,结果显示病变>4 cm、深间质侵犯和危险因素个数是淋巴结转移的独立影响因素。这一结论与以上报道的部分结果一致。但在淋巴脉管癌栓及FIGO分期方面存在分歧,可能与本研究中淋巴结转移患者较少、且本研究入组患者FIGO分期为ⅠB~ⅡA期,而其他研究中患者FIGO分期多为ⅠA~ⅡB期有关,需要大样本研究来进一步分析。
研究报道早期宫颈癌术后无淋巴结转移患者的5年OS为95.4%~98.2%,淋巴结转移患者的5年OS为65.8%~77.8%;淋巴结无转移和转移患者的5年RFS分别为90.2%、65.5%[7-8]。本研究结果显示淋巴结转移和无转移患者放疗后OS差异无统计学意义,两组OS均>95.0%,可能与本研究中患者均进行了术后放疗,从而提高了疗效;另外本研究中失访患者较多,占17.1%,而淋巴结转移53例患者中共15例复发,复发的患者中有7例失访,因此影响其生存率的统计结果。本研究中两组患者DFS差异具有统计学意义,淋巴结转移患者复发率显著高于淋巴结阴性患者,与以上报道相符。
研究报道淋巴结转移患者术后行放疗及未行放疗的5年OS分别为89.1%和45.5%[7],术后同步放化疗能更进一步提高早期宫颈癌术后淋巴结转移患者的疗效[1-2]。因此,国内外指南推荐早期宫颈癌术后淋巴结转移患者采用同步放化疗。但也有报道存在分歧,Matsuo等[3]回顾性分析近几十年来宫颈癌术后淋巴结转移患者同步放化疗的应用越来越多,但其5年OS显示同步放化疗与单纯放疗相比差异无统计学意义;Huang等[4]前瞻性研究报道早期宫颈癌术后存在不良病理因素的患者续贯放化疗的DFS显著优于同步放化疗及单纯放疗,但同步放化疗及单纯放疗间的DFS和肿瘤死亡风险差异无统计学意义。本研究结果显示淋巴结转移患者同步放化疗与单纯放疗疗效差异无统计学意义,与以上报道相符,但本研究中淋巴结转移病例数少,需要大样本的前瞻性研究。
本研究显示,早期宫颈癌术后淋巴结转移的53例患者放疗后共15例复发,其中远处转移9例,区域复发6例。由于远处转移比例较高,是否同步放化疗后进行巩固性化疗能提高疗效、降低远处转移等,值得探讨。Zhong等[11]报道宫颈癌术后淋巴结转移患者同步放化疗与同步放化疗后给予巩固性化疗对比,结果显示两组患者OS、DFS差异无统计学意义,但巩固性化疗组患者的3/4级骨髓抑制显著高于同步放化疗。本研究巩固性化疗病例少,需要前瞻性大样本研究。Nanthamongkolkul等[8]报道病变侵犯深度是影响术后淋巴结转移患者DFS的独立预后因素,本研究与其报道一致。
本研究中53例淋巴结转移患者多因素分析中放疗后残端阳性是DFS的预后因素,危险因素的个数对预后无显著影响,可能是因为淋巴结转移合并残端阳性两个高危因素的患者其复发率显著升高,本研究中的危险因素既包括高危因素又包括中危因素,由于病例数少,无法进行中高危因素的分层分析,需要今后扩大样本量进一步研究。另外,宫颈癌手术治疗中清扫淋巴结的数目差异较大,因此不能仅通过淋巴结转移的数目来预测预后,可能淋巴结转移与清扫淋巴结数的比值(淋巴结转移率)对预后更有价值,Lee等[12]报道淋巴结转移的比值与肿瘤的复发具有显著的相关性,但对OS无显著影响,由于本研究中淋巴结清扫数目均<20枚,是否淋巴结阳性比例对预后的判断更具有价值需要进一步扩大样本量进行分析。
综上所述,早期宫颈癌术后淋巴结阳性是主要的危险因素之一,宫颈深间质侵犯、病变>4 cm和危险因素个数是淋巴结转移的独立影响因素,淋巴结阳性患者放疗后的DFS显著低于淋巴结阴性患者,淋巴结转移患者复发以远处转移为主。深间质侵犯是早期宫颈癌术后盆腔淋巴结转移患者DFS的独立预后因素。
利益冲突 无
作者贡献声明 马建萍、潘闻燕负责收集资料、整理数据和统计分析、论文撰写及修改;何剑莉负责放疗靶区及计划质控;陆青、孟颖、冯阳阳、拜周兰参与患者治疗、资料收集
| [1] |
Peters WA, Liu PY, Barrett RJ, et al. Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix[J]. J Clin Oncol, 2000, 18(8): 1606-1613. DOI:10.1200/JCO.2000.18.8.1606 |
| [2] |
Trifiletti DM, Swisher-McClure S, Showalter TN, et al. Postoperative chemoradiation therapy in high-risk cervical cancer: re-evaluating the findings of gynecologic oncology group study 109 in a large, population-based cohort[J]. Int J Radiat Oncol Biol Phys, 2015, 93: 1032-1044. DOI:10.1016/j.ijrobp.2015.09.001 |
| [3] |
Matsuo K, Nusbaum DJ, Machida H, et al. Populational trends and outcomes of postoperative radiotherapy for high-risk early-stage cervical cancer with lymph node metastasis: concurrent chemo-radiotherapy versus radiotherapy alone[J]. Am J Obstet Gynecol, 2020, 222(5): 484.e1-484.e15. DOI:10.1016/j.ajog.2019.10.010 |
| [4] |
Huang H, Feng YL, Wan T, et al. Effectiveness of sequential chemoradiation vs concurrent chemoradiation or radiation alone in adjuvant treatment after hysterectomy for cervical cancer: the STARS phase 3 randomized clinical trial[J]. JAMA Oncol, 2021, 7(3): 361-369. DOI:10.1001/jamaoncol.2020.7168 |
| [5] |
Gray HJ. Primary management of early stage cervical cancer (IA1-IB) and appropriate selection of adjuvant therapy[J]. J Natl Compr Canc Netw, 2008, 6(1): 47-52. DOI:10.6004/jnccn.2008.0005 |
| [6] |
Fleming ND, Frumovitz M, Schmeler KM, et al. Signifificance of lymph node ratio in defifining risk category in node-positive early stage cervical cancer[J]. Gynecol Oncol, 2015, 136(1): 48-53. DOI:10.1016/j.ygyno.2014.11.010 |
| [7] |
冯淑瑜, 张彦娜, 刘建刚. 宫颈癌淋巴结转移的高危因素及预后分析[J]. 癌症, 2005, 24(10): 1261-1266. Feng SY, Zhang YN, Liu JG. Risk factors and prognosis of node-positive cervical carcinoma[J]. Chin J Cancer, 2005, 24(10): 1261-1266. DOI:10.3969/j.issn.1000-467X.2005.10.019 |
| [8] |
Nanthamongkolkul K, Hanprasertpong J. Predictive factors of pelvic lymph node metastasis in early-stage cervical cancer[J]. Oncol Res Treat, 2018, 41(4): 194-198. DOI:10.1159/000485840 |
| [9] |
刘宁阳. 宫颈癌根治术患者盆腔淋巴结转移及5年生存率的影响因素[J]. 当代医学, 2021, 27(2): 179-181. Liu NY. Influencing factors of pelvic lymph node metastasis and 5-year survival rate in patients undergoing radical hysterectomy for cervical cancer[J]. Contem Med, 2021, 27(2): 179-181. DOI:10.3969/j.issn.1009-4393.2021.02.078 |
| [10] |
Dai YF, Xu M, Zhong LY, et al. Prognostic significance of solitary lymph node metastasis in patients with stages IA2 to ⅡA cervical carcinoma[J]. J Int Med Res, 2018, 46(10): 4082-4091. DOI:10.1177/0300060518785827 |
| [11] |
Zhong ML, Wang YN, Liang MR, et al. Consolidation chemotherapy in early-stage cervical cancer patients with lymph node metastasis after radical hysterectomy[J]. Int J Gynecol Cancer, 2020, 30(5): 602-606. DOI:10.1136/ijgc-2019-000690 |
| [12] |
Lee YH, Chong GO, Kim SJ, et al. Prognostic value of lymph node characteristics in patients with cervical cancer treated with radical hysterectomy[J]. Cancer Manag Res, 2021, 13: 8137-8145. DOI:10.2147/CMAR.S332612 |
 2022, Vol. 42
2022, Vol. 42
