2. 北京大学肿瘤医院暨北京市肿瘤防治研究所介入科 恶性肿瘤发病机制及转化研究教育部重点实验室, 北京 100142
2. Key Laboratory of Carcinogenesis and Translational Research (Ministry of Education/Beijing), Interventional Therapy Department, Peking University Cancer Hospital and Institute, Beijing 100142, China
原发性肝癌是我国常见恶性肿瘤之一,位居我国癌症发病率的第4位、死亡率的第2位[1-2]。肝细胞性肝癌(hepatocellular carcinoma, HCC)是其主要病理类型,易于侵犯肝血管系统。在HCC诊断时有10%~40%的患者存在肝静脉和/或门静脉的大血管侵犯(macrovascular invasion, MVI),这不仅促进肝内肿瘤扩散,而且可导致肝功能恶化[3-4]。因此,合并MVI的HCC患者预后极差,接受支持治疗患者的中位生存时间仅2~4个月[5]。酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)索拉非尼可延缓此类患者的进展时间并延长总生存时间[6-7]。对于具有良好的肝功能和门静脉侧支循环的患者,经导管动脉化疗栓塞(transcatheter arterial chemoembolization, TACE)可以安全地用于无法切除的HCC合并MVI的患者[8],也推荐将TACE与放疗相结合[8-9]。但TACE与放疗及TKI联合治疗HCC合并MVI的研究较少。本课题组前期报道了调强放疗(intensity-modulated radiotherapy, IMRT)联合TACE及TKI治疗HCC合并MVI患者的安全性和疗效,初步证实患者可能从局部和全身相结合的综合治疗中获益[9]。本研究旨在探讨IMRT联合TACE及TKI治疗HCC合并MVI患者的长期随访结果。
资料与方法1. 一般临床资料:回顾性分析2015年10月至2018年10月63例在北京大学肿瘤医院接受调强放疗联合动脉化疗栓塞和/或索拉非尼治疗的肝细胞性肝癌合并静脉瘤栓且无远处转移患者的临床病理资料。纳入标准:①年龄≥18岁。②东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分≤2分。③基于病理和/或影像诊断的HCC[10]。④ Child-Pugh A级。⑤肿瘤不可切除。⑥单发病变或融合性多发病变。⑦合并门静脉和/或肝静脉瘤栓。⑧白细胞计数≥3.0×109/L,中性粒细胞绝对计数≥1.5×109/L,血红蛋白≥90 g/L,血小板≥80×109/L,谷草转氨酶(AST)和谷丙转氨酶(ALT)<标准上限的2.5倍,胆红素<标准上限的2倍,凝血酶原时间-国际标准化比值< 1.5(除外患者正在口服抗凝剂)。排除标准:①远处转移。②既往腹部放疗史。
2. 治疗方法
(1) TACE:根据肿瘤大小、血管分布、动静脉分流和肝功能储备情况决定碘油和阿霉素或顺铂的剂量。并注入明胶海绵颗粒选择性栓塞肝叶、段或亚段动脉。如果TACE有效,则每隔4~6周重复1次。
(2) IMRT:TACE后4~6周进行IMRT。放疗实施利用CT(或4D-CT)及磁共振成像(MRI)定位,充分结合MRI图像和TACE后的碘油沉积CT图像,确定大体肿瘤的范围,在动脉期进行勾画。患者仰卧位,体膜固定,应用静脉增强对比剂,层厚3~5 mm,扫描范围从膈上4~5 cm至L4椎体下缘。扫描图像传入治疗计划系统进行图像重建,勾画靶区及周围正常组织。原发病灶(gross tumor volume of primary tumor, GTVp)包括增强的肿瘤区域、碘油沉积区域、TACE后组织坏死的肿瘤区域,瘤栓(gross tumor volume of tumor thrombosis, GTVt)包括影像可见的瘤栓,转移淋巴结(gross tumor volume of regional lymph node, GTVnd)包括影像可见的转移区域淋巴结。临床靶体积(clinical target volume, CTV)定义为GTVp外扩0.5 cm[10],如果瘤栓不超出血管,则GTVt不进行外扩,同时,CTV包括转移淋巴结区域及下一站淋巴引流区。考虑到肝脏运动和摆位误差,CTV在前后和左右方向上外扩0.5 cm,在头脚方向上外扩1.0 cm,形成计划靶体积(planning target volume, PTV)[11]。正常肝脏被定义为总肝脏体积减去GTV。IMRT计划选择最小数量的照射野和合理的射野方向,以确保PTV被95%的等剂量曲线覆盖,并减少正常肝脏的受照剂量和体积。正常肝脏接受的平均剂量≤28 Gy[12]。胃和肠道的Dmax≤54 Gy,V45<15%。脊髓Dmax<45 Gy。肾脏V20<50%。处方剂量为95%PTV≥50 Gy,常规分割,每周5次。根据危及器官的剂量限制确定最终处方剂量。
(3) 索拉非尼:在IMRT之前、期间或之后,口服索拉非尼400 mg(每日两次)。当发生药物不良反应时,治疗中断并药物减量至200 mg(每日两次)。尽可能长时间维持索拉非尼治疗,直至疾病进展、死亡或出现以下停药指征之一:需要终止治疗的不良事件、ECOG评分恶化至4分、肝功能恶化(停止治疗4周后总胆红素>30 mg/L),或患者要求停止治疗。
3. 疗效评价和不良反应:基于改良实体瘤疗效评估标准(mRECIST),在IMRT完成后12周进行肝脏CT或MRI扫描,测量具有肿瘤活性的最长径[13]。分为完全缓解(complete response, CR),部分缓解(partial response, PR),稳定(stable disease, SD)和进展(progression disease, PD)。总生存时间定义为从放疗或索拉非尼治疗开始到任何原因死亡或末次随访时间,无进展生存时间定义为从放疗或索拉非尼治疗开始到首次进展、复发、末次随访或疾病相关死亡的时间。根据不良事件通用术语标准(Common Terminology Criteria of Adverse Events, CTCAE)4.0版本进行不良反应评价。放疗后4个月评估患者是否存在放射诱发肝病(radiation-induced liver disease, RILD)。
4. 随访:定期随访的内容包括详细的病史和体格检查、ECOG评分、血清甲胎蛋白(serum alpha-fetoprotein, AFP)、血常规、肝功能、凝血功能、胸部X射线片或CT,以及腹部CT和/或MRI,直到死亡或末次随访(2022年3月)。在治疗后前2年每3个月随访1次,之后每半年随访1次,5年后每年随访1次。随访方式包括门诊复查或电话随访。
5. 统计学处理:应用SPSS 24.0软件进行统计学分析,GraphPad Prism 8.0绘制生存曲线。单因素生存分析采用Kaplan-Meier法和Log rank检验。应用倾向评分配比法(propensity score matching, PSM)减少潜在混杂因素的影响。匹配变量包括性别、年龄、ECOG评分、肿瘤大小、N分期和MVI类型。匹配后,两组倾向评分相当的患者按1 ∶1分组。使用SAS 9.4软件进行PSM分析。P<0.05为差异具有统计学意义。
结果1. 临床病理特征:回顾性分析了2015年10月至2018年10月间收治的63例HCC合并MVI患者,根据治疗方式的不同分为两组,接受IMRT加TACE联合索拉非尼者为A组(28例),接受IMRT加TACE但未联合索拉非尼者为B组(35例)。所有患者PSM前基线信息见表 1。PSM后两组匹配良好,基线特征差异没有统计学意义(P>0.05,表 2)。
|
|
表 1 63例患者临床病理特征 Table 1 Clinicopathological characteristics of the 63 patients |
|
|
表 2 倾向评分匹配后患者临床病理特征 Table 2 Clinicopathological characteristics of the patients after propensity score matching |
2. TACE+IMRT+TKI组剂量学参数:接受IMRT加TACE联合索拉非尼治疗患者的95%PTV中位剂量为50 Gy (40~60 Gy),分割剂量为1.8~2.0 Gy。危及器官受量均在限量范围内。肝-GTV Dmean为(21.23±8.34)Gy,肝-GTV体积为(1072.68±384.09)cm3,脊髓Dmax为(27.81±10.92)Gy,十二指肠Dmax为(49.87±18.21)Gy,十二指肠V45为(11.06±9.62)cm3,胃Dmax为(48.55±13.15)Gy,胃V45为(30.54±35.80)cm3,小肠Dmax为(32.94±22.24)Gy,小肠V45为(10.11±14.95)cm3,大肠Dmax为(48.47±18.72)Gy,大肠V45为(26.86±38.73)cm3,左肾V20为(1.97±3.37)%,右肾V20为(15.59±13.04)%。
3. 近期疗效:根据mRECIST评估肿瘤治疗反应,A组中3例(10.7%)患者达到CR,B组未观察到CR患者,两组的总有效率和疾病控制率相似(表 3)。倾向评分匹配后,两组的总有效率和疾病控制率差异没有统计学意义(P>0.05,表 3)。
|
|
表 3 放疗结束12周后疗效评价 Table 3 Tumor response after 12 weeks of radiotherapy |
4. 失败模式:在随访期间,A组共17例(60.7%)患者出现肿瘤进展,B组为26例(74.3%)。其中,A组3例(10.7%)患者出现照射野内进展,9例(32.1%)出现肝内照射野外失败,8例(28.6%)远地转移。B组5例(14.3%)患者出现照射野内进展,22例(62.9%)发生肝内照射野外失败,10例(28.6%)远地转移。A组较B组明显减少了肝内照射野外失败的发生率(χ2=4.76,P=0.040)。
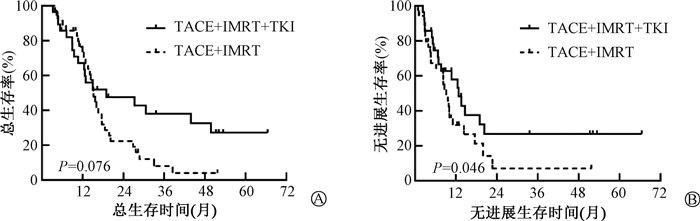
5. 生存分析:中位随访时间62个月。A组和B组的中位生存时间分别为19.0个月和15.2个月(P=0.076,图 1),A组的中位无进展生存时间高于B组(10.7个月比8.6个月,χ2=3.99,P=0.046,图 1)。经过PSM平衡组间差异后,A组的中位生存时间明显高于B组(30.6个月比15.2个月,χ2=5.34,P=0.023,图 2),A组的中位无进展生存时间仍然高于B组(12.5个月比8.3个月,χ2=4.79,P=0.026,图 2)。
|
图 1 倾向评分匹配前肝细胞性肝癌合并瘤栓患者总生存曲线(A)无进展生存曲线(B) Figure 1 Kaplan-Meier curves of OS (A) and PFS (B) of HCC with MVI patients before propensity score matching |

|
注:IMRT. 调强放疗;TACE. 经导管动脉化疗栓塞;TKI. 酪氨酸激酶抑制剂 图 2 倾向评分匹配后肝细胞性肝癌合并瘤栓患者总生存曲线(A)无进展生存曲线(B) Figure 2 Kaplan-Meier curves of OS (A) and PFS (B) of HCC with MVI patients after propensity score matching |
6. 不良反应:皮肤反应是最常见的不良反应(25例,89.3%)。A组的腹泻、手足综合征、其他皮肤反应和脱发的发生率分别为28.6%、17.9%、92.9%和14.3%,明显高于B组(0%、0%、68.6%和0%),P<0.05。以上不良反应均为1级或2级。10例患者(15.9%)出现3级血液学不良反应,A组4例,B组6例(14.3%和17.1%,P=1.000)。最常见的血液学不良反应是血小板减少和白细胞减少。7例患者出现3级肝脏不良反应,其中A组3例(10.7%),B组4例(11.4%,P=1.000)。γ-谷氨酰转肽酶(GGT)水平升高是最常见的肝不良反应。没有患者出现4级或5级不良反应,也没有观察到RILD(表 4)。
|
|
表 4 两组患者不良反应对比[例数(%)] Table 4 Comparison of adverse events between the patients of both groups [n(%)] |
讨论
MVI在HCC的自然病程中十分常见,与未出现MVI的患者相比,其预后更差[3, 6]。本研究的长期随访结果显示,与IMRT联合TACE相比,IMRT联合TACE及TKI不仅可以延长HCC合并MVI患者的中位PFS,且在PSM后可显著延长患者的中位OS。
HCC的系统治疗包括分子靶向药物治疗、免疫治疗和化学治疗等。索拉非尼是最早应用于肝癌系统治疗的酪氨酸激酶抑制剂。多项临床研究表明,索拉非尼对于不同国家地区、不同肝病背景的晚期肝癌患者都具有一定的生存获益,是HCC合并MVI的标准治疗[6-7]。然而,合并门静脉癌栓(PVTT)患者的OS仅延长了约3个月,治疗反应率仅2%~3.3%,且这些试验显示的生存优势是优于安慰剂,而非其他治疗方案。与索拉非尼相比,局部区域治疗可提高疗效[14-15]。一项回顾性研究显示HCC合并MVI的患者接受手术切除或索拉非尼治疗,手术切除组的中位OS与索拉非尼组相似(12.0个月比9.7个月,P=0.682)。TACE是HCC常用的非手术治疗方法。放疗是瘤栓局部治疗中最有效的手段之一,客观有效率为39.6%~51.8%,其受肿瘤位置的影响相对较小,而且大血管放疗耐受性好,因此放疗可以安全有效地应用于MVI的治疗,研究证实采用包括放疗在内的综合治疗后,HCC合并MVI的中位OS可以提高10个月左右[16-18]。Nakazawa等[15]回顾性分析了放疗联合索拉非尼治疗HCC合并门脉瘤栓的疗效,PSM后每组28例患者,放疗组患者的生存率优于索拉非尼组(中位OS,10.9个月比4.8个月;P=0.025)。此外,有研究表明与单独使用索拉非尼相比,TACE联合RT的治疗策略显着延长了生存期[8, 19-20]。一项前瞻随机临床试验评估了TACE联合RT对比索拉非尼对HCC合并MVI患者的疗效和安全性[19]。与索拉非尼组相比,12周时TACE-RT组的PFS显着增加(86.7%比34.3%,P<0.001),TACE-RT组在24周时的缓解率显著增加(33.3%比2.2%,P<0.001),中位进展时间也明显延长(31.0周比11.7周,P<0.001),并且中位OS也显著延长(55.0周比43.0周,P=0.04)[19]。TACE联合放疗不论是无进展生存还是总生存方面均明显优于索拉非尼[19]。此外,两项回顾性分析也显示,与索拉非尼组相比,在PSM后TACE-RT组的中位进展时间和OS都显著延长[8, 20]。
一项荟萃分析比较了不可手术HCC患者TACE联合放疗与单纯TACE治疗疗效,共包括25项研究,2 577例患者,其中18个研究包括了门静脉瘤栓患者,亚组分析显示无论是否合并门静脉瘤栓,HCC患者均可以从综合治疗中获益[21]。Kim等[22]总结了639例HCC合并MVI患者接受TACE联合放疗作为一线治疗的结果,中位OS为10.7个月,放疗后3个月内,3级以上肝功能异常为8.1%,3级以上胃肠道出血发生率为1.6%,TACE联合放疗安全有效。
由于HCC合并MVI的最主要失败模式为肝内照射野外的失败,其次为远地转移,因此在放疗及TACE的基础上联合系统治疗,同时关注了大体肿瘤、潜在的肝内病变和远处转移,可能对于HCC合并MVI的患者是一种更积极的治疗方法。前期报道的结果显示,与IMRT联合TACE相比,IMRT联合TACE及TKI治疗方案并未明显增加治疗毒性,但改善了HCC合并MVI患者的中位进展时间(13.6个月比9.2个月,P=0.044),PSM后A组的PFS仍优于B组(P=0.033)[9]。A组的中位OS长于B组(19.0个月比15.2个月),但差异无统计学意义[9]。本次长期随访结果的更新,显示IMRT联合TACE及TKI不仅可以延长HCC合并MVI患者的中位PFS,且PSM后结果显示可显著延长患者的中位OS。患者的生存获益主要来源于联合TKI组降低了肝内照射野外失败的发生率。IMRT联合TACE及TKI的治疗策略进一步改善了HCC合并MVI患者的预后。本研究为小样本回顾性研究,因此,需要进行前瞻随机对照研究来进一步证实这些发现。
综上所述,长期随访结果显示,对于HCC合并MVI的患者,经过倾向评分配比平衡组间差异后,在IMRT及TACE的基础上联合TKI,提高了PFS,并改善了OS,是安全有效的治疗手段。
利益冲突 无
作者贡献声明 赵雨婷负责资料收集、数据整理、统计分析和论文撰写;王洪智、董德左、朱向高、高嵩和朱旭负责提供数据和论文修改;王维虎负责研究设计和论文修改
| [1] |
Zheng R, Zhang S, Zeng H, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Cent, 2022, 2(1): 1-9. DOI:10.1016/j.jncc.2022.02.002 |
| [2] |
Zhou M, Wang H, Zeng X, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017:a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2019, 394(10204): 1145-1158. DOI:10.1016/S0140-6736(19)30427-1 |
| [3] |
Llovet JM, Bustamante J, Castells A, et al. Natural history of untreated nonsurgical hepatocellular carcinoma: rationale for the design and evaluation of therapeutic trials[J]. Hepatology, 1999, 29(1): 62-67. DOI:10.1002/hep.510290145 |
| [4] |
Minagawa M, Makuuchi M. Treatment of hepatocellular carcinoma accompanied by portal vein tumor thrombus[J]. World J Gastroenterol, 2006, 12(47): 7561-7567. DOI:10.3748/wjg.v12.i47.7561 |
| [5] |
Cabibbo G, Enea M, Attanasio M, et al. A meta-analysis of survival rates of untreated patients in randomized clinical trials of hepatocellular carcinoma[J]. Hepatology, 2010, 51(4): 1274-1283. DOI:10.1002/hep.23485 |
| [6] |
Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008, 359: 378-390. DOI:10.1056/NEJMoa0708857 |
| [7] |
Cheng AL, Kang YK, Chen Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase Ⅲ randomised, double-blind, placebo-controlled trial[J]. Lancet Oncol, 2009, 10(1): 25-34. DOI:10.1016/S1470-2045(08)70285-7 |
| [8] |
Kim GA, Shim JH, Yoon SM, et al. Comparison of chemoembolization with and without radiation therapy and sorafenib for advanced hepatocellular carcinoma with portal vein tumor thrombosis: a propensity score analysis[J]. J Vasc Interv Radiol, 2015, 26: 320-329. DOI:10.1016/j.jvir.2014.10.019 |
| [9] |
Zhao Y, Zhu X, Wang H, et al. Safety and efficacy of transcatheter arterial chemoembolization plus radiotherapy combined with sorafenib in hepatocellular carcinoma showing macrovascular invasion[J]. Front Oncol, 2019, 15(9): 1065. DOI:10.3389/fonc.2019.01065 |
| [10] |
Wang W, Feng X, Zhang T, et al. Prospective evaluation of microscopic extension using whole-mount preparation in patients with hepatocellular carcinoma: definition of clinical target volume for radiotherapy[J]. Radiat Oncol, 2010, 5: 73. DOI:10.1186/1748-717X-5-73 |
| [11] |
Zhao YT, Liu ZK, Wu QW, et al. Observation of different tumor motion magnitude within liver and estimate of internal motion margins in postoperative patients with hepatocellular carcinoma[J]. Cancer Manag Res, 2017, 9: 839-848. DOI:10.2147/CMAR.S147185 |
| [12] |
Pan CC, Kavanagh BD, Dawson LA, et al. Radiation-associated liver injury[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3 Suppl): S94-100. DOI:10.1016/j.ijrobp.2009.06.092 |
| [13] |
Lencioni R, Llovet JM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma[J]. Semin Liver Dis, 2010, 30(1): 52-60. DOI:10.1055/s-0030-1247132 |
| [14] |
Costentin CE, Decaens T, Laurent A, et al. Sorafenib vs surgical resection for hepatocellular carcinoma with macrovascular invasion: a propensity score analysis[J]. Liver Int, 2017, 37(12): 1869-1876. DOI:10.1111/liv.13491 |
| [15] |
Nakazawa T, Hidaka H, Shibuya A, et al. Overall survival in response to sorafenib versus radiotherapy in unresectable hepatocellular carcinoma with major portal vein tumor thrombosis: propensity score analysis[J]. BMC Gastroenterol, 2014, 14: 84. DOI:10.1186/1471-230X-14-84 |
| [16] |
Rim CH, Seong J. Application of radiotherapy for hepatocellular carcinoma in current clinical practice guidelines[J]. Radiat Oncol J, 2016, 34(3): 160-167. DOI:10.3857/roj.2016.01970 |
| [17] |
Im JH, Yoon SM, Park HC, et al. Radiotherapeutic strategies for hepatocellular carcinoma with portal vein tumour thrombosis in a hepatitis B endemic area[J]. Liver Int, 2017, 37(1): 90-100. DOI:10.1111/liv.13191 |
| [18] |
Yoon SM, Lim YS, Won HJ, et al. Radiotherapy plus transarterial chemoembolization for hepatocellular carcinoma invading the portal vein: long-term patient outcomes[J]. Int J Radiat Oncol Biol Phys, 2012, 82(5): 2004-2011. DOI:10.1016/j.ijrobp.2011.03.019 |
| [19] |
Yoon SM, Ryoo BY, Lee SJ, et al. Efficacy and safety of transarterial chemoembolization plus external beam radiotherapy vs sorafenib in hepatocellular carcinoma with macroscopic vascular invasion: a randomized clinical trial[J]. JAMA Oncol, 2018, 4: 661-669. DOI:10.1001/jamaoncol.2017.5847 |
| [20] |
Cho JY, Paik YH, Park HC, et al. The feasibility of combined transcatheter arterial chemoembolization and radiotherapy for advanced hepatocellular carcinoma[J]. Liver Int, 2014, 34(5): 795-801. DOI:10.1111/liv.12445 |
| [21] |
Huo YR, Eslick GD. Transcatheter arterial chemoembolization plus radiotherapy compared with chemoembolization alone for hepatocellular carcinoma: A systematic review and meta-analysis[J]. JAMA Oncol, 2015, 1(6): 756-765. DOI:10.1001/jamaoncol.2015.2189 |
| [22] |
Kim YJ, Jung J, Joo JH, et al. Combined transarterial chemoembolization and radiotherapy as a first-line treatment for hepatocellular carcinoma with macroscopic vascular invasion: Necessity to subclassify Barcelona clinic liver cancer stage C[J]. Radiother Oncol, 2019, 141: 95-100. DOI:10.1016/j.radonc.2019.08.009 |
 2022, Vol. 42
2022, Vol. 42


