2. 郑州大学附属肿瘤医院 河南省肿瘤医院对外交流部, 郑州 450008
2. Department of Outreaching, Affiliated Cancer Hospital of Zhengzhou University, Henan Cancer Hospital, Zhengzhou 450008, China
肺癌是世界上死亡率最高的恶性肿瘤[1],非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌总数的80%~85%,超过30%的NSCLC患者一经诊断即为局部晚期(locally advanced non-small cell lung cancer, LA-NSCLC),这是影响肺癌预后的重要原因。放射治疗是治疗肺癌的一种重要手段,77%的肺癌患者有放射治疗的循证证据[2]。与序贯放化疗相比,同步放化疗作为LA-NSCLC患者的标准治疗,可在长期生存和降低局部复发率方面显著受益[3-4]。然而,接受放化疗的LA-NSCLC患者预后表现出极大的差异,因此,探寻其放化疗的预后指标是非常有必要的。
炎症过程被认为是癌症患者体内促进肿瘤生长扩散及激活肿瘤信号通路的机制[5]。2018年,Mezquita等[6]首次提出了肺免疫预后指数(lung immune prognostic index, LIPI)以反映机体炎症状态。它是一种基于治疗前患者血液学衍生粒淋比(derive neutrophil-to-lymphocyte ratio, dNLR),即中性粒细胞/(白细胞-中性粒细胞)和乳酸脱氢酶(lactate dehydrogenase, LDH)水平的复合指标。Mezquita等[6]提出LIPI可能有助于识别不太可能从免疫检查点抑制剂(immune checkpoint inhibitor, ICI)治疗中获益的患者,而对于接受化疗的患者并没有类似作用。而Minami等[7]的研究表明,LIPI在接受化疗和靶向治疗的患者中也同样具有指导作用。因此,LIPI似乎并不是ICI治疗的特异性生物标志物。一项Meta分析提示,LIPI除了可以作为一种可能的预后指标外,还可以在随机研究中对患者进行分组[8]。因此,考虑到LIPI可能是晚期NSCLC患者的生物标志物,本研究回顾性分析接受放化疗的LA-NSCLC患者,探讨LIPI分组与其预后的关系,为临床治疗提供参考。
材料与方法1. 病例资料:回顾性收集郑州大学附属肿瘤医院放疗科2013—2019年不可手术切除或因个人原因拒绝手术治疗的LA-NSCLC患者,具体资料见表 1。病例入组标准:病理明确的非小细胞肺癌;根据美国癌症联合委员会(AJCC)第8版分期为T1~4N2~3M0(ⅢA~ⅢC期);治疗前患者及家属签署知情同意书;随访资料完整者。排除标准:治疗前行脑部磁共振成像(MRI)、颈胸腹部CT、全身骨扫描和/或正电子发射计算机断层显像(PET-CT)发现远处转移者;单纯放疗者或单纯化疗者;合并其他肿瘤者;放化疗前接受抗血管生成药物或靶向治疗者;随访资料不完整者。
|
|
表 1 238例局部晚期非小细胞肺癌患者一般临床资料 Table 1 General clinical data of 238 patients with LA-NSCLC |
2. 治疗方法
(1) 放疗方案:所有患者均采用体部负压真空垫固定体位,仰卧位双手抱肘置于额上,平静呼吸下行增强CT扫描模拟定位,扫描范围从环状软骨水平到第2腰椎下缘,层厚3 mm。根据美国国立综合癌症网络(NCCN)指南勾画靶区,行累及野照射。大体肿瘤体积(gross target volume,GTV)为肺原发灶,GTVnd为影像学可疑阳性淋巴结。临床靶体积(clinical target volume,CTV)为GTV外放6~8 mm。CTVnd为GTVnd外放5 mm并包括相应淋巴结区域。计划靶区体积(planning target volume,PTV)根据肺叶及呼吸移动度大小的不同在CTV基础上三维方向外扩5~10 mm。使用三维适形放疗或调强放疗,95%处方剂量为59.4~66 Gy/30~33次。每次放疗前均采用锥形束CT进行在线配准, 保证误差范围在5 mm以内。
(2) 放化疗模式及方案:患者接受放化疗结合的综合治疗,包括同步放化疗及序贯放化疗。患者接受含铂类联合方案化疗, 另一种药物包括依托泊苷、紫杉醇、多西他赛、培美曲塞、长春瑞滨。具体化疗方案:①紫杉醇135~175 mg/m2, 第1天;顺铂75 mg/m2,第1天。②多西他赛75 mg/m2,第1天;顺铂75 mg/m2,第1天。③培美曲塞500 mg/m2,第1天;顺铂75 mg/m2,第1天。④长春瑞滨25 mg/m2,第1、8天;顺铂80 mg/m2,第1天。⑤依托泊苷50 mg/m2,第1~5天,第29~33天;顺铂50 mg/m2,第1、8、29、36天。同步放化疗组包括同期接受放化疗或放疗前接受≤2周期化疗的患者,序贯放化疗组先给予上述化疗方案4~6周期,患者结束化疗后的2周内进行放疗。
3. 分组:根据患者治疗前血液学检测结果,对患者进行LIPI分组,将患者分成LIPI优、良、差3组[9],分别为dNLR≤3及LDH≤正常值上限(ULN),dNLR>3或LDH>ULN,dNLR>3及LDH>ULN。本研究LIPI优、良、差3组分布分别为72.3%(172例)、18.9%(45例)、8.8%(21例)。
4. 随访及疗效评价:在放化疗前、放化疗后1个月、2年内每3个月、2年后每半年复查胸部增强CT,同时进行血常规、生化、肿瘤标志物等血液学检测,有额外症状或体征者增加相应部位检查,必要时行PET-CT或明确病理。参照实体瘤疗效评价标准(response evaluation criteria in solid tumor,RESIST)进行疗效评价[10]。根据病灶缩减的百分比将临床疗效分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease,PD)。总生存(overall survival,OS)计算从首次治疗开始至任何原因导致死亡为止的时间。无进展生存(progression-free survival,PFS)计算从首次治疗开始至肿瘤首次进展或死亡时间。
5. 统计学处理:采用SPSS 24.0软件行Kaplan-Meier法计算生存率,Log-rank法及Cox回归检验比较生存差异。P<0.05为差异有统计学意义。
结果1. 临床资料:共入组238例LA-NSCLC患者,全组患者的中位年龄为62岁(29~84岁)。最常见剂量方案为60 Gy/30次(55.9%)。详见表 1。肿瘤进展后进行1~5线治疗, 部分患者进展后未继续治疗,中位数为1线治疗。
2. 生存分析:入组患者中共有166例患者接受放化疗后出现疾病进展,中位PFS 16.1个月。其中局部进展104例,远处转移62例。进展后有19例患者行靶向治疗,57例患者行化疗,22例患者行免疫治疗,6例患者行化疗联合免疫治疗,6例患者对远处转移病灶进行姑息放疗,56例患者肿瘤进展后未行进一步治疗,各治疗患者OS差异无统计学意义(P=0.08),但靶向治疗OS有延长趋势。随访截至2021年10月21日,中位随访时间37.1个月,共139位患者死亡,均死于肿瘤或其并发症。全组中位OS 30.6个月,见图 1。
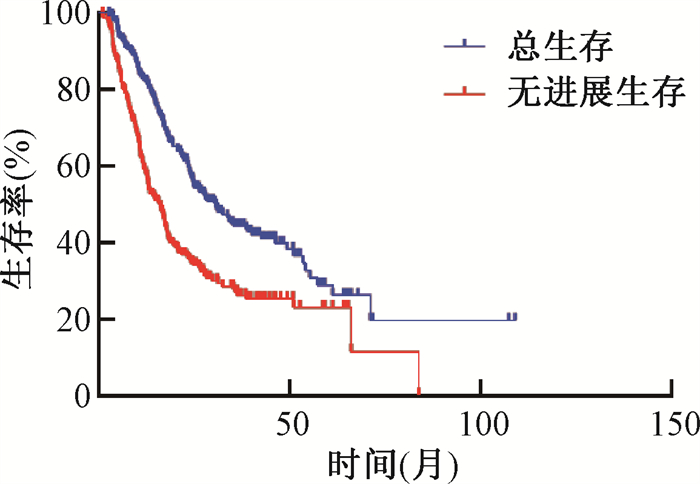
|
图 1 238例局部晚期非小细胞肺癌患者放化疗后总生存和无进展生存曲线 Figure 1 Overall survival and progression-free survival curves of LA-NSCLC 238 patients treated with chemoradiotherapy |
3. 单因素分析:对患者年龄、性别、吸烟史、TNM分期、肿瘤部位、病理类型、EGFR突变、放疗剂量、放化疗模式、LIPI分组分别进行Log-rank法单因素分析,结果显示,可影响OS的因素包括性别、病理类型、EGFR突变和LIPI分组,见图 2,表 2。LIPI分组是可影响PFS的因素,见图 3。LIPI差组相较于优、良组有较差的PFS及OS,1、3、5年PFS率及OS率见表 3。
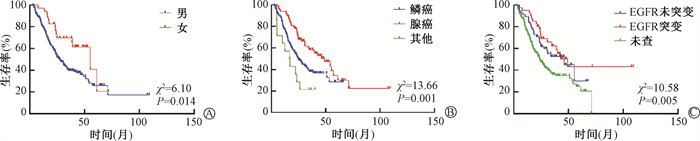
|
图 2 238例局部晚期非小细胞肺癌患者放化疗后总生存(OS)曲线亚组比较 A.性别;B.病理类型;C.EGFR突变状态 Figure 2 Comparison of overall survival (OS) curves of subgroups of 238 LA-NSCLC patients treated with chemoradiotherapy A.Gender; B.Pathological type; C.EGFR mutation status |
|
|
表 2 238例局部晚期非小细胞肺癌患者无进展生存期(PFS)和总生存期(OS)单因素分析 Table 2 Univariate analysis of the progression-free survival and the overall survival of 238 LA-NSCLC patients |
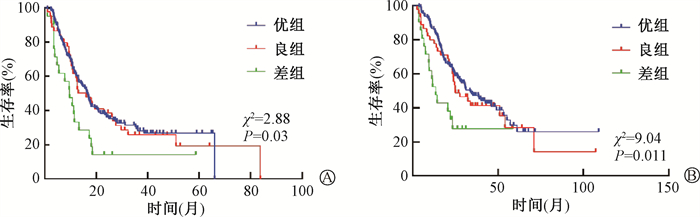
|
图 3 238例局部晚期非小细胞肺癌患者放化疗后LIPI分组间的不同生存曲线比较 A.无进展生存;B.总生存 Figure 3 Comparison of different survival curves of LIPI groups of 238 LA-NSCLC patients treated with chemoradiotherapy A.PFS; B.OS |
|
|
表 3 238例局部晚期非小细胞肺癌患者放化疗后不同LIPI分组无进展生存率及总生存率 Table 3 Progression-free survival and overall survival of different LIPI groups of 238 LA-NSCLC patients |
4.放化疗模式:同步放化疗OS、PFS与序贯放化疗差异无统计学意义(P>0.05)。但同步放化疗较序贯放化疗有较好的PFS及OS,见表 4。
|
|
表 4 局部晚期非小细胞肺癌患者不同放化疗模式无进展生存率及总生存率 Table 4 Progression-free survival and overall survival of LA-NSCLC patients treated with different chemoradiotherapy patterns |
5.多因素分析:对单因素分析有意义的因素性别、病理类型、EGFR突变和LIPI分组进行Cox回归法多因素分析,结果显示,EGFR突变与LIPI分组是OS的独立预后因素,见表 5。
|
|
表 5 238例局部晚期非小细胞肺癌患者总生存期(OS)多因素分析 Table 5 Multivariate analysis of overall survival(OS) of 238 LA-NSCLC patients |
讨论
在全球范围内,肺癌是男性人群中发病率和死亡率最高的恶性肿瘤;在女性人群中,其发病率仅次于乳腺癌,死亡率高居榜首[11]。LA-NSCLC患者的临床治疗决策往往需要多学科共同参与和制订,同步放化疗是其标准治疗,虽然治疗目的是治愈,但大多数患者仍会有肿瘤进展[12]。接受放化疗的LA-NSCLC患者5年生存率仅为15%~30%[13]。LA-NSCLC患者异质性较高,生存差异明显,因此,寻找与预后相关的生物标志物,筛选获益人群显得尤为重要。
LIPI分组最初是被用来预测NSCLC患者ICI治疗的反应性[14],从而指导治疗选择,这可能是因为LDH及dNLR可反映机体炎症状态且可用来衡量肿瘤负荷[15-16]。有研究表明,LIPI可能有助于识别不太可能从ICI治疗中获益的患者,而在接受化疗的患者中并未发现LIPI与预后的关系[6, 9]。但是,LIPI分组可能并不是与ICI治疗预后相关的特异性生物标志物,在放化疗及靶向治疗中亦有指导作用。在弗林德斯大学的一项临床研究中,1 489例接受ICI治疗的NSCLC患者,LIPI与OS、PFS和反应性显著相关,且对于687例行多西他赛化疗的治疗组中,LIPI与OS和反应性也存在相似的关联[17]。另外,Kazandjian等[18]证实在接受靶向治疗的NSCLC患者中,良好的LIPI分组也同样与较好的OS存在相关性。与中国医学科学院肿瘤医院的一项研究结果相同[19],本研究显示,LIPI分组同样与行放化疗的LA-NSCLC患者的PFS及OS显著相关。在本次回顾性研究中,首先评估了LIPI分组对LA-NSCLC患者预后的影响,将患者分为LIPI优、良、差3组。结果显示差组患者的死亡、进展风险明显高于优与良组。单因素分析结果显示,可影响OS的因素包括性别、病理类型、EGFR突变和LIPI分组。仅LIPI分组是可影响PFS的因素。LIPI差组患者的1、3、5年PFS率及OS率均显著低于良与优组患者,而良与优组患者间未见明显差异。多因素分析显示,LIPI分组与患者OS具有独立相关性。因此,LIPI可作为预后指标筛选LA-NSCLC放化疗疗效较差的患者,对临床治疗具有一定的指导意义。现有的临床结果表明,LIPI分组与NSCLC患者ICI治疗、靶向治疗及放化疗预后存在相关性。
本研究多因素分析显示除LIPI分组外,EGFR突变也是OS的独立预后因素。近年来的研究发现,部分肺腺癌患者可发生EGFR基因突变,其中约90%为EGFR基因中的21和19号外显子突变[20]。表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)是一种小分子药物,它通过与ATP竞争结合于细胞膜EGFR基因的酪氨酸区域,阻止酪氨酸磷酸化,抑制细胞内一系列与肿瘤细胞的形成、增殖、凋亡相关的信号通路级联反应,从而抑制肿瘤细胞的增殖[21]。本研究40例EGFR突变患者中有19例患者接受EGFR-TKI治疗,这部分患者OS有延长趋势。但由于本研究入组鳞癌患者较多,且早年间进行基因检测患者数目较少,因此入组患者中有143例(60.1%)未行基因检测。
除此之外,多项临床研究证实,晚期NSCLC接受同步放化疗者与接受序贯放化疗者相比,可获得较大的临床获益[22]。本研究中,同步放化疗1、3、5年PFS率均高于序贯放化疗,且3年与5年PFS率相同,1年和5年OS率高于序贯放化疗。因此,虽然差异无统计学意义,但同步放化疗有延长长期生存和降低局部复发率的趋势。组间差异无统计学意义可能与组间病例分布不均衡有关。
本文的不足是本研究是单中心回顾性分析,各不同治疗组的病例分布不均衡,患者具体治疗方案也不尽相同,因而得出的结论需要大样本量的前瞻性研究进一步证实。
综上所述,LIPI分组与患者放化疗预后相关。LIPI分组的优势在于简单易行,能够识别高风险患者,可考虑作为预后指标应用于临床工作。
利益冲突 无
作者贡献声明 王韵涵负责设计研究方案, 研究实施及论文撰写; 郑晓丽、孙亚楠负责设计研究方案与论文修改; 王晓辉、罗辉、叶柯参与论文修改; 程宸、杨洋、但勤富参与数据的收集工作; 葛红负责论文总体修改与最终审校
| [1] |
Siege RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [2] |
Vinod SK, Hau E. Radiotherapy treatment for lung cancer: Current status and future directions[J]. Respirology, 2020, 25(Suppl 2): 61-71. DOI:10.1111/resp.13870 |
| [3] |
Xiao W, Hong M. Concurrent vs sequential chemoradiotherapy for patients with advanced non-small-cell lung cancer: a meta-analysis of randomized controlled trials[J]. Medicine (Baltimore), 2021, 100(11): e21455. DOI:10.1097/MD.0000000000021455 |
| [4] |
Koning CC, Wouterse SJ, Daams JG, et al. Toxicity of concurrent radiochemotherapy for locally advanced non-small-cell lung cancer: a systematic review of the literature[J]. Clin Lung Cancer, 2013, 14(5): 481-487. DOI:10.1016/j.cllc.2013.03.002 |
| [5] |
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [6] |
Mezquita L, Auclin E, Ferrara R, et al. Association of the lung immune prognostic index with immune checkpoint inhibitor outcomes in patients with advanced non-small cell lung cancer[J]. JAMA Oncol, 2018, 4(3): 351-357. DOI:10.1001/jamaoncol.2017.4771 |
| [7] |
Minami S, Ihara S, Komuta K. Pretreatment lung immune prognostic index is a prognostic marker of chemotherapy and epidermal growth factor receptor tyrosine kinase inhibitor[J]. World J Oncol, 2019, 10(1): 35-45. DOI:10.14740/wjon1179 |
| [8] |
Xie J, Zang Y, Liu M, et al. The lung immune prognostic index may predict the efficacy of different treatments in patients with advanced NSCLC: a Meta-analysis[J]. Oncol Res Treat, 2021, 44(4): 164-175. DOI:10.1159/000514443 |
| [9] |
Aldea M, Benitez JC, Mezquita L. The lung immune prognostic index (LIPI) stratifies prognostic groups in advanced non-small cell lung cancer (NSCLC) patients[J]. Transl Lung Cancer Res, 2020, 9(4): 967-970. DOI:10.21037/tlcr.2020.04.14 |
| [10] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [11] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [12] |
Cheema PK, Rothenstein J, Melosky B, et al. Perspectives on treatment advances for stage III locally advanced unresectable non-small-cell lung cancer[J]. Curr Oncol, 2019, 26(1): 37-42. DOI:10.3747/co.25.4096 |
| [13] |
Gray JE, Villegas A, Daniel D, et al. Three-year overall survival with durvalumab after chemoradiotherapy in stage III NSCLC-update from PACIFIC[J]. J Thorac Oncol, 2020, 15(2): 288-293. DOI:10.1016/j.jtho.2019.10.002 |
| [14] |
Wang W, Huang Z, Yu Z, et al. Prognostic value of the lung immune prognostic index may differ in patients treated with immune checkpoint inhibitor monotherapy or combined with chemotherapy for non-small cell lung cancer[J]. Front Oncol, 2020, 10: 572853. DOI:10.3389/fonc.2020.572853 |
| [15] |
Dall'Olio FG, Marabelle A, Caramella C, et al. Tumour burden and efficacy of immune-checkpoint inhibitors[J]. Nat Rev Clin Oncol, 2022, 19(2): 75-90. DOI:10.1038/s41571-021-00564-3 |
| [16] |
Auclin E, Vuagnat P, Smolenschi C, et al. Association of the lung immune prognostic index with immunotherapy outcomes in mismatch repair deficient tumors[J]. Cancers (Basel), 2021, 13(15): 3776. DOI:10.3390/cancers13153776 |
| [17] |
Sorich MJ, Rowland A, Karapetis CS, et al. Evaluation of the lung immune prognostic index for prediction of survival and response in patients treated with atezolizumab for NSCLC: pooled analysis of clinical trials[J]. J Thorac Oncol, 2019, 14(8): 1440-1446. DOI:10.1016/j.jtho.2019.04.006 |
| [18] |
Kazandjian D, Gong Y, Keegan P, et al. Prognostic value of the lung immune prognostic index for patients treated for metastatic non-small cell lung cancer[J]. JAMA Oncol, 2019, 5(10): 1481-1485. DOI:10.1001/jamaoncol.2019.1747 |
| [19] |
Zhang T, Xue W, Wang D, et al. A validation study on the lung immune prognostic index for prognostic value in patients with locally advanced non-small cell lung cancer[J]. Radiother Oncol, 2021, 156: 244-250. DOI:10.1016/j.radonc.2020.12.039 |
| [20] |
Tang Y, Wang WY, Zheng K, et al. EGFR mutations in non-small cell lung cancer: an audit from West China Hospital[J]. Expert Rev Mol Diagn, 2016, 16(8): 915-919. DOI:10.1080/14737159.2016.1199961 |
| [21] |
Lemmon MA, Schlessinger J. Cell signaling by receptor tyrosine kinases[J]. Cell, 2010, 141(7): 1117-1134. DOI:10.1016/j.cell.2010.06.011 |
| [22] |
Liang HY, Zhou H, Li XL, et al. Chemo-radiotherapy for advanced non-small cell lung cancer: concurrent or sequential? It's no longer the question: a systematic review[J]. Int J Cancer, 2010, 127(3): 718-728. DOI:10.1002/ijc.25087 |
 2022, Vol. 42
2022, Vol. 42


