随着电离辐射应用日渐广泛,意外事故及放射治疗不良反应逐渐增多。电离辐射损伤严重影响患者的生活质量[1-2]。电离辐射会导致细胞内活性氧(ROS)累积,伴随DNA损伤[3-6]。DNA损伤可致内质网过度延展,Ca2+大量转运至线粒体,导致细胞凋亡[5]。目前,植物天然提取物在辐射损伤防护和救治的研究中逐步应用[7-8],而部分天然产物稳定性差、时效短[9],具有一定局限性。
植物的电离辐射耐受度普遍较高,曾有研究总结多种草本植物半致死剂量,发现景天科植物具有较高耐受度,其中东南景天为500 Gy[10]。东南景天是一种对镉、锌、铅的耐受度和积累量较高的植物[11]。除东南景天自身稳定的脱落酸水平[12]、内生菌影响[13]和土壤微生物影响[14]以外,其敏感的Ca2+信号通路也起重要作用,直接影响了重金属在植物体内的分布[15]。目前,东南景天提取物在辐射损伤救治中的作用尚未见报道。
本研究以人小肠上皮细胞HIEC-6为模型,使用东南景天提取物(SafE)进行处理并照射,发现SafE可减少细胞辐射损伤,并通过转录组分析发现靶基因PRKN。本研究成果将为辐射损伤防护提供新的候选药物,并为以PRKN为靶点的电离辐射损伤研究提供实验依据。
材料与方法1. 细胞培养:人小肠上皮细胞HIEC-6培养于含有10%胎牛血清的RPMI 1640完全培养基中。将细胞分为对照组(Con)、照射组(IR)、单独提取物组(SafE)、提取物照射组(SafE+IR)。SafE经提取后,使用磷酸盐缓冲液(PBS,8 mmol/L Na2HPO4,136 mmol/L NaCl,2 mmol/L KH2PO4,2.6 mmol/L KCl),溶解膏状提取物至0.2 g/ml制成母液,SafE母液经0.22 μm无菌过滤头过滤。SafE组细胞需待完全培养基传代的细胞贴壁后,替换为含0.02 g/ml SafE的RPMI 1640完全培养基正常培养。
2. 东南景天成分提取:取东南景天干燥全草,粉碎后,用10倍质量的体积、70%乙醇溶液浸泡24 h,加热回流提取1.5 h,过滤,弃药渣,蒸发浓缩至获得膏状提取物,即为浓浸膏,使用双蒸水、细胞培养基或PBS溶解至所需浓度,或膏体置于4℃中备用。
3. 照射条件:放射源采用137Cs装置产生的γ射线(GammacellⓇ 40 Exactor,剂量率0.84 Gy/min,加拿大原子能有限公司),细胞培养皿封口,置于137Cs放射源下照射,培养皿面上覆盖1.5 cm厚等效蜡板,以消除剂量建成效应。
4. 转录组分析:选择样本总RNA总量≥800 ng,使用建库试剂盒(Illumina,NEBNextⓇ UltraTM RNA Library Prep Kit,美国),根据说明书流程,完成建库操作。计算每个基因的读数,根据基因的长度计算每个基因的FPKM,并计算映射到该基因的读数。FPKM指每百万碱基对测序的转录本序列片段的每千碱基片段的预期数量。同时考虑了测序深度和基因长度对读数计数的影响,这是当前最常用于估计基因表达水平的方法。
5. 细胞活力检测:将待检测细胞铺至96孔板中,每孔100 μl,每个样本每个处理设置8个复孔,正常培养至贴壁后,每100 μl加入10 μl CCK-8检测液,37℃孵箱静置1 h后,使用酶标仪测定每孔在450 nm处的吸光度。
6. 内质网观察:内质网观察使用ER-Tracker(SY0591,北京百奥莱生物科技有限公司)检测。将正常培养的细胞按照实验需求分组,IR组和SafE+IR组照射后继续培养24 h,随后吸去培养基,使用Hank′s缓冲液(160 g/L NaCl,2 g/L MgSO4·7H2O,8 g/L KCl,2 g/L MgCl2·6H2O,2.8 g/L CaCl2)将荧光探针按1 ∶1 000稀释,加入至细胞培养皿中并置于37℃染色15~30 min,随后使用Hank′s或PBS缓冲液清洗细胞,于激光共聚焦显微镜下观察荧光。细胞核染色则使用4′,6-二脒基-2-苯基吲哚(DAPI)染色液(北京索莱宝科技有限公司)染色10 min后,使用PBS洗掉非特异残留的染色液后,于激光共聚焦显微镜下观察。ER-Tracker使用激发波长为561 nm,发射波长接收段为600~650 nm;4′-6-二脒基-2-苯基吲哚DAPI使用激发波长为405 nm,发射波长接收段为450~500 nm。
7. 实时定量PCR:待检测基因的引物合成自苏州金唯智生物科技有限公司。引物用双蒸水稀释至10 mmol/L后-20℃保存。取待检测基因的上下游引物,按照实际使用量稀释20倍(即每100 μl引物混合液中,加入上下游引物各5 μl)。每个反应孔中加入8 μl引物混合液、10 μl SybrGreen、2 μl cDNA,每个样本的每个基因检测设置4个复孔。每组数据重复3次以上。
8. 统计学处理:采用SPSS 25.0软件对数据进行统计学分析。采用Kolmogorov-Smirnov法检验数据是否符合正态分布(P>0.1为符合正态分布),符合正态分布的数据采用x±s表示。采用Hartley检验验证数据是否符合方差齐性(P>0.1为符合方差齐性),对符合正态分布且方差齐性的数据采用独立样本t检验。P < 0.05为差异有统计学意义。
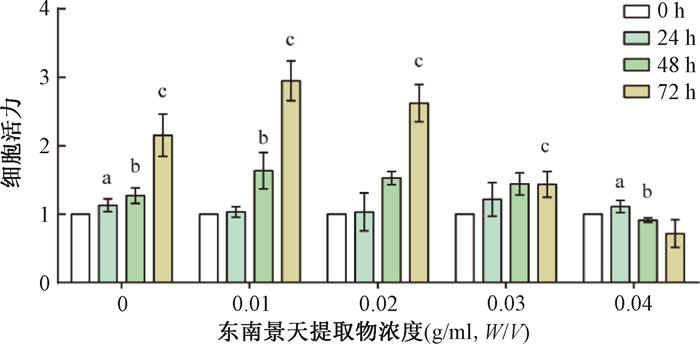
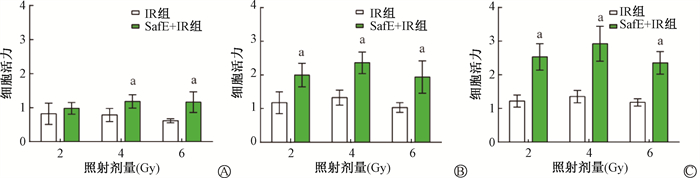
结果1. 东南景天提取物可减少HIEC-6细胞辐射损伤:对HIEC-6进行最适SafE药物处理浓度筛选。SafE使用浓度>0.02 g/ml(W/V)时,细胞生长受到影响,0.03 g/ml SafE处理时,细胞活力无显著增长(P>0.05)。因此,将使用0.02 g/ml浓度作为SafE处理浓度,见图 1。细胞经0.02 g/ml SafE处理24 h后,进行2、4、6 Gy照射,照后24、48和72 h,SafE+IR组与IR组相比,4 Gy和6 Gy细胞活力在不同时间点均出现差异有统计学意义(t=2.94、4.24、5.27、4.96、5.87、10.40,P < 0.05)。图 2B和2C中,2 Gy辐照后,48和72 h的SafE+IR组的细胞活力均显著高于对照组(t=6.35、9.50,P < 0.05)。以上结果表明,SafE处理可有效减少细胞受到的辐射损伤,见图 2。
|
注:细胞活力指各时间点与0 h细胞数的比值。a与同一浓度0 h比较,t=7.66、3.21,P<0.05;b与同一浓度24 h比较,t=-3.95、7.60、-5.74,P<0.05;c与同一浓度48 h比较,t=14.10、10.26、18.19、5.18,P<0.05 图 1 SafE的最适浓度筛选 Figure 1 Optimal concentration screening of Sedum alfredii extracts |
|
注:细胞活力值为各时间点与0 h细胞数的比值。a与同一剂量IR组相比,t=2.94、4.24、6.35、5.27、4.96、9.50、5.87、10.40,P<0.05 图 2 HIEC-6的细胞活力检测 A.照后24 h;B.照后48 h;C.照后72 h Figure 2 Cell viability assay of HIEC-6 cells after SafE treatment and irradiation A. 24 h post-irradiation; B. 48 h post-irradiation; C. 72 h post-irradiation |
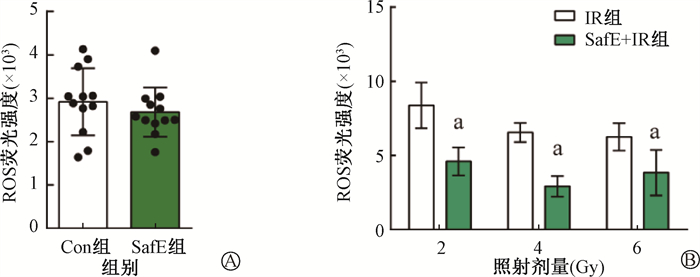
2. 东南景天提取物处理可降低细胞内ROS水平:结果如图 3所示。SafE组细胞的ROS水平与Con组差异无统计学意义(P>0.05),即在正常情况下,SafE对细胞内ROS水平没有影响。当细胞分别接受2、4和6 Gy照射时,SafE处理可有效降低胞内ROS水平(t=-11.71、-13.29、-4.53,P<0.05)。因此,确定SafE处理可抑制辐照后细胞内ROS的累积。
|
注:a与同一剂量IR组相比,t=-11.71、-13.29、-4.53,P<0.05;ROS.活性氧 图 3 SafE组(A)和SafE + IR组(B)HIEC-6细胞内ROS含量 Figure 3 Intracellular ROS levels in HIEC-6 cells of SafE group (A) and SafE + IR group (B) |
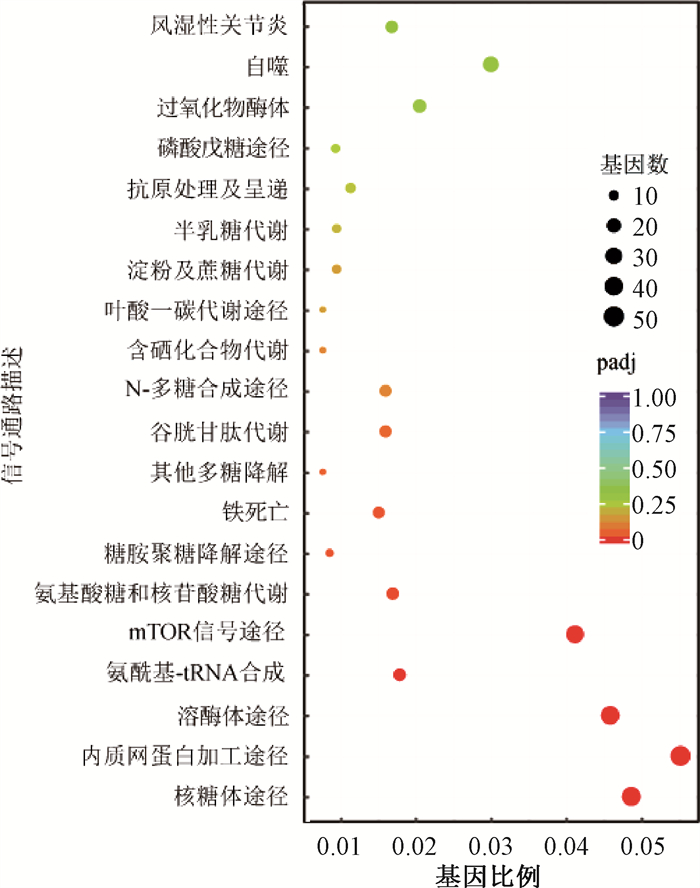
3. 东南景天提取物通过E3泛素连接酶PRKN发挥作用:为进一步探究SafE的作用机制,使用SafE+IR组与IR组进行转录组分析。经比对,mRNA水平差异有统计学意义的基因为8 440个,其中上调基因为3 826个,下调基因为4 614个。通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析,获得差异基因富集的信号通路。如图 4所示,内质网相关信号通路富集度较高。其中差异最显著的基因为E3泛素连接酶PRKN。实时定量PCR检测显示,HIEC-6细胞中PRKN对辐照敏感,4 Gy照射后mRNA水平显著下降(图 5)。SafE处理可维持胞内PRKN表达水平(P>0.05)。综上可知,SafE的靶基因之一为PRKN。
|
图 4 SafE+IR组照后24 h细胞内差异基因的KEGG分析图 Figure 4 KEGG analysis of differential expressed genes in SafE+IR group cells at 24 h post-irradiation |

|
注:内参基因为GAPDH。a与Con组相比,t=-5.55, P<0.05 图 5 SafE处理或照射后HIEC-6细胞内的PRKN转录水平检测 Figure 5 PRKN transcript levels in HIEC-6 cells after treatment of SafE and/or irradiation |
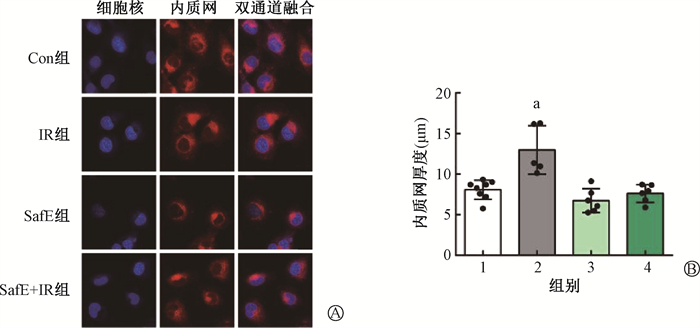
4. 东南景天提取物可抑制辐照引起的内质网延展:通过对各处理组HIEC-6细胞内质网染色观察,发现经4 Gy照射后,IR组内质网增厚加宽,SafE+IR组内质网则无此现象。照射可显著促进内质网的延展(t=3.273,P < 0.05),SafE处理可抑制这一过程(P>0.05)(图 6)。
|
注:1.Con组;2.IR组;3.SafE组;4.SafE+IR组;a与Con组相比,t=3.27,P<0.05 图 6 SafE处理或照射后HIEC-6细胞内质网厚度的观察 A.激光共聚焦显微镜下观察内质网ER-Tracker荧光染色×40;B.内质网厚度统计 Figure 6 The thicknesses of endoplasmic reticulum in HIEC-6 cells after SafE treatment or irradiation A. ER-Tracker fluorescent staining of endoplasmic reticulum under a laser confocal microscope ×40; B. The thicknesses of ER in different groups |
讨论
电离辐射会引起细胞多方面损伤,细胞线粒体受损后,导致ROS累积[16-17],造成DNA双链断裂[18]。在本研究中,采用SafE处理,发现受照细胞内ROS累积量减少、细胞活力得以维持。通过转录组分析发现,受照细胞经SafE处理后,响应信号主要集中在核糖体途径、内质网相关信号图路、溶酶体途径、mTOR信号通路等。其中差异最显著的基因为E3泛素连接酶PRKN。经实时定量PCR验证,PRKN受电离辐射影响下调,SafE处理可稳定受照细胞内的PRKN转录水平。线粒体与内质网的连接对Ca2+的流向至关重要,Ca2+过度累积会直接造成线粒体障碍[19-21]。有研究表示,PINK1-PRKN介导的信号通路对线粒体障碍响应有重要作用,PINK1-PRKN的表达缺陷和修饰错误是多种疾病形成的主要原因[22]。PRKN过度表达可增加内质网延展度,加大与线粒体的接触面积,导致线粒体自噬[23-24]。通过荧光探针染色观察发现,受照细胞内质网的延展可被SafE抑制,这表示SafE可能通过调控内质网与线粒体的连接实现辐射防护作用。这一现象是否与PRKN转录水平有关,是否会影响Ca2+流向仍然未知。虽然本研究使用人小肠上皮细胞开展实验,但目前已知PRKN在小鼠体内主要表达在大脑皮层,它的错误表达直接导致神经系统疾病和衰老,目前没有PRKN与其他病症的相关工作报道。因此,电离辐射后的小鼠造血系统、小肠或结肠中的PRKN表达情况是否会受影响,是否可以通过SafE给药处理后有所缓解仍然未知,这将是未来工作的重点方向。本研究发现电离辐射降低PRKN转录水平,并调控内质网延展,这将为未来开展电离辐射损伤和救治相关研究提供实验依据。
东南景天未记载于中医药相关书籍中,将东南景天提取物作为药物进行处理是基于东南景天对电离辐射的高耐受度[10]。本研究首次提出东南景天提取物可作为辐射损伤药物使用,但其有效活性成分未知。植物体内产物复杂,其活性成分的分析和分离是未来临床使用的最佳方案。
综上所述,本研究发现东南景天提取物可有效缓解人小肠上皮细胞的辐射损伤,抑制细胞内因辐照引起的ROS累积、PRKN表达水平降低等现象,初步解释了东南景天提取物在细胞水平上的作用机制。这项工作将为未来开展更多植物天然产物救治辐射损伤的研究奠定实验基础,并为开发救治药物提供新的思路。
利益冲突 本研究由署名作者按以下贡献声明独立开展, 不涉及任何利益冲突
作者贡献声明 朱彤负责现场实验的实施和论文撰写; 贺俊博负责现场实验的实施; 武欣负责东南景天的提取; 王周旋负责数据分析; 樊赛军负责提供实验思路、指导课题设计、审阅和修改论文
| [1] |
Fliedner TM, Graessle D, Meineke V, et al. Pathophysiological principles underlying the blood cell concentration responses used to assess the severity of effect after accidental whole-body radiation exposure: an essential basis for an evidence-based clinical triage[J]. Exp Hematol, 2007, 35(4 Suppl 1): 8-16. DOI:10.1016/j.exphem.2007.01.006 |
| [2] |
陈犹白, 柴密, 乌兰哈斯, 等. 放射性损伤: 类型、症状和机制[J]. 中华损伤与修复杂志(电子版), 2017, 12(3): 203-206. Chen YB, Chai M, Wulan H, et al. Radiation induced injury: classification, manifastation, and mechanism[J]. Chin J Injury Repair Wound Healing (Electr Edit), 2017, 12(3): 203-206. DOI:10.3877/cma.j.issn.1673-9450.2017.03.010 |
| [3] |
Yamamori T, Yasui H, Yamazumi M, et al. Ionizing radiation induces mitochondrial reactive oxygen species production accompanied by upregulation of mitochondrial electron transport chain function and mitochondrial content under control of the cell cycle checkpoint[J]. Free Radical Biol Med, 2012, 53(2): 260-270. DOI:10.1016/j.freeradbiomed.2012.04.033 |
| [4] |
Cheng B, Xu A, Qiao M, et al. BECN1s, a short splice variant of BECN1, functions in mitophagy[J]. Autophagy, 2015, 11(11): 2048-2056. DOI:10.1080/15548627.2015.1100785 |
| [5] |
Zheng P, Chen Q, Tian X, et al. DNA damage triggers tubular endoplasmic reticulum extension to promote apoptosis by facilitating ER-mitochondria signaling[J]. Cell Res, 2018, 28(8): 833-854. DOI:10.1038/s41422-018-0065-z |
| [6] |
Liu L, Sakakibara K, Chen Q, et al. Receptor-mediated mitophagy in yeast and mammalian systems[J]. Cell Res, 2014, 24(7): 787-795. DOI:10.1038/cr.2014.75 |
| [7] |
Lu L, Dong J, Li D, et al. 3, 3'-diindolylmethane mitigates total body irradiation-induced hematopoietic injury in mice[J]. Free Radical Biol Med, 2016, 99: 463-471. DOI:10.1016/j.freeradbiomed.2016.09.007 |
| [8] |
Jardim FR, de Rossi FT, Nascimento MX, et al. Resveratrol and brain mitochondria: a review[J]. Mol Neurobiol, 2018, 55(3): 2085-2101. DOI:10.1007/s12035-017-0448-z |
| [9] |
薛晓蕾, 韩晓丹, 张俊伶, 等. 花青素对电离辐射引起骨髓c-kit阳性细胞损伤防护作用的体外研究[J]. 天津医药, 2017, 45(1): 1-4. Xue XL, Han XD, Zhang JL, et al. The protective effect of anthocyanin on irradiation induced bone marrow c-kit positive cell injury in vitro[J]. Tianjin Med J, 2017, 45(1): 1-4. DOI:10.11958/20160702 |
| [10] |
Sparrow AH, Schairer LA, Sparrow RC. Relationship between nuclear volumes, chromosome numbers, and relative radiosensitivities[J]. Science, 1963, 141(3576): 163-166. DOI:10.1126/science.141.3576.163 |
| [11] |
Pollard AJ, Reeves RD, Baker AJ. Facultative hyperaccumulation of heavy metals and metalloids[J]. Plant Sci, 2014, 217-218: 8-17. DOI:10.1016/j.plantsci.2013.11.011 |
| [12] |
Tao Q, Jupa R. Abscisic acid-mediated modifications of radial apoplastic transport pathway play a key role in cadmium uptake in hyperaccumulator Sedum alfredii[J]. Plant Cell Environ, 2019, 42(5): 1425-1440. DOI:10.1111/pce.13506 |
| [13] |
Wang Q, Ye J, Wu Y, et al. Promotion of the root development and Zn uptake of Sedum alfredii was achieved by an endophytic bacterium Sasm05[J]. Ecotoxicol Environ Saf, 2019, 172: 97-104. DOI:10.1016/j.ecoenv.2019.01.009 |
| [14] |
Hou D, Lin Z, Wang R, et al. Cadmium exposure-sedum alfredii planting interactions shape the bacterial community in the hyperaccumulator plant rhizosphere[J]. Appl Environ Microbiol, 2018, 84(12): e02797-02817. DOI:10.1128/aem.02797-17 |
| [15] |
Tian S, Xie R, Wang H, et al. Calcium deficiency triggers phloem remobilization of cadmium in a hyperaccumulating species[J]. J Plant Physiol, 2016, 172(4): 2300-2313. DOI:10.1104/pp.16.01348 |
| [16] |
Lin MT, Beal MF. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases[J]. Nature, 2006, 443(7113): 787-795. DOI:10.1038/nature05292 |
| [17] |
Sun L, Wang H, Xu D, et al. Lapatinib induces mitochondrial dysfunction to enhance oxidative stress and ferroptosis in doxorubicin-induced cardiomyocytes via inhibition of PI3K/Akt signaling pathway[J]. Bioengineered, 2022, 13(1): 48-60. DOI:10.1080/21655979.2021.2004980 |
| [18] |
Karanjawala ZE, Murphy N, Hinton DR, et al. Oxygen metabolism causes chromosome breaks and is associated with the neuronal apoptosis observed in DNA double-strand break repair mutants[J]. Curr Biol, 2002, 12(5): 397-402. DOI:10.1016/s0960-9822(02)00684-x |
| [19] |
Peggion C, Massimino ML. Regulation of endoplasmic reticulum-mitochondria tethering and Ca(2+) fluxes by TDP-43 via GSK3β[J]. Int J Mol Sci, 2021, 22(21): 11853. DOI:10.3390/ijms222111853 |
| [20] |
Tiwary S, Nandwani A, Khan R, et al. GRP75 mediates endoplasmic reticulum-mitochondria coupling during palmitate-induced pancreatic β-cell apoptosis[J]. J Biol Chem, 2021, 297(6): 101368. DOI:10.1016/j.jbc.2021.101368 |
| [21] |
Kovacs G, Reimer L, Jensen PH. Endoplasmic reticulum-based calcium dysfunctions in synucleinopathies[J]. Frontiers Neurol, 2021, 12: 742625. DOI:10.3389/fneur.2021.742625 |
| [22] |
Yao J, Wang J, Xu Y, et al. CDK9 inhibition blocks the initiation of PINK1-PRKN-mediated mitophagy by regulating the SIRT1-FOXO3-BNIP3 axis and enhances the therapeutic effects involving mitochondrial dysfunction in hepatocellular carcinoma[J]. Autophagy, 2021, 10: 1-19. DOI:10.1080/15548627.2021.2007027 |
| [23] |
Yan C, Gong L, Chen L, et al. PHB2 (prohibitin 2) promotes PINK1-PRKN/Parkin-dependent mitophagy by the PARL-PGAM5-PINK1 axis[J]. Autophagy, 2020, 16(3): 419-434. DOI:10.1080/15548627.2019.1628520 |
| [24] |
Niu K, Fang H. USP33 deubiquitinates PRKN/parkin and antagonizes its role in mitophagy[J]. Autophagy, 2020, 16(4): 724-734. DOI:10.1080/15548627.2019.1656957 |
 2022, Vol. 42
2022, Vol. 42


