2. 河北医科大学生理教研室, 石家庄 050011
2. Department of Physiology, Hebei Medical University, Shijiazhuang 050011, China
脑转移癌(brain metastasis,BM)在成人颅内恶性肿瘤中占比较高[1]。随着精准医学的发展,脑转移瘤的检出率进一步提高。BM的发生率呈逐渐上升趋势[2]。目前脑转移常用的治疗方法有手术、立体定向放射外科(stereotactic radiosurgery, SRS)、全脑放疗(whole brain radiation therapy, WBRT)等。日本一项多机构前瞻性研究显示,与2~4个脑转移瘤相比,5~10个脑转移瘤患者的SRS治疗的生存率并不低,但目前临床工作中SRS仍主要针对于脑转移灶≤4个的患者[3],全脑放疗目前仍作为多发脑转移瘤的主要治疗方法。
全脑放疗过程中如不对海马区采取保护措施,会导致海马体的损伤,从而导致海马体依赖性的学习、记忆和空间处理能力受损[4-6]。目前,全脑放疗中海马保护技术主要限于螺旋断层放射治疗(TOMO)中完成,但普及性差。寻找一种有效且经济的减轻神经认知障碍的方法具有一定的临床意义。本课题组前期研究发现,慢性间歇性低压低氧(chronic intermittent hypobaric hypoxia, CIHH)可以减轻放射性心脏损伤[7],既往研究发现CIHH可以抑制癫痫发作,挽救癫痫引起的空间学习和记忆障碍[8],目前并没有关于CIHH预处理对放射性海马损伤方面的研究。本研究通过建立放射性海马损伤模型,观察小鼠海马区病理学变化,并对CIHH预处理后小鼠海马的一些功能学及病理学指标进行观察,以期为放射性海马损伤的预防提供参考。
材料与方法1. 实验动物:小鼠购自北京维通利华公司[SCXK(京)2016-0011],清洁级成年C57BL/6雄性小鼠48只,体重20~25 g,7~8周龄,按照河北医科大学动物饲养标准(室温恒定20~26℃,相对湿度50%~60%,明暗交替为12 h/12 h)饲养。小鼠按完全随机法分为健康对照组、单纯照射(IR)组、CIHH组、CIHH+IR组,每组12只。
2. 照射预实验:将18只小鼠按完全随机法分为5 Gy组、10 Gy组、20 Gy组3组,分别给予5、10、20 Gy剂量照射。射野大小为1.5 cm×1.0 cm,深度为1.0 cm,源皮距为100 cm,吸收剂量率为1.87 Gy/min,照射设备为美国瓦里安Trilogy,6MeV X射线。观察到5 Gy组小鼠照射后4周内行为、饮食均未见明显变化;10 Gy组小鼠放疗结束3 d内饮食、活动量明显减少,并有1只小鼠在此过程内死亡,从第4天开始逐渐恢复正常;20 Gy组小鼠照射后1周内饮食、活动量明显减少,并有3只小鼠在照后2周内死亡,从第3周开始剩余的3只小鼠活动、饮食逐渐恢复正常。为保证造模后小鼠存活可进行后续实验,本研究根据预实验结果采用单次10 Gy照射建立放射性海马损伤模型。10%水合氯醛(0.35 ml/100 g)麻醉小鼠后,呈俯卧位固定于瑞典医科达Pricese医用直线加速器下,小鼠全脑暴露于照射野内,照射结束后将小鼠置于25℃环境中苏醒。
3. CIHH预处理:将CIHH组和CIHH+IR组小鼠置于低压氧舱内,接受相当于海拔5 000 m高度的低压低氧处理(PB=404 mmHg,PaO2=84 mmHg),每天6 h,其余时间与常压常氧环境中饲养,连续28 d。
4. 试剂:乙醇、10%中性甲醛溶液购于北京Ruitaibio公司,甲苯胺蓝购于美国Sigma公司。
5. Mirrors水迷宫:Morris水迷宫为一直径180 cm,高50 cm的圆形白色水池,水域等分为4个象限,直径3cm的白色平台固定放置于第一象限中间位置,低于水面2 cm。环境温度25℃,水温22~24℃。照射后30 d进行Morris水迷宫行为学测试。实验开始前1 d将小鼠置于行为学测试房间,使其适应环境。小鼠测试顺序保持不变,开始象限随机选取。定位航行实验历时5 d,每天4次。将实验动物按照固定顺序面壁放入水中,记录小鼠入水至寻找到平台所需的时间,即逃避潜伏期(escape latency)。小鼠找到平台后,使其停留于平台上10 s;若在60 s内未找到平台,则引导其至平台上,停留10 s,记录逃避潜伏期60 s。第6天进行空间探索实验,撤去平台,将小鼠从平台相对象限面壁放置入水,记录动物60 s内穿越平台区的次数及在平台所在第一象限停留的时间等行为学指标。
6. 组织病理切片染色:水迷宫实验结束后取材,制作海马组织蜡块,尼氏染色观察小鼠海马神经元细胞变化,免疫荧光法检测CA1区DCX表达情况。
7. 统计学处理:采用graph Pad 8.0软件进行统计学分析。所有数据以x±s表示。以“IR”与“CIHH”作为两处理因素做双因素方差分析进行组间比较,选用Post Hoc中的Turkey法进行两两比较。P < 0.05为差异具有统计学意义。
结果1. 记忆认知功能测定:结果显示,4组小鼠随着训练天数增加,逃避潜伏期均缩短。IR组与健康对照组相比,逃避潜伏期从第2天开始延长(P>0.05),第3天开始潜伏期延长差异具有统计学意义(P < 0.001),CIHH+IR组与IR组比较,第2、3天逃避潜伏期缩短(P>0.05),第4、5天差异有统计学意义(P < 0.05),见图 1。

|
注:a与健康对照组比较,P < 0.001;b与IR组比较,P < 0.05 图 1 1 min内各处理组小鼠逃避潜伏期 Figure 1 The escape latency of different groups in 1 min |
2. 空间探索能力:IR组与健康对照组比较,穿越平台次数明显减少(P < 0.001),目标限探索时间明显减少(P < 0.001)。CIHH+IR组与IR组比较,穿越平台次数明显增多(P < 0.05),在第一象限探索时间明显延长(P < 0.05)。表明表明全脑照射可造成小鼠记忆力、认知功能减退。CIHH预处理可减轻小鼠记忆、认知功能障碍。见表 1。
|
|
表 1 1 min内小鼠穿越平台次数及目标象限探索时间(x±s) Table 1 The frequency of mice crossing platform and the exploration time in the first quadrant within 1 min(x±s) |
3. 组织病理学变化
(1) 尼氏染色:IR组与健康对照组相比,小鼠CA1区神经元细胞排列紊乱,神经元细胞肿胀、坏死。CIHH+IR组与IR组相比,小鼠CA1区神经元细胞肿胀、坏死减少,排列较单纯照射组密集、有序。见图 2。
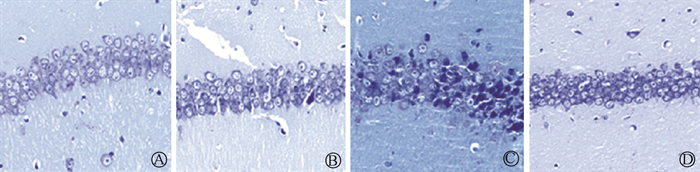
|
图 2 以尼氏染色法检测辐射引起的小鼠海马CA1区神经元变化 ×200 A.健康对照组;B.CIHH组;C.IR组;D.CIHH+IR组 Figure 2 Radiation-induced injury of hippocampal neurons in the CA1 region of mice were detected by Nissl staining ×200 A.Control group; B. CIHH group; C.IR group; D.CIHH+IR group |
(2) 免疫荧光染色:免疫荧光法标记海马CA1区双皮质醇(doublecortin,DCX)表达量,结果显示,与健康对照组相比,IR组小鼠CA1区DCX表达量明显减少。CIHH+IR较IR组神经发生增加。见图 3。
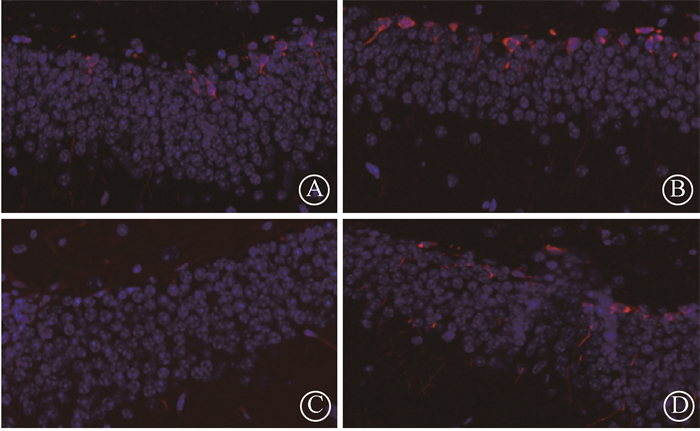
|
图 3 观察小鼠海马CA1区神经发生情况免疫荧光染色 ×200 A.健康对照组;B.CIHH组;C.IR组;D.CIHH+IR组 Figure 3 Immunofluorescence of the expression of DCX in hippocampal CA1 ×200 A. Control group; B. CIHH group; C. IR group; D. CIHH+IR group |
讨论
临床研究发现,全脑放疗引起的认知功能障碍发生在50%的长期生存脑转移瘤患者中[1]。关于如何减轻全脑放疗后记忆认知障碍的研究逐渐受到重视。放射治疗肿瘤学协作组(Radiation Therapy Oncology Group,RTOG)09-33研究结果显示,在现代的放疗技术中,TOMO能在海马区形成较低的剂量分布,从而达到保护海马的目的[9]。但因其价格昂贵,尚未完全普及。RTOG 0614 Ⅲ期临床试验结果显示全脑放疗(37.5 Gy/10次)联合服用美金刚24周可降低17%的神经认知障碍[1]。是否存在其他形式的保护方式尚未可知。
CIHH是指在一段时间内间断短时间暴露于低压低氧环境中,其余时间处于常压常氧环境。人体实验中发现CIHH可运用于运动员的日常训练中,以增加缺氧的耐受性[10]。关于低压低氧对中枢神经系统影响的研究尚不够系统,多为对某些特定指标的观察,科学探索的成分较多,尚未形成可供实际应用的确定结论。CIHH是近年来研究较多的脑损伤保护模型,CIHH通过模拟高原环境,动员内源性适应机制使大脑抵抗缺血性损伤。轻度低氧预适应,对神经系统可能是一种保护机制,使机体对低氧产生适应能力,通过促进神经干细胞分化、神经元迁徙,最终对学习记忆起到促进作用[11-12]。Oryacheva等[13]研究表明,将大鼠置于模拟海拔4 000 m高原的低压氧舱14 d,可对抗氧化应激和凋亡引起的海马神经元损伤导致的认知功能障碍。Wang等[14]发现模拟海拔5 000 m高原,每天6 h的CIHH预处理可改善小鼠缺血后认知功能障碍。本课题组前期研究发现通过模拟海拔5 000 m高原,每天6 h预处理成年雄性大鼠,可对抗放射线所致的心肌纤维化,对心肌起到保护作用[7]。本研究拟通过建立放射性海马损伤模型,观察小鼠记忆认知功能变化和CA1区形态学变化,首次评估CIHH是否对放射性海马损伤存在保护作用。
本研究进行了预实验,发现给予小鼠颅脑单次10 Gy照射可成功建模,保证小鼠存活以进行后续实验。关于射线引起海马损伤动物模型方面已有报道。Son等[15]研究发现,以C57小鼠为实验动物,照射剂量单次10 Gy,等效生物剂量公式相当于临床常规照射剂量(2 Gy×10次),该剂量可引起放射性海马损伤。Liu等[16]研究发现大鼠放射性脑损伤模型中最早、最典型的损伤发生在海马区,当照射剂量超过10 Gy时就可引起海马区组织形态学异常改变,从而引起动物记忆、认知功能的改变。Dong等[17]给予3周龄小鼠全脑单次10 Gy照射,6周后观察到记忆、认知功能障碍。嵇建峰等[18]研究发现给予大鼠单次10 Gy照射可引起大鼠记忆、认知障碍。本研究应用经典水迷宫试验通过记录小鼠全脑照射30 d逃避潜伏期、空间探索能力的变化来评估记忆、认知功能的变化。结果显示,4组小鼠均观察到随着训练时间延长,逃避潜伏期逐渐缩短,说明小鼠在训练过程中均具备了一定的空间记忆能力。IR组与健康对照组相比,全脑照射30 d后小鼠逃避潜伏期逐渐延长,且从第3天开始潜伏期延长差异具有统计学意义。除去平台后,1 min内穿越平台次数、目标象限探索时间均减少,表明全脑照射可造成小鼠记忆力、认知功能减退,且具有一定的时间持续性。本研究结果与Son等[15]研究结果一致,上述研究结果表明本实验小鼠放射性海马损伤动物模型成功建立。
Peissner等[19]和Mizumatsu等[20]对大鼠全脑进行放疗,并对放射性大鼠海马损伤进行了时间和剂量梯度研究,观察组织病理学改变,主要表现为海马CA1区神经元细胞肿胀,胞核偏位、结构不清,甚至出现神经细胞固缩、坏死,进而造成认知、记忆功能减退。本研究通过给予小鼠海马CA1区尼氏染色观察放射性海马损伤组织病理学变化,结果发现照射后海马CA1区神经元细胞肿胀,胞核偏位、结构不清,以及少量神经元细胞坏死,提示全脑放疗后海马区损伤可能主要表现为神经元变性和神经元坏死。与上述研究结果相一致。DCX是一种微管结合蛋白,在中枢神经系统成长过程高度表达,DCX的表达被用于成年神经干细胞发生标志。Son等[21]给予大鼠全脑单次照射10 Gy,照射后2个月测定齿状回中的细胞神经发生(DCX)情况,发现DCX阳性平均细胞密度显著降低。Casciati等[22]研究表明,给予10周龄的小鼠单次全脑照射2 Gy,6个月后通过免疫荧光标记DCX观察到新生神经元明显减少。本研究通过应用免疫荧光方法对成年小鼠CA1区DCX蛋白进行标记,发现小鼠全脑单次照射10 Gy照射后,同样观察到小鼠海马CA1区DCX表达量明显减少。提示神经发生减少可能导致小鼠记忆和认知功能障碍。上述研究均显示放疗可导致新生神经元细胞减少,但并未对剂量梯度和时间梯度进行研究。与Son等[21]研究观察到的放疗后2个月、6个月后新生神经元减少不同,本研究显示,照射后1个月小鼠即发生了明显的新生神经元减少,可能与照射结束早期存在脑水肿、损伤的神经元细胞未及时得到修复、神经发生未全部完成相关。同时提示,放射性脑损伤在放疗早期即可出现,若及时给予干预并逆转,具有一定的临床意义。
Wang等[14]评估CIHH治疗缺血后1个月小鼠的学习和记忆能力,并通过硫堇染色检查CA1区锥体神经元的组织病理学表现,发现CIHH预处理后CA1区神经元密度增加。Goryacheva等[23]模拟高原环境,适应性间歇性低氧预处理阿尔兹海默病大鼠模型,发现间歇性低氧可抑制海马组织中一氧化氮(NO)过度产生和神经变性,预防记忆功能减退。本研究应用CIHH预处理后再行全脑照射发现,CIHH预处理后再照射较IR组比较,小鼠逃避潜伏期缩短。除去平台后,1 min内穿越平台次数、目标象限探索时间均增加。CIHH预处理减轻了海马组织病理学损伤,本研究观察到海马CA1区神经元细胞坏死程度减轻、神经发生增加,说明照射前进行CIHH预处理可增加神经发生、减轻神经元细胞坏死、减轻小鼠记忆、认知功能障碍。
本课题组前期研究发现,IR组与健康对照组大鼠相比,心肌梗死面积增加,心肌纤维化程度明显增加,CIHH预处理后再照射较单纯CIHH组相比,心肌梗死面积减少、心肌纤维化程度减轻[7]。本组研究在病理学和功能学两个不同维度对放射性脑损伤进行观察,结果显示IR组与健康对照组小鼠相比,同样观察到神经元细胞坏死程度增加、新生神经元减少,CIHH预处理后再照射较单纯CIHH组比较,神经元细胞坏死程度减轻、新生神经元增加。
本研究存在不足,目前针对小鼠全脑照射后功能学和病理学方面进行了一些相关研究,并未对其保护机制行进一步的研究。既往研究发现,内质网应激与自噬作用均在神经损伤与保护中起着重要的作用,然而上述两者在放射性海马损伤中扮演者怎样的角色尚未可知。下一步将对放射性海马损伤相关机制进行探索。
综上所述,经X射线单次10 Gy照射后30 d即可引起小鼠记忆、认知功能障碍。在形态学上可表现为增加海马CA1区神经元坏死,提示动物模型的放射性海马损伤可能通过引CA1区神经元坏死增多,进而造成放射性海马损伤。CIHH预处理后再照射,可改善上述损伤,进而从一定程度上改善小鼠的记忆、认知功能。下一步工作将对放射性海马损伤的机制行进一步探索,以寻求更有效的干预措施,从而为临床工作提供参考。
利益冲突 无
作者贡献声明 王媛负责实验和论文撰写; 刘宜先指导论文修改; 王帅、张伟参与实验操作; 王祎、武亚晶参与论文修改; 王升、王军指导论文撰写
| [1] |
Lamba N, Mehanna E, Kearney RB, et al. Prescription of memantine during non-stereotactic, brain-directed radiation among patients with brain metastases: a population-based study[J]. J Neuro-Oncol, 2020, 148: 509-517. DOI:10.1007/s11060-020-03542-4 |
| [2] |
Federica F, Roberta R, Riccardo S. Mechanisms and therapy for cancer metastasis to the brain[J]. Front Oncol, 2018, 8: 161. DOI:10.3389/fonc.2018.00161 |
| [3] |
Shuto T, Akabane A, Yamamoto M, et al. Multiinstitutional prospective observational study of stereotactic radiosurgery for patients with multiple brain metastases from non-small cell lung cancer (JLGK0901 study-NSCLC)[J]. J Neurosurg, 2018, 129(Suppl 1): 86-94. DOI:10.3171/2018.7.GKS181378 |
| [4] |
Ding X, Wu HH, Ji SJ, et al. The p75 neurotrophin receptor regulates cranial irradiation-induced hippocampus-dependent cognitive dysfunction[J]. Oncotarget, 2017, 8(25): 40544-40557. DOI:10.18632/oncotarget.16492 |
| [5] |
Soussain C, Ricard DD, Fike JR, et al. CNS complications of radiotherapy and chemotherapy[J]. Lancet, 2009, 374(9701): 1639-1651. DOI:10.1016/S0140-6736(09)61299-X |
| [6] |
中国放射性脑损伤多学科协作组, 中国医师协会神经内科分会脑与脊髓损害专业委员会. 放射性脑损伤诊治中国专家共识[J]. 中华神经医学杂志, 2019, 18(6): 541-549. China Radiation Brain Injury Multidisciplinary Cooperation Group, Brain and Spinal Cord Injury Professional Committee of Neurology branch of Chinese Medical Association. Consensus of Chinese experts on diagnosis and treatment of radiation-induced brain injury[J]. Chin J Neuromed, 2019, 18(6): 541-549. DOI:10.3760/cma.j.issn.1671-8925.2019.06.001 |
| [7] |
Wang J, Wu Y, Fang Y, et al. Chronic intermittent hypobaric hypoxia attenuates radiation induced heart damage in rats[J]. Life Sci, 2016, 160: 57-63. DOI:10.1016/j.bbrc.2016.06.145 |
| [8] |
Sun C, Fu J, Qu Z, et al. Chronic intermittent hypobaric hypoxia restores hippocampus function and rescues cognitive impairments in chronic epileptic rats via Wnt/β-catenin signaling[J]. Front Mol Neurosci, 2021, 13: 617143. DOI:10.3389/fnmol.2020.617143 |
| [9] |
Gondi V, Pugh SL, Tome WA, et al. Preservation of memory with conformal avoidance of the hippocampal neural stem-cell compartment during whole-brain radiotherapy for brain metastases (RTOG 0933): a phase II multi-institutional trial[J]. J Clin Oncol, 2016, 32(34): 3810-3816. DOI:10.1200/JCO.2014.57.2909 |
| [10] |
许欣, 曾凡星. 间歇性常压低氧训练研究进展[J]. 中国运动医学杂志, 2002, 21(5): 490-494. Xu X, Zeng FX. Research progress of intermittent normobaric hypoxia training[J]. Chin J Sports Med, 2002, 21(5): 490-494. |
| [11] |
杨洁, 邵国. 促红细胞生成素在低氧预适应中的神经保护作用[J]. 生理科学进展, 2015, 46(5): 383-386. Yang J, Shao G. Neuroprotective effect of erythropoietin in hypoxic preconditioning[J]. Prog Physiol Sci, 2015, 46(5): 383-386. |
| [12] |
曹晓宇, 武柯含, 杨海霞, 等. miRNA对低氧/缺血损伤脑神经的保护作用研究进展[J]. 包头医学院学报, 2021, 37(5): 4. Cao XY, Wu HH, Yang HX, et al. Research progress on the protective effect of miRNA on hypoxic / ischemic brain injury[J]. J Baotou Med College, 2021, 37(5): 4. DOI:10.16833/j.cnki.jbmc.2021.05.035.Jbmc2021.05.035 |
| [13] |
Goryacheva AV, Kruglov SV, Pshennikova MG, et al. Adaptation to intermittent hypoxia restricts nitric oxideoverproduction and prevents Beta amyloid toxicity in rat brain[J]. Nitric Oxide, 2010, 23(4): 289-299. DOI:10.1016/j.niox.2010.08.005 |
| [14] |
Wang J, Zhang S, Ma H, et al. Chronic intermittent hypobaric hypoxia pretreatment ameliorates ischemia-induced cognitive dysfunction through activation of ERK1/2-CREB-BDNF pathway in anesthetized mice[J]. Neurochemical Res, 2017, 42(2): 501-512. DOI:10.1007/s11064-016-2097-4 |
| [15] |
Son Y, Yang M, Wang H, et al. Hippocampal dysfunctions caused by cranial irradiation: A review of the experimental evidence[J]. Brain Behavior Immunity, 2015, 45: 287-296. DOI:10.1016/j.bbi.2015.01.007 |
| [16] |
Liu Y, Xiao S, Liu J, et al. An experimental study of acute radiation-induced cognitive dysfunction in a young rat model[J]. AJNR Am J Neuroradiol, 2010, 31(2): 383-387. DOI:10.3174/ajnr.A1801 |
| [17] |
Dong X, Luo M, Huang G, et al. Relationship between irradiation-induced neuro-inflammatory environments and impaired cognitive function in the developing brain of mice[J]. Int J Radiat Biol, 2015, 91(3): 224-239. DOI:10.3109/09553002.2014.988895 |
| [18] |
嵇建峰, 刘蕴莹, 孔月, 等. 18F-FDG micro-PET代谢显像评估大鼠放射性认知功能障碍的实验研究[J]. 中华放射医学与防护杂志, 2020, 40(9): 653-658. Ji JF, Liu YY, Kong Y, et al. Experimental study of 18F-FDG micro PET metabolic imaging in evaluating radiation-induced cognitive impairment in rats[J]. Chin J Radiat Med Prot, 2020, 40(9): 653-658. DOI:10.3760/cma.j.issn.0254-5098.2020.09.001 |
| [19] |
Peissner W, Kocher M, Treuer H, et al. Ionizing radiation-induced apoptosis of proliferating stem cells in the dentate gyrus of the adult rat hippocampus[J]. Mol Brain Res, 1999, 71(1): 61-68. DOI:10.1016/S0169-328X(99)00170-9 |
| [20] |
Mizumatsu S, Monje ML, Morhardt DR, et al. Extreme sensitivity of adult neurogenesis to low doses of X-irradiation[J]. Cancer Res, 2003, 63(14): 4021-4027. DOI:10.1016/S0165-4608(03)00013-X |
| [21] |
Son Y, Kang S, Kim J, et al. Possible involvement of hippocampal immediate-early genes in contextual fear memory deficit induced by cranial irradiation[J]. Neurobiol Learn Mem, 2016, 133: 19-29. DOI:10.1016/j.nlm.2016.05.012 |
| [22] |
Casciati A, Dobos K, Antonelli F, et al. Age-related effects of X-ray irradiation on mouse hippocampus[J]. Oncotarget, 2016, 7(19): 28040-28058. DOI:10.18632/oncotarget.8575 |
| [23] |
Goryacheva AV, Kruglov SV, Pshennikova MG, et al. Adaptation to intermittent hypoxia restricts nitric oxide overproduction and prevents beta-amyloid toxicity in rat brain[J]. Nitric Oxide, 2010, 23(4): 289-299. DOI:10.1016/j.niox.2010.08.005 |
 2022, Vol. 42
2022, Vol. 42


