磁共振加速器系统(MR-Linac,Unity)是由1.5 T磁共振扫描系统(荷兰Philips公司)和7 MV环形直线加速器(瑞典Elekta公司)组成[1]。该治疗系统可通过每次治疗前的磁共振影像产生在线治疗计划,以修正在治疗过程中由于器官运动或形变造成的误差。并且可以在治疗过程中和治疗完成后采集磁共振图像,评估患者位置变化和治疗效果。此外,该系统还支持在照射过程中实时扫描动态磁共振影像,监控肿瘤靶区或危及器官的运动情况[2]。目前,国内外已有多篇文献报道Unity磁共振加速器系统和常规加速器系统计划质量相比较的相关文章,证明磁共振加速器系统可实现临床可接受的放疗计划[3-6]。常规的调强放射治疗计划均采用等中心照射技术,通常会将计划中心点放置于靶区中心位置,在常规加速器上开展治疗时通过移动调整治疗床,将患者靶区中心置于加速器等中心处。但是,磁共振加速器的治疗床只能在头脚方向移动,无法左右方向移动,在进行计划设计时计划中心点位置须在治疗床中间位置,这将导致在治疗偏中心位置肿瘤时将无法像常规加速器一样将计划中心点置于靶区中心位置。已有多篇文献讨论放疗计划中心点位置对剂量的影响,证明一个合适的计划中心点选择,可以缩短计划设计时间,提高治疗效率,并降低正常组织的放疗并发症概率(normal tissue complication probability, NTCP)[7-10]。目前国内外讨论磁共振加速器系统计划质量的文献,鲜见涉及偏中心位置肿瘤部位[11]。针对在磁共振加速器上开展偏中心肿瘤照射过程中,关于计划中心点无法放置于靶区中心而带来的剂量学影响,国内外文献少有报道。本研究通过对比分析偏中心肿瘤两种放疗计划剂量学差异,探究磁共振加速器放疗计划等中心点位置对剂量的影响,为临床提供参考。
资料与方法1. 临床资料:回顾性选取2020年3月—12月在中山大学肿瘤防治中心接受放射治疗的19例患者病例资料,其中男性15例,女性4例;年龄15~88岁,中位年龄50岁;其中10例骨转移,6例肺癌,3例肝癌,所有患者肿瘤靶区几何中心点均在患者身体一侧偏离中心轴位置。患者均使用真空袋固定,采用荷兰Philips大孔径CT获得定位CT影像,扫描层厚均为3 mm。由一位放疗科主任医师勾画靶区和危及器官。
2. 放疗计划设计:运用Elekta Unity磁共振加速器(瑞典Elekta公司)专用的放疗计划系统Monaco(v5.40.02)进行计划设计。该计划系统采用GPUMCD(graphicprocessingunit(GPU)-based Monte Carlo dose calculation platform)剂量计算算法,且考虑了1.5 T磁场对剂量的影响[12]。磁共振加速器系统计划设计流程中,计划中心点固定在机架等中心位置,x方向固定在治疗床中间,z方向固定在治疗床上方13 cm,y方向可根据靶区位置调整(图 1)。本研究中根据计划等中心点位置设置不同,产生两组放疗计划:①按照磁共振加速器常规计划设计流程,计划等中心点固定(A组)。②模拟将计划等中心位置设为靶区的几何中心点(B组)。放疗计划采用5~9个射野,射野方向均设置于肿瘤所在患侧位置,相邻射野间隔20°~30°,以最大程度减少健侧正常组织受照剂量。因磁共振加速器13°方向设置有低温恒温管,所以在10°~20°方向尽量避免布置射野。治疗计划参数设置:计算网格为0.2 cm,每控制点统计不确定度为2%,最小子野面积为4 cm2,最小子野宽度为0.5 cm,每个子野最小5 MU,每个计划最多设置150个子野。所有计划均同时满足处方剂量覆盖靶区体积95%以上,最大剂量<110%处方剂量。危及器官和正常组织剂量限值基于国际辐射单位与测量委员会(ICRU)83号报告[13]和本中心临床要求进行设置,根据处方剂量要求产生step-and-shoot调强放射治疗计划。两组计划采用相同的优化目标函数和计划参数进行设计。
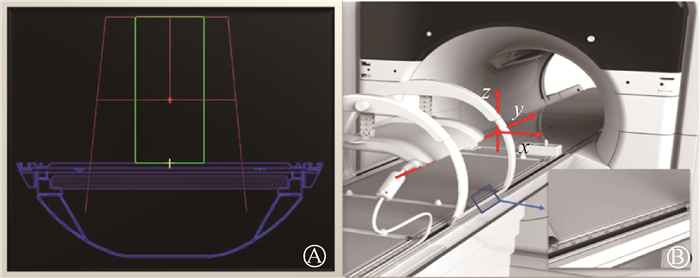
|
A.磁共振加速器计划系统中计划中心点位置示意图;B.磁共振加速器治疗床坐标示意图 图 1 磁共振加速器中计划中心点和治疗床坐标示意图 Figure 1 MR-Linac-based planned isocenter and couch coordinate system A. Planned isocenter position in MR-Linac planning system; B. MR-Linac-based couch coordinate system |
3. 计划评估: 比较两组计划的剂量-体积直方图(DVH)剂量学参数和MU数。①DVH剂量学参数:采用适形指数(conformityIndex,CI)和均匀性指数(homogeneityIndex,HI)评估靶区剂量分布,CI和HI定义公式如下:
| $ \begin{aligned} \mathrm{CI} &=\frac{\left(T V_{\mathrm{PV}} \times T V_{\mathrm{PV}}\right)}{\left(V_{\mathrm{PTV}} \times V_{\mathrm{TV}}\right)} \end{aligned} $ | (1) |
| $ \begin{aligned} \mathrm{HI} &=\frac{\left(D_{2 \%}-D_{98 \%}\right)}{D_{50 \%}} \end{aligned} $ | (2) |
式中,VPTV为对应的治疗靶区体积VTV为处方剂量覆盖的体积;TVPV为靶区内处方剂量覆盖体积[14];D2%、D98%、D50%分别为剂量覆盖达到靶区体积的2%、98%、50%所接受到的最小剂量[15]。其中,CI值越大,表示靶区剂量适形性越好;HI越小,表示靶区剂量均匀性越好。在放射治疗中,正常组织定义为外轮廓减去靶区得到的体积(Body-PTV),采用V80%、V50%、V30%和V10%评价正常组织受照剂量。②MU数:评价整个计划总的MU数目。
4. 统计学处理:采用SPSS v25.0统计软件对每个评估指标进行配对t检验分析,数据采用x ±s表示。P<0.05为差异有统计学意义。
结果1.靶区和正常组织剂量比较: A组计划中靶区几何中心与计划等中心点坐标距离为x方向-19.56~17.66 cm,z方向为-5.11~5.04 cm, y方向与靶区中心坐标一致;B组计划中靶区几何中心与计划等中心点重合。两组计划的靶区和正常组织剂量分布均能满足临床要求。A和B两组计划中,靶区适形指数CI和均匀性指数HI比较结果显示,差异均无统计学意义(P>0.05),见表 1。同时,两组计划正常组织剂量V80%、V50%、V30%和V10%比较显示,差异也无统计学意义(P>0.05)。1例骨转移病例的两组放疗计划剂量分布和DVH结果如图 2所示,可直观显示两组计划剂量差异。
|
|
表 1 两组放疗计划靶区和正常组织的剂量比较(x ±s) Table 1 Comparison of planned target volumes and doses to normal tissues between two groups (x ±s) |
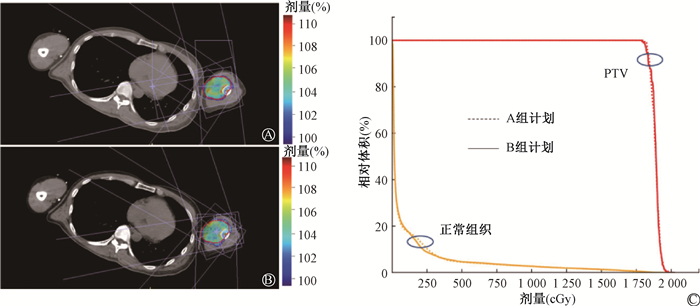
|
A. A组计划剂量分布;B. B组计划剂量分布;C. 两组计划DVH比较 图 2 骨转移患者的两组放疗计划的剂量分布和DVH Figure 2 Dose distribution and dose-volume histogram foratypical case A. Dose distribution for Plan A; B. Dose distribution for Plan B; C. DVH differences between two plans |
2.MU数比较: 两组计划总MU数比较结果显示,A组计划MU数为1 149±903,B组计划MU数为970±652,A组明显多于B组,差异有统计学意义(t=2.804,P=0.012)。
讨论磁共振加速器和传统加速器在机器结构设计和治疗流程都有很大差异。磁共振加速器治疗床两边有床值刻度为0~51.5,每两个刻度值间距离是2 cm。磁共振加速器机房未安装激光灯辅助摆位,患者治疗位置以治疗床值记录以辅助摆位。在定位CT扫描时,将磁共振加速器治疗床板放置在CT扫描床上,治疗床中轴与矢状面激光灯重合,需记录两侧CTMarker点对应的治疗床值,在实际治疗时按照记录的床值进行摆位。此外,传统加速器治疗床是由特殊合成材料组成,对剂量衰减较小。而磁共振加速器治疗床由10种不同材料的部件组装而成,剂量计算时需要考虑其对剂量的影响。计划设计流程中,在计划系统中添加治疗床,并参照定位CT扫描时实际治疗床位置调整治疗床到合适位置。同时按照CT定位时记录的CTMarker点对应床值,在计划系统中设置治疗床值,其目的是在治疗时计算得出到等中心位置的进床距离。
磁共振加速器治疗过程中,治疗床x方向(左右)和z方向(上下)不可移动,使得计划等中心点位置固定,x方向在治疗床中间位置,z方向在治疗床上方13 cm处。在偏侧肿瘤部位照射时,无法像传统加速器治疗时调整治疗床位置将靶区中心移动至等中心位置照射。已有多篇文献讨论放疗计划中心点位置对剂量的影响,证明了一个合适的计划中心点选择,可以缩短计划设计时间,提高治疗效率,并降低正常组织的放疗并发症概率(NTCP)[7]。在针对偏中心肿瘤部位计划设计中,若未将靶区置于射野中心轴处时,靶区在射野边缘,则导致剂量计算均是采用剂量剖面曲线的肩部或半影区照射,未满足射线利用最优原则;对于射野边缘处的靶区,也可能会存在治疗中由于摆位误差导致靶区移出射野的风险;而且射野边缘处多叶光栅(multi-leaf collimator, MLC)的精度和效率也有可能不及中心位置处。目前国内外讨论磁共振加速器系统计划质量的文献,均未涉及偏中心位置肿瘤部位[4, 11]。另外,磁共振加速器由于存在磁场的影响,使得百分深度剂量曲线前移,建成区减小;同时剖面剂量曲线呈现不对称,偏向右侧[16]; 以及源轴距(source to axial distance, SAD)增加为143.5 cm,导致半影区增加。这些特殊的设计,有可能会更加增大偏中心照射时中心点位置选择对剂量的影响,对于在磁共振加速器上开展偏中心肿瘤照射过程中,关于计划中心点无法放置于靶区中心而带来的剂量学影响,目前尚不明确。本研究目的就是探究磁共振加速器计划等中心点位置对放疗剂量的影响,为临床提供参考。
磁共振加速器照射野大小为x方向57.4 cm,y方向22 cm,准直器角度固定,MLC宽度为7.1 mm。在本研究中,选取偏侧位置的肿瘤靶区的计划剂量比较,A组计划为按照磁共振加速器设计流程,将计划等中心点固定;B组计划通过移动治疗床位置,模拟将计划的等中心点放置在靶区几何中心位置,但该计划不符合磁共振加速器临床应用流程,只作为对照组进行剂量比较。虽然磁共振加速器计划中心点无法设置在靶区中心,但因x方向57.4 cm,在体内照射时几乎不存在靶区在射野外的情况,根据本研究结果中DVH剂量统计,两组计划差异无统计学意义,左上肢照射计划的剂量分布和DVH结果也没有差异,均满足临床要求。另外,从比较两组计划MU数目的结果可知,A组计划相较B组计划MU数明显增多,且差异有统计学意义。这可能是由于磁共振加速器射线采用7 MV非均整模式(FFF),同时受磁场的影响,剖面曲线不对称,半影区增加,在计划中心点固定后,偏中心靶区照射利用的是剖面曲线的肩部区或者是半影区,射线利用率低,需要更多MU进行剂量补偿。
此外,尽管磁共振加速器照射偏侧肿瘤剂量分布可以接受,但是在治疗过程中,采集在线MRI图像,扫描范围边缘图像几何形变等问题会影响治疗决策,临床应用过程中也需要加以考虑[17]。本组骨转移患者采用侧身摆位治疗,其主要原因就是在磁共振加速器上治疗床无法左右移动,患者平躺时靶区会处于磁共振扫描范围边缘,将会导致图像几何形变较大、图像质量较差从而影响治疗决策,所以采用侧身摆位尽量将靶区置于磁共振扫描范围中心位置。本研究只讨论了偏中心照射部位计划剂量分布,目前在磁共振加速器上使用磁共振兼容的ArcCheck模体进行治疗计划验证,且只能摆放在治疗床中心位置,由于其探测器半径有限,对于偏中心位置计划验证时,无法验证靶区的高剂量区域差异,只是比较低剂量区域差别,后续研究将讨论计划验证的解决方案。
综上,本研究结果显示,由于磁共振加速器放疗计划中心点位置固定,计划MU数较多,照射效率较低,但是计划剂量分布均能满足临床要求。研究可证明磁共振加速器计划中心点位置对剂量分布影响较小,可满足临床应用要求。
利益冲突 所有作者没有任何利益冲突,未接受任何不当的职务或财务利益
作者贡献声明 丁寿亮负责研究设计和撰写论文;刘红冬参与研究设计和论文修改;李永宝和王彬参与研究设计;黄晓延负责研究设计
| [1] |
Raaymakers BW, Lagendijk JJ, Overweg J, et al. Integrating a 1.5 T MRI scanner with a 6 MV accelerator: proof of concept[J]. Phys Med Biol, 2009, 54(12): N229-237. DOI:10.1088/0031-9155/54/12/N01 |
| [2] |
丁寿亮, 刘红冬, 王彬, 等. 基于磁共振加速器系统头颈部肿瘤自适应放射治疗的剂量学评估[J]. 中华放射医学与防护杂志, 2021, 41(7): 499-503. Ding SL, Liu HD, Wang B, et al. Dose evaluation of adaptive radiotherapy using high-field MR-Linac systems for head and neck cancers[J]. Chin J Radiol Med Prot, 2021, 41(7): 499-503. DOI:10.3760/cma.j.issn.0254-5098.2021.07.004 |
| [3] |
Ding S, Li Y, Liu H, et al. Comparison of intensity modulated radiotherapy treatment plans between 1.5T MR-Linac and conventional linac[J]. Technol Cancer Res Treat, 2021, 20: 1533033820985871. DOI:10.1177/1533033820985871 |
| [4] |
Nachbar M, Mönnich D, Kalwa P, et al. Comparison of treatment plans for a high-field MRI-Linac and a conventional linac for esophageal cancer[J]. Strahlenther Onkol, 2019, 195(4): 327-334. DOI:10.1007/s00066-018-1386-z |
| [5] |
Raaijmakers AJ, Raaymakers BW, Lagendijk JJ. Integrating a MRI scanner with a 6 MV radiotherapy accelerator: dose increase at tissue-air interfaces in a lateral magnetic field due to returning electrons[J]. Phys Med Biol, 2005, 50(7): 1363-1376. DOI:10.1088/0031-9155/50/7/002 |
| [6] |
Ding S, Liu H, Wang B, et al. Impact of field number and beam angle on ERE for lung stereotactic body radiotherapy with 1.5T MR-Linac[J]. Cancer Radiother, 2021, 25(4): 366-372. DOI:10.1016/j.canrad.2021.01.006 |
| [7] |
桑勇, 单国平, 祝成龙, 等. 静态调强放疗等中心点对鼻咽癌剂量学的影响[J]. 中国医学物理学杂志, 2019, 36(4): 394-397. Sang Y, Shan GP, Zhu CL, et al. Dosimetric effects of isocenter on static intensity-modulated radiotherapy for nasopharyngeal carcinoma[J]. Chin J Med Phys, 2019, 36(4): 394-397. DOI:10.3969/j.issn.1005-202X.2019.04.005 |
| [8] |
吴伟, 黄庆荣, 周巧敏, 等. 偏中心调强布野对中枢神经系统儿童放射治疗首次摆位的影响[J]. 中国医学装备, 2020, 17(12): 56-59. Wu W, Huang QR, Zhou QM, et al. Effect of distribution field of off-center IMRT on initial positioning of radiotherapy on central nervous system of children[J]. China Med Equip, 2020, 17(12): 56-59. DOI:10.3969/J.ISSN.1672-8270.2020.12.014 |
| [9] |
柏晗, 夏耀雄, 刘旭红, 等. 胸部肿瘤放疗中呼吸运动对偏中心处点剂量和面剂量的影响[J]. 肿瘤预防与治疗, 2020, 33(9): 753-759. Bai H, Xia YX, Liu XH, et al. Impact of respiratory motion on point and planar radiation dose for thoracic tumor at off-center location[J]. J Cancer Control Treat, 2020, 33(9): 753-759. DOI:10.3969/j.issn.1674-0904.2020.09.005 |
| [10] |
Mandal A, Asthana AK, Pradhan S, et al. Search of an ideal location of isocenter in intensity-modulated radiotherapy treatment plans: A dosimetrical approach[J]. J Cancer Res Ther, 2019, 15(1): 211-215. DOI:10.4103/jcrt.JCRT_985_16 |
| [11] |
Christiansen RL, Hansen CR, Dahlrot RH, et al. Plan quality for high-risk prostate cancer treated with high field magnetic resonance imaging guided radiotherapy[J]. Phys Imaging Radiat Oncol, 2018, 7: 1-8. DOI:10.1016/j.phro.2018.06.006 |
| [12] |
Hissoiny S, Raaijmakers AJ, Ozell B, et al. Fast dose calculation in magnetic fields with GPUMCD[J]. Phys Med Biol, 2011, 56(16): 5119-5129. DOI:10.1088/0031-9155/56/16/003 |
| [13] |
International Committee for Radiological Units. ICRU Report 83. Prescribing recording and reporting intensity-modulated photon-beam therapy(IMRT)[R]. Stockholm: ICRU, 2010.
|
| [14] |
Feuvret L, Noël G, Mazeron JJ, et al. Conformity index: a review[J]. Int J Radiat Oncol Biol Phys, 2006, 64(2): 333-342. DOI:10.1016/j.ijrobp.2005.09.028 |
| [15] |
Ning ZH, Mu JM, Jin JX, et al. Single arc volumetric-modulated arc therapy is sufficient for nasopharyngeal carcinoma: a dosimetric comparison with dual arc VMAT and dynamic MLC and step-and-shoot intensity-modulated radiotherapy[J]. Radiat Oncol, 2013, 8: 237. DOI:10.1186/1748-717X-8-237 |
| [16] |
Raaijmakers AJ, Raaymakers BW, Lagendijk JJ. Magnetic-field-induced dose effects in MR-guided radiotherapy systems: dependence on the magnetic field strength[J]. Phys Med Biol, 2008, 53(4): 909-923. DOI:10.1088/0031-9155/53/4/006 |
| [17] |
Wang J, Yung J, Kadbi M, et al. Assessment of image quality and scatter and leakage radiation of an integrated MR-Linac system[J]. Med Phys, 2018, 45(3): 1204-1209. DOI:10.1002/mp.12767 |
 2022, Vol. 42
2022, Vol. 42


