2. 连云港市卫生监督所,连云港 222002;
3. 苏州大学放射医学与辐射防护国家重点实验室,苏州 215123
2. The Health Supervision Institute of Lianyungang, Lianyungang 222002, China;
3. State Key Laboratory of Radiation Medicine and Protection, Soochou University, Suzhou 215123, China
氚的排放是核电站影响环境的主要因素之一。随着核能事业的不断发展, 核反应堆的建立日益增多,氚向环境中排放量将不断增加[1-2],对人类健康的影响将变得越来越重要。在氚引起的生物效应中,前期研究关注的是急性毒性效应及长期低水平暴露诱发的遗传毒性[3-4]。近年来,电离辐射的非癌症效应等其他健康效应成为关注的焦点,尤其是对心血管系统的影响。国际放射防护委员会(International Commission on Radiological Protection,ICRP)118号报告指出,当累计受到0.5 Sv电离辐射照射10年后,大约有1%的受照个体会发生循环系统疾病(circulatory system diseases,CSD)。已有临床研究表明,接受放射治疗的肿瘤患者由射线引起的心血管疾病的概率大大增加,包括心肌纤维化、心室壁运动功能减退、冠心病和心肌梗死等[5]。近10年来的日本原爆幸存者心血管疾病队列研究也发现,中风及缺血性心脏病(ischemic heart disease,IHD) 的患病风险显著增加[6]。可见,电离辐射引起的心血管疾病发病率升高已成为共识。但氚暴露与循环系统疾病之间的因果关系报道很少。为探讨氚对循环系统的初步影响,本课题组前期的研究发现,氚暴露可以改变血管内皮细胞的粘附性和血管生成能力等[7]。因此,本研究利用前期建立的人脐静脉血管内皮细胞氚水染毒模型,采用高通量芯片技术筛选差异表达lncRNAs和mRNAs,从lncRNAs角度探讨氚水对血管内皮细胞的毒性机制,以期对氚与循环系统疾病的关系提供初步的理论依据。
材料与方法1.主要实验材料和试剂:氚水(美国PerkinElmer公司)、胎牛血清(美国BI公司)、人脐静脉内皮细胞HUVEC[美国模式培养物集存库(ATCC)]、DMEM高糖培养基和磷酸缓冲盐溶液(PBS)[中国维森特生物技术(南京)有限公司]。常用化学试剂购于国药集团化学试剂有限公司。
2.HUVEC细胞培养和染毒:HUVEC细胞于含有10%胎牛血清的DMEM高糖培养基37℃、5%CO2培养箱中培养。细胞生长汇合度达到约90%时,进行传代。吸去培养皿内原培养基,加入适量无菌PBS润洗两次,均匀加入适量0.25%胰蛋白酶,孵育1 min,收集细胞,按照1 ∶3的比例接种至3个含有新鲜培养基的培养皿中,继续培养。将HUVEUC细胞分为对照组和氚水组。对照组细胞用DMEM培养;氚水组细胞染毒时,用DMEM高糖培养基预先与经过稀释的氚水原液按照一定比例混合,终浓度为3.7×103 Bq/ml,持续暴露48 h后收集细胞。
3.芯片检测和数据分析:本部分实验由上海康成生物协助完成。细胞样本经过细胞匀浆、分离后,进行RNA沉淀、清洗和干燥,最后溶解RNA沉淀,RNA溶液保存于-80℃的低温冰箱备用。接着总RNA纯化,cDNA样品标记。标记/扩增的RNA的纯化。芯片杂交、洗涤、扫描。使用Aglient Feature Extraction Software软件提取数据,导出数据到文本。使用GeneSpring GX v12.1软件(Agilent Technologies)对原始数据进行Quantile标准化和随后的数据处理。原始数据标准化后经过筛选高质量探针进行进一步分析。两组样品间具有统计学意义的差异表达lncRNA或差异表达mRNA通过P-value/FDR筛选。差异表达mRNA进行Pathway和GO的富集分析,使用编写脚本进行层次聚类和关联分析。
4.统计学处理:数据录入SPSS 17.0进行统计学分析,经正态性检验后,组间比较采用Student-t检验。P < 0.05为差异有统计学意义。
结果1. HUVEC细胞染毒后差异表达lncRNA和mRNA的筛选:氚水染毒组与对照组间差异表达的lncRNAs分析结果表明,染毒组与对照组相比,有1 717个基因显著上调,3 994个基因显著下调(差异倍数> 2,P < 0.05)。LncRNA芯片上除了提供lncRNAs探针外,还提供了mRNA探针,以辅助lncRNA功能研究。因此,还筛选了差异mRNAs,mRNAs分析结果显示,染毒组与对照组相比,有4 562个基因显著上调,1 433个基因显著下调(差异倍数> 2,P < 0.05)。
2.差异表达基因GO分析:利用数据库,进一步分析了氚水染毒组与对照组间差异表达基因参与的各个生物学功能,集中在生物学过程、细胞组件和分子功能3个方面。按生物学过程分类,这些差异基因主要与DNA双链断裂修复的正调控、外源肽抗原的抗原加工和呈递、参与心脏发育的BMP信号通路、泛素非依赖的蛋白分解代谢、晚期内体向溶酶体的转运、足体组装的正调控和G蛋白腺苷酸环化酶活性的正调控等有关。按细胞组件分类,这些差异基因产物主要参与MHCⅠ类蛋白复合物、细胞尖端、细胞质、核、线粒体、着丝粒、细胞外外泌体等功能中。按分子功能分类,这些差异基因主要涉及磷酸甘露糖蛋白甘露糖基转移酶活性、tau蛋白结合和RNA聚合酶= 2 〔ROMANII转录因子活性、RNA结合、DNA结合、钙粘蛋白结合、GTP结合、半胱氨酸肽酶活性等作用过程。
3.差异表达基因KEGG分析:差异表达基因KEGG分析结果见图 1的富集气泡图所示。气泡图中X轴Enrichment Score为富集分值,用气泡的颜色表示P值,由紫-蓝-绿-红变化,其富集Pvalue值越小,显著程度越大;气泡的大小表示基因个数(就是提交的基因与某通路/GO条目中基因的重叠个数),气泡越大表示包含的差异蛋白编码基因数目越多。由图可见,差异表达基因具体富集的信号通路主要包括肿瘤中的miRNA、病毒致癌、细胞凋亡、细胞衰老、吞噬体、泛素介导的蛋白质水解等。
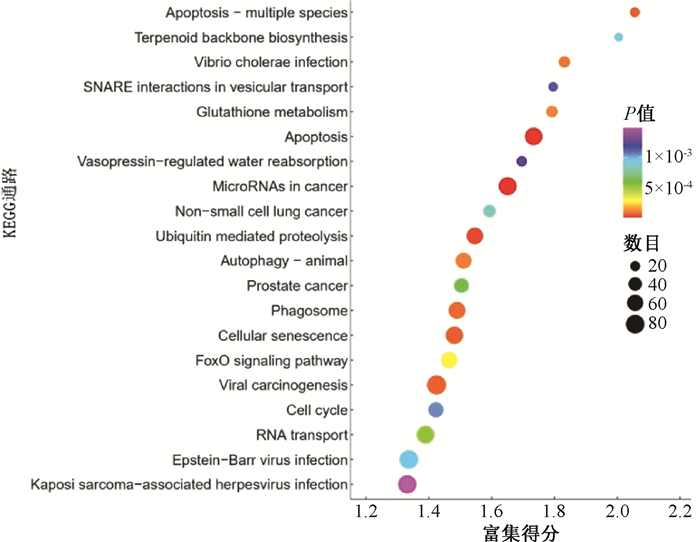
|
图 1 差异表达基因KEGG富集Top20气泡图 Figure 1 Bubble chart of KEGG enriched Top20 differentially expressed genes |
4.差异mRNAs与差异lncRNAs共表达分析:差异mRNA与差异lncRNA,通过Pearson相关性分析,筛选共表达值相关系数Cor≥0.8,且P < 0.05则具有相关性,然后获取top100关系对绘制共表达网络图,见图 2,图中绿色圆圈代表基因,橙色箭头代表LncRNA。结果可见,这些共表达的关系对中,lncRNA可能参与调控这些关键基因,包括SQSTM1、CXCL8、ITPR1、GADD45A、NF-kB1和VDAC1等差异表达基因,每个基因可以分别和20~30个lncRNA关联。
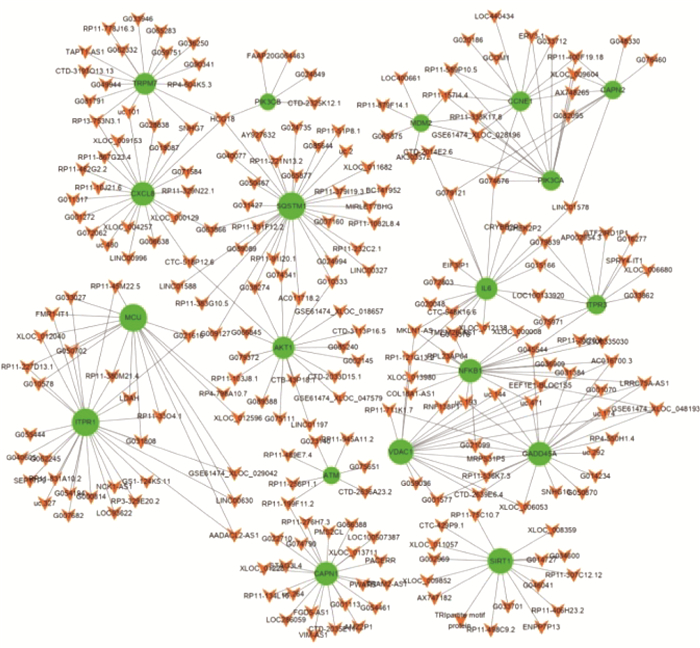
|
图 2 差异mRNAs与差异lncRNAs共表达网络图 Figure 2 Co-expression network diagram of differentially expressed mRNAs and lncRNAs |
讨论
电离辐射防护与辐射源安全基本标准(GB18871-2002)规定[8],氚水、有机结合氚、甲烷氚均属于低毒组核素。氚β射线在水中的平均射程为0.56 μm,最大射程6 μm,因此不会对人体构成外照射损伤,但可通过食入、吸入和皮肤渗透吸收等途径引起内照射损伤。氚进入体内后,可以迅速与生物大分子中的氢原子发生置换反应,或者与细胞组分结合形成有机结合氚(OBT)。职业照射情况时,同等浓度氚水的照射危害约为氚气的25 000倍,引起诸如DNA链断裂、微核形成、细胞坏死或凋亡和染色体畸变等现象,从而对人体健康产生损害。
尽管前期很多实验明确了氚的毒性和相对生物学效应,但关于其毒性机制的研究相对欠缺。近年来,有多个实验室以斑马鱼为模式动物,探讨了氚水对斑马鱼的毒性机制。Arcanjo等[9-11]研究结果表明氚水暴露后斑马鱼骨骼肌、心肌收缩、眼睛浑浊相关基因表达紊乱,透射电镜发现肌节组织紊乱。Gagnaire等[12]观察到氚水暴露可诱导斑马鱼DNA损伤、活性氧产生和肌肉组织的损坏。本组前期实验发现,氚水染毒后斑马鱼幼鱼心率异常,与心肌纤维、心肌收缩和心脏发育等心血管相关的GO term和KEGG pathway都明显富集,表明氚水可能通过这些信号通路影响了斑马鱼的心脏发育及功能[13]。
本研究中筛选出氚水染毒诱发的差异lncRNAs和mRNAs。众所周知,lncRNAs是以RNA的形式在多种层面上(表观遗传调控、转录调控以及转录后调控等)参与蛋白编码基因调控。因此,本研究对差异mRNAs与差异lncRNAs进行共表达分析,聚焦了一些关键基因,如SQSTM1、CXCL8、ITPR1、GADD45A、NF-kB1和VDAC1等基因。Sequestosome 1 (p62/SQSTM1)是一种与细胞信号转导、氧化应激和自噬有关的泛素结合蛋白[14]。p62/SQSTM1是多个关键信号通路的调控枢纽,在动脉粥样硬化、肿瘤及其微环境、骨质疏松等过程中发挥着重要作用。p62作为血管研究通路的重要调控因子,在氚水染毒后异常表达,并且与30多个具有差异表达的lncRNAs有联系,说明其在氚水诱发的血管内皮细胞毒性中发挥重要作用,为下一步基因和lncRNAs的功能研究明确了方向。白细胞介素-8 (Interleukin-8, IL-8),又称为趋化因子CXCL8,是巨噬细胞和上皮细胞等分泌的细胞因子,参与感染反应、炎症反应和癌症等多个生物学反应的过程[15]。本实验室前期已经证实,长期氚水暴露可通过IL-8介导,诱发血管内皮细胞出现衰老、通透性下降和粘附性改变等,从而失去维持血管稳态的功能[10]。三磷酸肌醇受体1型(inositol 1,4,5-triphosphate receptor type 1,ITPR1)是一种配体门控离子通道蛋白,介导钙从内质网中释放,参与控制细胞内的钙信号和调节自噬[16]。研究还发现,HIF-2α通过调节ITPR1表达,增强肿瘤细胞逃避NK细胞监视[17]。ITPR1如何参与氚水对血管内皮细胞的毒性作用值得继续深入研究。
综上所述,氚水暴露可诱发血管内皮细胞发生多个mRNAs与lncRNAs的表达改变,聚焦在SQSTM1、CXCL8、ITPR1、GADD45A、NF-kB1和VDAC1等关键基因,并且可能通过这些基因与有关lncRNA的信号通路从而导致毒性效应,因此,下一步的工作重点将研究这几个关键基因的信号通路在毒性效应中的作用及详细分子机制。
利益冲突 无
志谢 感谢江苏省高校协同创新中心对本研究的支持
作者贡献声明 陈忠民负责组学数据整理和撰写论文,并参与细胞染毒和剂量讨论;张蒙负责细胞培养、样本收集;李峰生参与项目指导和染毒剂量确定;徐龙江参与组学数据分析与整理;孙亮参与剂量确定和数据分析。陈秋和涂彧参与论文指导及修改;崔凤梅负责项目整体设计、论文撰写和修改
| [1] |
Dutton LMC, Gerchikov MY, Nielsen S, et al. MARINA Ⅱ. Update of the MARINA Project on the radiological exposure of the European Community from radioactivity in North European marine waters[R]. Executive summary. AGRIS, 2002. http://www.ecolo.org/documents/documents_in_english/North-Sea-radioact-study.pdf.
|
| [2] |
Thompson PA, Kwamena NO, Ilin M, et al. Levels of tritium in soils and vegetation near Canadian nuclear facilities releasing tritium to the atmosphere: implications for environmental models[J]. J Environ Radioact, 2015, 140: 105-113. DOI:10.1016/j.jenvrad.2014.11.009 |
| [3] |
Little MP, Lambert BE. Systematic review of experimental studies on the relative biological effectiveness of tritium[J]. Radiat Environ Biophys, 2008, 47(1): 71-93. DOI:10.1007/s00411-007-0143-y |
| [4] |
Melintescu A, Galeriu D. Dynamic model for tritium transfer in an aquatic food chain[J]. Radiat Environ Biophys, 2011, 50(3): 459. DOI:10.1007/s00411-011-0362-0 |
| [5] |
Wang K, Eblan MJ, Deal AM, et al. Cardiac toxicity after radiotherapy for stage Ⅲ non-small-cell lung cancer: pooled analysis of dose-escalation trials delivering 70 to 90 Gy[J]. J Clin Oncol, 2017, 35(13): 1387-1394. DOI:10.1200/JCO.2016.70.0229 |
| [6] |
Menezes K M, Wang H, Hada M, et al. Radiation matters of the heart: a mini review[J]. Front Cardiovasc Med, 2018, 5: 83. DOI:10.3389/fcvm.2018.00083 |
| [7] |
Yan HB, Liu YT, Li ZY, et al. Tritiated water induces toxicity in human umbilical vein vascular endothelial cells via IL8[J]. Dose Response, 2020, 18(3): 1559325820938541. DOI:10.1177/1559325820938541 |
| [8] |
国家质量监督检验检疫总局. GB18871-2002电离辐射防护与辐射源安全基本标准[S]. 北京: 中国标准出版社, 2003. General Aolministration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB18871-2002 Basic standards for protection against ionizing radiation and for the safety of radiation sources[S]. Beijing: Standards Press of China, 2003. |
| [9] |
Arcanjo C, Adam-Guillermin C, El Houdigui SM, et al. Effects of tritiated water on locomotion of zebrafish larvae: a new insight in tritium toxic effects on a vertebrate model species[J]. Aquat Toxicol, 2020, 219: 105384. DOI:10.1016/j.aquatox.2019.105384 |
| [10] |
Arcanjo C, Armant O, Floriani M, et al. Tritiated water exposure disrupts myofibril structure and induces mis-regulation of eye opacity and DNA repair genes in zebrafish early life stages[J]. Aquat Toxicol, 2018, 200: 114-26. DOI:10.1016/j.aquatox.2018.04.012 |
| [11] |
Arcanjo C, Maro D, Camilleri V, et al. Assessing tritium internal is ation in zebra fish early life stages: importance of rapid isotopic exchange[J]. J Environ Radioact, 2019, 203: 30-38. DOI:10.1016/j.jenvrad.2019.02.009 |
| [12] |
Gagnaire B, Arcanjo C, Cavalié I, et al. Tritiated water exposure in zebrafish (Daniorerio): effects on the early-life stages[J]. Environ Toxicol Chem, 2020, 39(3): 648-658. DOI:10.1002/etc.4650 |
| [13] |
Li S, Zhang Y, Xue H, et al. Integrative effects based on behavior, physiology and gene expression of tritiated water on zebrafish[J]. Ecotoxicol Environ Saf, 2021, 225: 112770. DOI:10.1016/j.ecoenv.2021.112770 |
| [14] |
Sánchez-Martín P, Saito T, Komatsu M. p62/SQSTM1: 'Jack of all trades' in health and cancer[J]. FEBS J, 2019, 286(1): 8-23. DOI:10.1111/febs.14712 |
| [15] |
David JM, Dominguez C, Hamilton DH, et al. The IL-8/IL-8R axis: a double agent in tumor immune resistance[J]. Vaccines (Basel), 2016, 4(3): 22. DOI:10.3390/vaccines4030022 |
| [16] |
Messai Y, Noman MZ, Hasmim M, et al. HIF-2α/ITPR1 axis: a new saboteur of NK-mediated lysis[J]. Oncoimmunology, 2015, 4(2): e985951. DOI:10.4161/2162402X.2014.985951 |
| [17] |
Xu S, Wang P, Zhang J, et al. Ai-lncRNA EGOT enhancing autophagy sensitizes paclitaxel cytotoxicity via upregulation of ITPR1 expression by RNA-RNA and RNA-protein interactions in human cancer[J]. Mol Cancer, 2019, 18(1): 89. DOI:10.1186/s12943-019-1017-z |
 2022, Vol. 42
2022, Vol. 42


