2. 郑州大学人民医院河南省人民医院肿瘤内科,郑州 450000
2. Department of Oncology, Henan Provincial People′s Hospital, People′s Hospital of Zhengzhou University, School of Clinical Medicine, Zhengzhou 450000, China
放射性肺损伤在早期表现为急性放射性肺部炎症,而后迁延为放射性肺纤维化,而这其中的发生发展机制尚未完全阐明[1]。目前的研究表明,作为肺泡内局部干细胞,肺Ⅱ型上皮细胞(type Ⅱ alveolar epithelial cells, AECⅡ)对维持正常肺生理功能至关重要,并在各种肺损伤发生时通过增殖分化来发挥修复作用,但异常修复最终也会导致肺纤维化的形成[2-3]。上皮间质转化(epithelial-mesenchymal transition, EMT)被认为是放射性肺纤维化发生过程中的关键[4]。而本研究建立放射性肺损伤小鼠模型,通过分离放射性肺损伤不同阶段的原代AEC Ⅱ,检测AEC Ⅱ中细胞表型相关特异性标记物、EMT相关标记物及促纤维化因子的mRNA表达水平,以期揭示AEC Ⅱ在放射性肺损伤过程中的细胞表型演变及其参与肺纤维化形成的机制,为放射性肺损伤的发生机制提供新的理论依据。
材料与方法1. 主要试剂:DispaseⅡ购于德国Roche公司;DNaseI、庆大霉素、2 mmol/L L-谷氨酰胺、2.5 μg/ml两性霉素B和20 mmol/L HEPES(pH 7.4)均购于北京索莱宝科技有限公司;带有CD45抗体和Ep-CAM抗体的MicroBeads购于德国Miltenyi公司。
2. 实验动物与分组:雌性C57BL/6J小鼠(SPF级)90只,6~8周龄,体重20 g左右,购于北京维通利华实验动物中心,分笼饲养于河南中医药大学实验动物中心,食水不限。按随机数表法随机分成假照射组(40只)和照射组(50只)。
3. 放射性肺损伤模型的建立:小鼠用1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉后,每10只小鼠腹面朝上依次排列,并以胶带固定于治疗床上,铅屏蔽头部与腹部。采用Elekta Precise高能直线加速器(瑞典医科达公司),6 MV光子,经前胸单次照射小鼠20 Gy,吸收剂量率300 cGy/min,源皮距(SSD)1 m,照射野2 cm ×3 cm,确保全肺受照。假照射组小鼠以同样的方法麻醉后,以0 Gy剂量假照射。照射后小鼠常规喂饲并动态观测动物一般情况。分别于照射24 h(10只)、4周(10只)和12周(15只)后取小鼠用于原代AEC Ⅱ的分离,另外,分别在上述时间点取5只小鼠的肺组织经10%中性甲醛溶液固定。
4. AEC Ⅱ的分离纯化:小鼠麻醉后固定于操作台内,首先用磷酸盐缓冲液(PBS)心脏灌流至双侧肺叶变白,后经气管插管注入DispaseⅡ溶液,并用低熔点琼脂糖封闭插管。胸部覆以碎冰,待琼脂糖凝固后取下完整的心脏和肺,置于含有10 μg/ml庆大霉素和2.5 μg/ml两性霉素B的PBS中。分离心脏和大支气管,将肺叶置于含有10 μg/ml庆大霉素,2 mmol/L L-谷氨酰胺,2.5 μg/ml两性霉素B,20 mmol/L HEPES(pH 7.4)和120U/mlDNaseI溶液的MACS C管中,使用Gentle MACS Dissociator组织解离仪将肺组织研磨成单细胞悬液。该悬液分别经70和40 μm细胞过滤器过滤后,先后与吸附有CD45抗体和Ep-CAM抗体的MicroBeads孵育,经过磁力柱两次分选获得CD45-Ep-CAM+细胞。其中Ep-CAM在AEC Ⅱ中特异性表达,但有研究证明CD45+细胞中也有少量表达Ep-CAM,故首先去除CD45+细胞[5-6]。
5. AECⅡ的鉴定:分离得到的细胞沉淀经2.5%戊二醛和1%四氧化锇固定后包埋于环氧树脂中,经透射电子显微镜观察AEC Ⅱ的特征性板层小体进行鉴定。
6. 小鼠肺组织病理学观察:所有组别的肺组织经10%中性甲醛溶液固定后,按常规流程制作石蜡包埋切片,组织切片经HE染色和Masson三色染色,光镜下观察肺组织形态和胶原蛋白分布情况。
7. AEC Ⅱ细胞中相关分子实时荧光定量(RT-PCR)检测:AEC Ⅱ沉淀经Trizol提取总RNA,反转录合成cDNA。以cDNA为模板进行RT-PCR,反应条件为:95℃预变性2 min,95℃变性30 s,95℃退火30 s,40个循环。通过2-△△Ct法计算各基因的mRNA相对表达量,引物序列见表 1。
|
|
表 1 RT-PCR引物序列 Table 1 The primers of RT-PCR |
8. 统计学处理: 所有数据采用SPSS 24.0统计软件进行数据分析,均进行正态性检验和方差齐性检验,各组间总的趋势比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD-t检验法,以x ±s表示。P < 0.05为差异有统计学意义。
结果1. 小鼠的一般情况:6 MV光子照射4周后,照射组小鼠照射区域的被毛颜色开始变浅, 极少数小鼠出现照射野溃疡,而假照射组小鼠照射野皮肤及被毛无异常。照射12周后,照射组小鼠照射野内被毛颜色全部变白,精神变差,活动量变少,体重减轻。取肺组织时可见假照射组肺组织呈淡红色,而照射组中照射24 h后肺组织颜色加深,并在照射4周后恢复淡红色,照射12周后所取的肺组织萎缩,色暗。
2. 小鼠肺组织病理学改变:假照射组小鼠肺组织内支气管、细支气管结构正常,肺泡形态正常,壁薄。毛细血管壁完整,未见明显渗出和出血,无炎症反应。射线照射24 h后,小鼠的肺组织内出现急性放射性肺炎,主要表现为肺间质及肺泡壁水肿,伴有大量炎性细胞浸润(图 1)。照射4周后仍可见少量炎性细胞浸润,同时伴有明显地毛细血管充血,部分肺泡间隔不规则增厚,或相邻的肺泡融合成大肺泡囊,使肺泡总表面积减小,Masson染色结果显示在肺泡间隙内有少量蓝色胶原沉积。照射12周后,胶原沉积更加明显,肺泡腔塌陷融合,肺泡间隔异常增生,正常肺泡结构几乎不可见(图 1)。
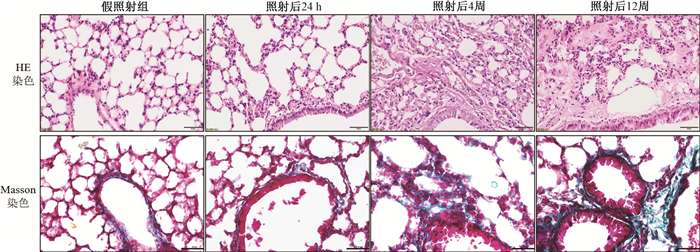
|
图 1 小鼠照射后不同时间点肺组织病理学变化(标尺=50 μm) Figure 1 Histopathological changes of the lungs of mice after irradiation(Ruler=50 μm) |
AEC Ⅱ的分离过程及鉴定: 纯化后的AEC Ⅱ在透射电子显微镜下可见胞浆内存在AEC Ⅱ特有的板层小体, 见图 2。于低倍镜下统计不同视野内含有板层小体的细胞所占细胞总数的纯度为90.7%,可用于后续实验。
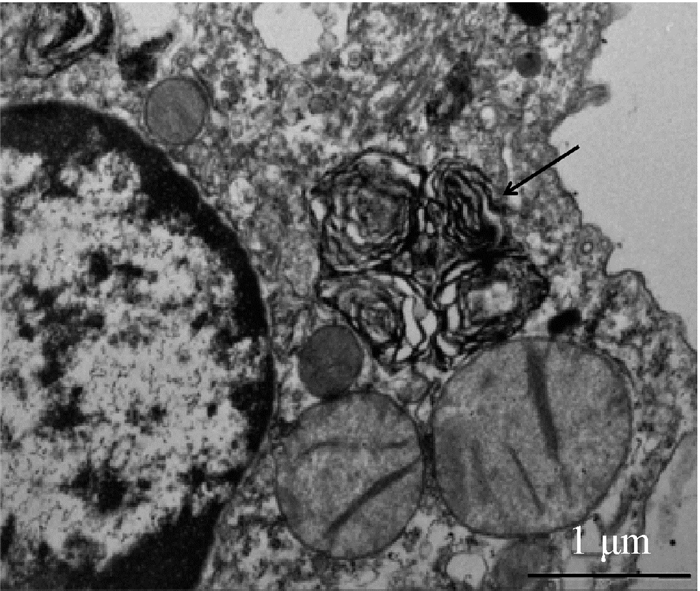
|
注:箭头为板层小体,标尺=1 μm 图 2 透射电镜下小鼠AEC Ⅱ胞浆内超微结构 Figure 2 The ultrastructural of mouse AEC cytoplasmby transmission electron microscope |
3. AEC Ⅱ内细胞表型特异性标记物的表达水平:proSP-C作为AEC Ⅱ细胞的特异性标记物,其mRNA相对表达量在所有4组间的均值差异具有统计学意义(F=8.441,P=0.001),多重比较分析显示,与假照射组相比,其mRNA相对表达量在照射后24 h开始升高(P < 0.05),并在照射4周后达到峰值(P < 0.05),肺Ⅰ型上皮细胞(AEC Ⅰ)的特征性标记物是HOPX,其mRNA的相对表达量在所有4组间的均值差异具有统计学意义(F=3.586,P=0.036),多重比较分析显示,与假照射组相比,其mRNA相对表达量在在照射后升高,差异在4周后具有统计学意义(P < 0.05),见表 2。
|
|
表 2 小鼠照射后不同时间点ACE Ⅱ细胞表型标记物表达水平(x ±s) Table 2 The mRNA levels of cell phenotype biomarkers in ACE Ⅱ cells after irradiation(x ±s) |
4. AECⅡ内EMT相关基因的表达水平:E-cadherin是上皮细胞特异性标记物,其mRNA相对表达量虽然随着照射后时间的增加而有变化,但4组间的均值差异不具有统计学意义(F=1.978,P=0.151)。Vimentin是间质细胞特异性标记物,其mRNA相对表达量在4组间的均值差异具有统计学意义(F=8.358,P=0.001),多重比较分析显示,与假照射组相比,其mRNA相对表达量在照射后第4周和第12周均明显升高(P<0.05),见表 3。
|
|
表 3 小鼠照射后不同时间点ACE Ⅱ内EMT相关基因的表达水平(x ±s) Table 3 The expressions of EMT-related genes in ACE Ⅱ cells after irradiation(x ±s) |
5. AEC Ⅱ内促纤维化相关因子表达水平:β-catenin、TGF-β1的mRNA相对表达量均在照射后升高,4组间的均值差异均具有统计学意义(F=4.623、3.279,P=0.044),多重比较分析显示,与假照射组相比,其mRNA相对表达量均在照射后12周均显著升高(P < 0.05,见表 4)。
|
|
表 4 小鼠照射后不同时间点AEC Ⅱ细胞内促纤维化基因的表达水平(x ±s) Table 4 The expressions of profibrotic genes in ACE Ⅱ cellsafter irradiation(x ±s) |
讨论
近年来,为寻找新型有效的放射性肺损伤临床治疗方法,有关其发生机制的研究探索逐渐深入。电离辐射带来的直接损伤或产生的活性氧,可造成肺上皮、内皮等肺部细胞的损伤,细胞损伤进一步导致细胞因子的释放,触发多种信号传导通路,引起多种级联反应[7-9]。作为肺内干细胞,AEC Ⅱ数目虽然仅占肺泡上皮细胞总量的7%,但其不仅有合成分泌肺表面活性物质和免疫调节因子的功能,同时可以分化为AECI维持肺稳态,由此可见,AEC Ⅱ在放射性肺损伤修复过程中发挥重要作用[10-11]。因此,针对AEC Ⅱ的细胞功能研究或将精准揭示肺的损伤和其修复机制。但AEC Ⅱ细胞易损伤,体外培养时细胞表型难以维持,导致AEC Ⅱ体外分离纯化步骤复杂且难以体外培养,所以有关AEC Ⅱ的体外研究极难开展。既往关于放射性肺损伤的研究也大多局限于肺组织,不能准确而详实地探究AEC Ⅱ的细胞表型变化及其参与放射性肺损伤修复的机制。本研究直接从照射后不同时间点的肺组织中分离出原代AEC Ⅱ进行研究,可较为真实反映不同损伤阶段AEC Ⅱ在体内的细胞表型动态,此为本研究的创新和特点。
通过RT-PCR检测照射后不同时间点AECⅡ中有关AEC Ⅱ和AEC Ⅰ特异性标记物的表达水平,本研究发现AECⅡ的特异性标记物proSP-C基因表达量在射线照射后,即急性炎症期开始急剧增加,并在照射4周后达到最高水平。结合本研究的肺组织病理学结果可知,在照射4周后肺组织虽仍有炎症细胞浸润,但已出现胶原沉积。而当肺组织处于明显的肺纤维化时期,即在照射12周后,proSP-C的表达水平又急剧下降。proSP-C是一种仅在AEC Ⅱ内合成分泌的肺表面活性物质,已有研究证实其表达上调预示着AEC Ⅱ正在进行自我增殖[12]。与proSP-C基因表达变化趋势一致,AEC Ⅰ细胞的特异性标记物HOPX的表达在照射4周后达到峰值,随后下降。在急性放射性肺炎时期,HOPX的表达维持低水平,并且低于proSP-C的表达水平,这对AEC Ⅱ的自我增殖十分必要[13]。由此推测,在损伤早期,AEC Ⅱ可能通过快速补充表面活性蛋白,自我增殖和分化为AEC Ⅰ等多种途径以维持正常肺泡功能。但进入放射性肺损伤的后期,即照射后12周,AEC Ⅱ可能已被消耗或异分化为间质样细胞,proSP-C分泌不足,修复进入另外一个阶段,即纤维化发生。此时HOPX又恢复低表达水平,HOPX可能是纤维化进展的潜在指标[13]。
AEC Ⅱ自我增殖后分化为AEC Ⅰ,对损伤后肺稳态的维持至关重要。但也有研究认为AECⅡ诱导EMT的发生,导致损伤后肺纤维化的形成[14]。在整个放射性肺损伤阶段,上皮细胞特异性标记物E-cadherin的表达水平虽有变化,但浮动范围很小,且没有固定趋势,差异无统计学意义。这表示在射线照射24 h至12周后,分离的原代AEC Ⅱ仍保留上皮细胞表型。而间质细胞特异性标记物,Vimentin的表达水平则随照射后时间的增加而升高,在照射4周后明显高表达。其表达上调是肺泡上皮细胞早期损伤修复和重塑所必需[15]。照射12周后,Vimentin表达水平达到峰值,但同时HOPX,proSP-C的表达处于较低水平,表明AEC Ⅱ细胞此时已经呈现间质细胞表型,为促纤维化因子的分泌提供细胞来源。
TGF-β1已被证实为诱导EMT的“主开关”,可与β-catenin一起参与纤维化的形成,AEC Ⅱ被认为是除成纤维细胞外TGF-β1的另一重要来源[16-17]。β-catenin是Wnt/β-catenin信号通路的关键分子。在正常情况下,β-catenin与E-cadherin连接形成复合物,维持上皮细胞完整性。一旦β-catenin与E-cadherin分离并转移到细胞核中,将诱导EMT的发生[18]。本研究中,分离的原代AEC Ⅱ内促纤维化因子TGF-β1和β-catenin的表达均随照射后时间的延长而持续增加,并在照射12周后明显高表达,表明在损伤后期AEC Ⅱ可表达促纤维化因子,启动EMT,导致放射性肺纤维化的形成。已有研究在小鼠模型中使用TGF-β1信号通路拮抗剂逆转EMT,即可抑制纤维化的发生[19-20]。这也将为放射性肺损伤的治疗提供新的思路。
综上所述,本研究通过成功分离照射后不同时期的原代AEC Ⅱ,检测AEC Ⅱ内细胞表型相关特异性标记物、EMT相关标记物及促纤维化因子的基因表达水平,结合相应肺损伤时期的肺组织病理学结果,揭示了在放射性肺损伤进展过程中AEC Ⅱ的动态细胞表型变化,即AECⅡ细胞表型从prosp-c+ →hopx+ /prosp-c+ →hopx+ /prosp-c+ /vimentin+ →vimentin+ /prosp-c的转换。AEC Ⅱ细胞表型的动态变化提示肺组织经射线照射损伤后从正常损伤修复到纤维化的演变过程。此外,AECⅡ还可能通过异分化为间质细胞,高表达促纤维化因子,诱导EMT的发生,形成纤维化。放射性肺损伤不同阶段AECⅡ细胞表型的明确,为下一步细胞和小鼠药物实验研究提供启发。今后将进一步探索在AECⅡ体外培养体系和小鼠模型中,给予维持其细胞表型的添加物,能否逆转纤维化结局。
利益冲突 研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突,排名无争议
作者贡献声明 张婷婷负责细胞分离及分子实验、数据分析及论文撰写;周建炜负责小鼠饲养及模型建立;岳浩迪、李颜君、耿熙炆负责组织病理学实验;李立、张玉薇、刘小转负责指导统计分析;田健指导实验设计及论文修改
| [1] |
应航洁, 陈亚梅, 陈梦圆, 等. 放射性肺损伤发生机制研究进展[J]. 中华放射肿瘤学杂志, 2021, 30(2): 213-216. Ying HJ, Chen YM, Chen MY, et al. Research progress on the mechanism of radiation-induced lung injury[J]. Chin J Radiat Oncol, 2021, 30(2): 213-216. DOI:10.3760/cma.j.cn113030-20190628-00248 |
| [2] |
Rock JR, Barkauskas CE, Cronce MJ, et al. Multiple stromal populations contribute to pulmonary fibrosis without evidence for epithelial to mesenchymal transition[J]. Proc Natl Acad Sci USA, 2011, 108(52): E1475-1483. DOI:10.1073/pnas.1117988108 |
| [3] |
Crosby LM, Luellen C, Zhang Z, et al. Balance of life and death in alveolar epithelial type Ⅱ cells: proliferation, apoptosis, and the effects of cyclic stretch on wound healing[J]. Am J Physiol Lung Cell Mol Physiol, 2011, 301(4): L536-546. DOI:10.1152/ajplung.00371.2010 |
| [4] |
Piera-Velazquez S, Mendoza FA, Jimenez SA. Endothelial to mesenchymal transition (EndoMT) in the pathogenesis of human fibrotic diseases[J]. J Clin Med, 2016, 5(4): 45. DOI:10.3390/jcm5040045 |
| [5] |
Hasegawa K, Sato A, Tanimura K, et al. Fraction of MHCⅡ and EpCAM expression characterizes distal lung epithelial cells for alveolar type 2 cell isolation[J]. Respir Res, 2017, 18(1): 150. DOI:10.1186/s12931-017-0635-5 |
| [6] |
Messier EM, Mason RJ, Kosmider B. Efficient and rapid isolation and purification of mouse alveolar type Ⅱ epithelial cells[J]. Exp Lung Res, 2012, 38(7): 363-373. DOI:10.3109/01902148.2012.713077 |
| [7] |
Käsmann L, Dietrich A, Staab-Weijnitz CA, et al. Radiation-induced lung toxicity-cellular and molecular mechanisms of pathogenesis, management, and literature review[J]. Radiat Oncol, 2020, 15(1): 214. DOI:10.1186/s13014-020-01654-9 |
| [8] |
Giuranno L, Ient J, De Ruysscher D, et al. Radiation-induced lung injury (RILI)[J]. Front Oncol, 2019, 9: 877. DOI:10.3389/fonc.2019.00877 |
| [9] |
Huang Y, Zhang W, Yu F, et al. The cellular and molecular mechanism of radiation-induced lung injury[J]. Med Sci Monit, 2017, 23: 3446-3450. DOI:10.12659/msm.902353 |
| [10] |
Barkauskas CE, Cronce MJ, Rackley CR, et al. Type 2 alveolar cells are stem cells in adult lung[J]. J Clin Invest, 2013, 123(7): 3025-3036. DOI:10.1172/JCI68782 |
| [11] |
肖子婷, 田健, 朱琰琰, 等. 肺Ⅱ型上皮干细胞分化在放射性肺纤维化中作用[J]. 中华放射肿瘤学杂志, 2020, 29(12): 1102-1109. Xiao ZT, Tian J, Zhu YY, et al. The role of lung type Ⅱ epithelial stem cell differentiation in radiation-induced pulmonary fibrosis[J]. Chin J Radiat Oncol, 2020, 29(12): 1102-1109. DOI:10.3760/cma.j.cn113030-20190811-00323 |
| [12] |
Beers MF, Moodley Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine[J]. Am J Respir Cell Mol Biol, 2017, 57(1): 18-27. DOI:10.1165/rcmb.2016-0426PS |
| [13] |
Ota C, Ng-Blichfeldt JP, Korfei M, et al. Dynamic expression of HOPX in alveolar epithelial cells reflects injury and repair during the progression of pulmonary fibrosis[J]. Sci Rep, 2018, 8(1): 12983. DOI:10.1038/s41598-018-31214-x |
| [14] |
Crosby LM, Waters CM. Epithelial repair mechanisms in the lung[J]. Am J Physiol Lung Cell Mol Physiol, 2010, 298(6): L715-731. DOI:10.1152/ajplung.00361.2009 |
| [15] |
Rogel MR, Soni PN, Troken JR, et al. Vimentin is sufficient and required for wound repair and remodeling in alveolar epithelial cells[J]. FASEB J, 2011, 25(11): 3873-3883. DOI:10.1096/fj.10-170795 |
| [16] |
Königshoff M, Eickelberg O. WNT signaling in lung disease: a failure or a regeneration signal?[J]. Am J Respir Cell Mol Biol, 2010, 42(1): 21-31. DOI:10.1165/rcmb.2008-0485TR |
| [17] |
夏诚诚, 宋宇哲, 丁丽娟, 等. 肺泡上皮间质转分化的信号转导研究进展[J]. 中华放射医学与防护杂志, 2014, 34(7): 555-558. Xia CC, Song YZ, Ding LJ, et al. Research progress on signal transduction of epithelial-mesenchymal transition in alveoli[J]. Chin J Radiol Med Prot, 2014, 34(7): 555-558. DOI:10.3760/cma.j.issn.0254-5098.2014.07.020 |
| [18] |
Basu S, Cheriyamundath S, Ben-Ze'ev A. Cell-cell adhesion: linking Wnt/β-catenin signaling with partial EMT and stemness traits in tumorigenesis[J]. F1000 Res, 2018, 7: 1488. DOI:10.12688/f1000research.15782.1 |
| [19] |
Zeisberg M, Bottiglio C, Kumar N, et al. Bone morphogenic protein-7 inhibits progression of chronic renal fibrosis associated with two genetic mouse models[J]. Am J Physiol Renal Physiol, 2003, 285(6): 1060-1067. DOI:10.1152/ajprenal.00191.2002 |
| [20] |
孙丹丹, 肖莉, 于悦. LY2109761对小鼠放射性肺纤维化的治疗作用[J]. 中华放射医学与防护杂志, 2017, 37(9): 651-655. Sun DD, Xiao L, Yu Y. Role of LY2109761 in radiation-induced pulmonary fibrosis in mice[J]. Chin J Radiol Med Prot, 2017, 37(9): 651-655. DOI:10.3760/cma.j.issn.0254-5098.2017.09.002 |
 2022, Vol. 42
2022, Vol. 42


