放射治疗是临床肿瘤常规且有效的治疗方法之一,但在盆腹腔肿瘤患者的放射治疗过程中,高剂量的电离辐射会引起肠黏膜炎症和内皮细胞(EC)损伤,导致急性肠损伤[1]。因此,为临床上寻找减轻放射治疗引起的肠道损伤的方法至关重要。
血管性血友病因子裂解蛋白酶(ADAMTS13)是血管性血友病因子(vWF)的裂解酶,主要由肝星状细胞和EC合成,具有调节炎症反应和血栓形成等功能。辐射会引起EC通透性增加、间质纤维蛋白沉积以及血栓-出血平衡偏向凝血,进而直接促进辐射暴露后的肠道损伤[2];此外,有动物实验证明急性放射性肠损伤EC中vWF表达和分泌增加[3],加重微血管和组织损伤,故EC被认为是辐射诱发肠病的关键部分[4]。而ADAMTS13可水解切割vWF,防止微血管血栓形成、功能障碍和组织损伤[5-6]。Zitomersky等[7]研究发现ADAMTS13缺乏会加重肠道炎症,前期也有研究表明rhADAMTS13可以通过抑制急性肾损伤炎症反应和氧化应激水平进而改善EC功能[8-9]。然而,目前鲜有关于rhADAMTS13是否能改善放射性肠损伤的研究,本研究重点关注rhADAMTS13能否通过调节炎症和氧化应激水平发挥辐射防护作用,为以EC中ADAMTS13-vWF平衡轴为靶点的辐射防护提供基础研究线索。
材料与方法1. 药品试剂:rhADAMTS13蛋白购于美国R&D Systems公司;vWF、ADAMTS13及C-反应蛋白(CRP)试剂盒购于上海酶联生物技术有限公司;丙二醛(MDA)、总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)和二氨基联苯胺(DAB)辣根过氧化物酶显色试剂盒购于上海碧云天生物技术有限公司;免疫组织化学使用Ki67抗体购自英国Abcam公司,髓过氧化物酶(MPO)及肿瘤坏死因子α(TNF-α)抗体购于美国Proteintech公司。
2. 实验动物及分组:8~10周龄C57BL/6 J雄性SPF级小鼠30只,体重(25±2)g,购于北京维通利华实验动物技术有限公司(许可证号:SCXK[京]2019-0009)。饲养于苏州大学动物实验中心(许可证号:XCYK [苏] 2002-0008),环境温度为22~25℃,湿度为55%~65%。1周适应喂养后,根据体重随机数表法分为3组,健康对照组(6只)、单纯照射组(12只)和联合组(12只),自由摄食饮水。联合组小鼠于照射前3 d给予尾静脉注射2.5 μg/kg rhADAMTS13,3 d后单纯照射组和联合组给予单次12 Gy X射线腹部照射。
3. 照射方案:5%水合氯醛麻醉小鼠,将小鼠于固定于特制固定架上。采用美国X-RAD 320直线加速器(美国Precision X-Ray公司)6 MV的X射线照射,源皮距为51 cm,剂量率为1 Gy/min,总照射剂量为12 Gy,照射范围为小鼠全腹部,其余用铅板遮挡。
4. 标本采集与处理:照射后1和3 d处死小鼠,腹主动脉取血(枸橼酸钠抗凝),离心半径为30 cm,3 000 r/min,4℃条件下离心15 min,取上清,-80℃冻存备用。用4%多聚甲醛溶液固定小肠组织,用于石蜡包埋切片及病理染色实验。
5. 病理切片观察及评价:取肠组织石蜡包埋切片,5 μm切片脱蜡至水后,苏木素-伊红(HE)染色。电子显微镜观察并采集图像分析。
6. Ki67、MPO和TNF-α免疫组织化学分析:取肠组织石蜡切片,脱蜡至水化,高压修复,3%过氧化氢灭活内源性过氧化物酶,牛血清白蛋白(BSA)封闭。加入50 μl的一抗Ki67 (1 ∶1 000稀释),MPO (1 ∶400稀释)和TNF-α(1 ∶500稀释),4℃孵育过夜,磷酸盐缓冲液(PBS)冲洗后加入二抗,常温孵育1 h,二氨基联苯胺(DAB)显色后复染苏木素,中性树胶封片待拍摄。免疫组织化学染色阳性细胞呈棕黄,染色深者呈褐色,每张切片随机取6个视野(×400)读片,并用Image Pro Plus图像分析软件对图像进行定量计算。
7. 酶联免疫吸附法(ELISA)检测血浆因子:血浆vWF、ADAMTS13和CRP按照试剂盒说明书检测,酶标仪450 nm波长检测吸光度(A450)值,计算各因子含量。
8. 氧化应激生化指标:血清MDA、T-AOC和SOD按照试剂盒说明书检测,酶标仪450 nm波长检测吸光度(A450)值,计算各氧化应激指标水平。
9. 统计学处理:采用SPSS 24.0软件进行统计学分析,数据符合正态分布,用x ±s表示。组间比较使用两独立样本t检验。P<0.05为差异具有统计学意义。
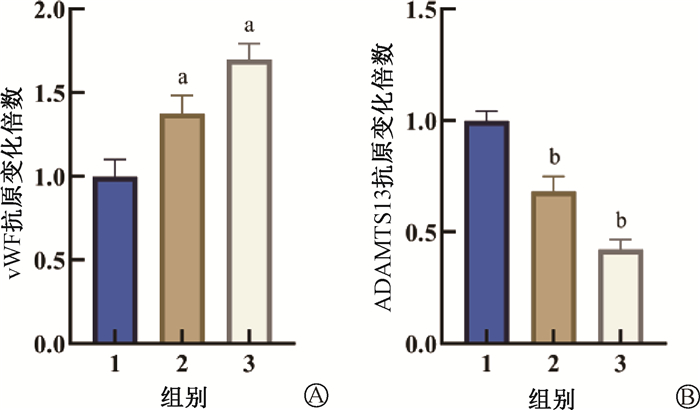
结果1.照射致小鼠血浆ADAMTS13-vWF轴紊乱:与健康对照组比较,照射后小鼠血浆vWF及ADAMTS13抗原水平均发生改变,其中照射后1和3 d血浆vWF含量上升(t=6.20、12.29,P < 0.05),而ADAMTS13水平下降(t=9.82、22.83,P < 0.05),差异均具有统计学意义,见图 1。
|
注:1.健康对照组;2.单纯照射组照射后1 d;3.单纯照射组照射后3 d;与健康对照组比较,at=6.20、12.29,P < 0.05;bt=9.82、22.83,P < 0.05;vWF.血管性血友病因子;ADAMTS13. 血管性血友病因子裂解蛋白酶 图 1 单纯照射组小鼠照后不同时间血浆ADAMTS13-vWF轴抗原水平变化 A.vWF抗原变化倍数;B.ADAMTS13抗原变化倍数 Figure 1 Changes of the antigen levels in plasma ADAMTS13-vWF axis at different time after irradiation A. Fold change of vWF antigen; B. Fold change of ADAMTS13 antigen |
2. rhADAMTS13调节血浆ADAMTS13-vWF水平:与健康对照组比较,单纯照射组和联合组照射后1和3d vWF抗原含量均有不同程度增加(t= 7.47、3.72、12.29、8.58,P < 0.05),ADAMTS13抗原含量降低(t= 13.93、6.71、22.83、13.21,P < 0.05)。体内给予rhADAMTS13,联合组与单纯照射组比较,照后1和3 d小鼠血浆vWF含量降低差异具有统计学意义(t=2.93、3.96,P < 0.05),对于ADAMTS13水平被逆转而升高差异具有统计学意义(t=5.09、9.82,P < 0.05),见表 1。
|
|
表 1 各组小鼠照射后不同时间血浆vWF和ADAMTS13抗原水平变化倍数(x ±s) Table 1 Changes of plasma vWF and ADAMTS13 antigen at different time after irradiation in each group of mice (x ±s) |
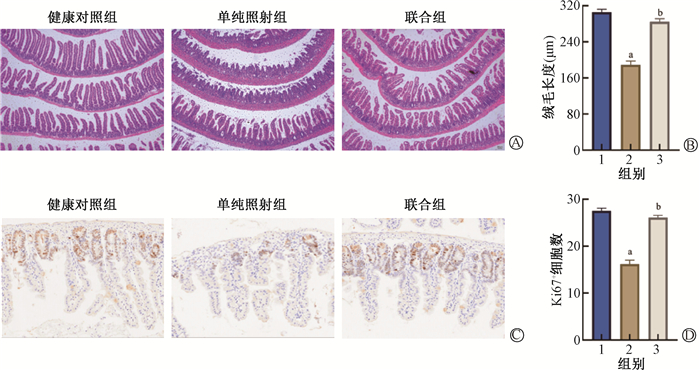
3. rhADAMTS13减轻辐射引起的肠道损伤:分别取单纯照射组和联合组照射后3 d的小鼠小肠进行HE和Ki67染色,以评估肠组织形态及修复能力。HE染色结果见图 2,与健康对照组比较,单纯照射组肠绒毛长度明显缩短,差异有统计学意义(t=10.53, P < 0.05);与单纯照射组比较,联合组绒毛缩短程度显著减轻(t=8.51,P < 0.05)。Ki67免疫组织化学染色结果见图 2,与健康对照组比较,单纯照射组隐窝Ki67+细胞数量明显减少(t=10.89, P < 0.05);与单纯照射组比较,联合组Ki67+细胞数量明显增加(t=9.82,P < 0.05)。
|
注:1.健康对照组;2.单纯照射组;3.联合组。a与健康对照组比较,t=10.53、10.89, P < 0.05;b与单纯照射组比较,t=8.51、9.82,P < 0.05;Ki67.增殖相关的核蛋白 图 2 照射后3 d小鼠肠组织病理染色及定量分析 A.HE染色 ×200;B.肠绒毛长度定量分析;C.Ki67免疫组织化学染色 ×400;D.隐窝Ki67+细胞数定量分析 Figure 2 Histopathological staining and quantitative analysis of mouse intestine 3 days after irradiation A. HE staining ×200; B. Quantitative analysis of intestinal villi length; C. Ki67 immunohistochemical staining ×400; D. Quantitative analysis of crypt Ki67+ cell count |
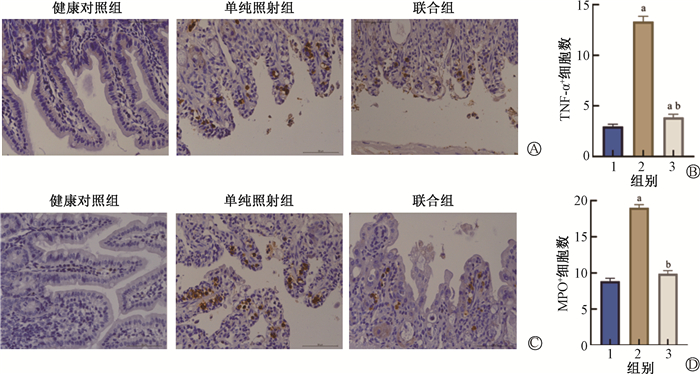
4. rhADAMTS13抑制由辐射诱导的肠道炎症:为了评估rhADAMTS13对放射性肠损伤的保护作用是否通过改善肠组织炎症水平实现,分别取单纯照射组和联合组照射后3 d肠组织进行TNF-α和MPO免疫组织化学染色。与健康对照组相比,单纯照射组与联合组TNF-α+水平增加(t=18.14、2.32,P < 0.05);联合组与单纯照射组相比,TNF-α+细胞在肠组织浸润水平降低,差异有统计学意义(t=15.44,P < 0.05)。与健康对照组比较,单纯照射组3 d MPO+细胞浸润明显增加(t=16.53,P < 0.05),联合组与单纯照射组比较MPO+细胞在肠组织浸润水平明显减低差异有统计学意义(t=14.33,P < 0.05),见图 3。此外,还检测了血浆炎症指标CRP的含量,结果见表 2,与健康对照组比,照射后1及3 d血浆CRP含量明显增加(t=7.63、3.42,P < 0.05);与单纯照射组比较,联合组照后1和3 d的CRP含量明显减低,差异具有统计学意义(t=5.02、2.96,P < 0.05)。
|
注:1.健康对照组;2.单纯照射组;3.联合组。a与健康对照组比较,t=18.14、2.32、16.53,P < 0.05;b与单纯照射组比较,t=15.44、14.33,P < 0.05;TNF-α.肿瘤坏死因子α;MPO.髓过氧化物酶 图 3 照射后3 d小鼠肠组织炎症细胞浸润程度 A.TNF-α免疫组织化学染色 ×400;B.TNF-α+细胞数定量分析;C.MPO免疫组织化学染色 ×400;D.MPO+细胞数定量分析 Figure 3 Status of inflammatory cell infiltration in mouse intestinal tissue 3 d after irradiation A. Immunohistochemical staining of TNF-α ×400; B. Quantitative analysis of TNF-α+ cell count; C. Immunohistochemical staining of MPO ×400; D. Quantitative analysis of MPO+ cell count |
|
|
表 2 各组小鼠照射后不同时间血浆CPR及氧化应激相关指标水平变化(x ±s) Table 2 Changes of plasma CPR and oxidative stress-related indexes at different time after irradiation in various groups of mice (x ±s) |
5. rhADAMTS13减轻放射性肠损伤小鼠氧化应激水平:与健康对照组比,照射后1和3 d,MDA增加(t=3.31、4.40,P < 0.05),SOD和T-AOC均减低(t=3.54、4.58、6.39、7.86,P < 0.05)。与单纯照射组比,联合组照射后1和3 d,MDA下降(t=2.47、2.55,P < 0.05),且SOD及T-AOC增强,差异有统计学意义(t=2.64、3.05、5.64、5.07,P < 0.05), 见表 2。
讨论rhADAMTS13已在动物水平开展广泛研究,主要集中在心肌损伤、肾脏损伤和结肠炎领域,其体内裂解底物vWF由内皮细胞棒杆状小体、血小板α颗粒和内皮下结缔组织合成并分泌至血浆,常被认为是血管内皮损伤标志物。Savchenko等[10]认为EC损伤会释放vWF多聚体,促进白细胞和血小板募集,导致更多的棒杆状小体释放vWF,形成炎症浸润和氧化应激的恶性循环。ADAMTS13主要由肝脏星状细胞和血管内皮细胞合成,分泌于血液之中被证实可以通过对vWF蛋白的水解作用,在动脉粥样硬化、局灶性脑缺血和心肌缺血再灌注期间降低炎症反应[11-13]。此外,有研究表明在接受5至6周放疗的盆腔癌患者中,大约80% 的患者会出现胃肠道功能障碍[14]。由于胃肠道有大量EC和黏膜上皮细胞,因此EC障碍被认为是放射性肠病的关键因素之一[15]。
本研究发现,辐照后小鼠血浆vWF抗原水平升高,而ADAMTS13水平下降,表明血浆ADAMTS13-vWF轴紊乱和血管内皮功能障碍。进一步体内给予rhADAMTS13,结果证明rhADAMTS13可恢复ADAMTS13-vWF轴和减轻辐照后小鼠肠损伤,具体表现为绒毛损伤减轻、隐窝Ki67+细胞数量增加等。以上结果表明辐射肠损伤的发生和损伤程度可能与vWF抗原水平升高以及ADAMTS13抗原水平降低有关。
与之前的研究一致,本研究结果表明rhADAMTS13可降低辐射后肠组织TNF-α和MPO+细胞浸润以及血浆CRP含量,发挥一定的抗炎作用。另一方面,氧化应激主要参与辐射引起的肠道损伤,尤其与EC和肠上皮损伤有关。目前的研究表明,氧化应激被vWF增强,但被rhADAMTS13抑制[16]。因此,rhADAMTS13可能通过降低氧化应激水平来限制辐射肠损伤和功能障碍。Kremer等[17]证明EC损伤刺激vWF释放,从而促进血小板聚集和单核细胞活化,而ADAMTS13的合成和分泌受到抑制,由此产生的低水平ADAMTS13不能再充分切割升高的vWF,并且血小板锚定在血管内皮腔中的vWF沉积物上,会进一步促进损伤部位的单核细胞渗出。这种活化的单核细胞会产生大量的ROS,进而增加氧化应激和组织炎症,形成恶性循环,加剧组织损伤[18]。因此,ADAMTS13-vWF轴在氧化应激相关途径中也可能发挥重要作用。本研究结果表明rhADAMTS13可以通过降低MDA含量、增加SOD活性及T-AOC发挥抑制辐照后机体氧化应激功能,但具体作用机制还需进一步研究。
综上,rhADAMTS13通过降低炎症和氧化应激水平减轻放射性肠损伤,指出通过调控ADAMTS13-vWF轴对放射性肠损伤的防护与治疗可能具有积极意义。
利益冲突 所有研究者均未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 许杰负责实验操作与数据分析、论文撰写;周雅丽、王文负责部分数据分析与实验操作;何杨负责课题设计与指导、论文修改
| [1] |
Hauer-Jensen M, Denham JW, Andreyev HJ. Radiation enteropathy-pathogenesis, treatment and prevention[J]. Nat Rev Gastroenterol Hepatol, 2014, 11(8): 470-479. DOI:10.1038/nrgastro.2014.46 |
| [2] |
Korpela E, Liu SK. Endothelial perturbations and therapeutic strategies in normal tissue radiation damage[J]. Radiat Oncol, 2014, 9: 266. DOI:10.1186/s13014-014-0266-7 |
| [3] |
Kim KT, Chae HS, Kim JS, et al. Thalidomide effect in endothelial cell of acute radiation proctitis[J]. World J Gastroenterol, 2008, 14(30): 4779-4783. DOI:10.3748/wjg.14.4779 |
| [4] |
Paris F, Fuks Z, Kang A, et al. Endothelial apoptosis as the primary lesion initiating intestinal radiation damage in mice[J]. Science, 2001, 293(5528): 293-7. DOI:10.1126/science.1060191 |
| [5] |
Béland S, Désy O, Ung RV, et al. Tacrolimus prevents von Willebrand factor secretion by allostimulated human glomerular endothelium[J]. Am J Transplant, 2018, 18(9): 2314-2321. DOI:10.1111/ajt.14944 |
| [6] |
Yang K, Du C, Wang X, et al. Indoxyl sulfate induces platelet hyperactivity and contributes to chronic kidney disease-associated thrombosis in mice[J]. Blood, 2017, 129(19): 2667-2679. DOI:10.1182/blood-2016-10-744060 |
| [7] |
Zitomersky NL, Demers M, Martinod K, et al. ADAMTS13 deficiency worsens colitis and exogenous ADAMTS13 administration decreases colitis severity in mice[J]. TH Open, 2017, 1(1): e11-e23. DOI:10.1055/s-0037-1603927 |
| [8] |
Zhou S, Guo J, Zhao L, et al. ADAMTS13 inhibits oxidative stress and ameliorates progressive chronic kidney disease following ischaemia/reperfusion injury[J]. Acta Physiol (Oxf), 2021, 231(3): e13586. DOI:10.1111/apha.13586 |
| [9] |
Zhou S, Jiang S, Guo J, et al. ADAMTS13 protects mice against renal ischemia-reperfusion injury by reducing inflammation and improving endothelial function[J]. Am J Physiol Renal Physiol, 2019, 316(1): F134-F145. DOI:10.1152/ajprenal.00405.2018 |
| [10] |
Savchenko AS, Borissoff JI, Martinod K, et al. VWF-mediated leukocyte recruitment with chromatin decondensation by PAD4 increases myocardial ischemia/reperfusion injury in mice[J]. Blood, 2014, 123(1): 141-8. DOI:10.1182/blood-2013-07-514992 |
| [11] |
Gandhi C, Khan MM, Lentz SR, et al. ADAMTS13 reduces vascular inflammation and the development of early atherosclerosis in mice[J]. Blood, 2012, 119(10): 2385-2391. DOI:10.1182/blood-2011-09-376202 |
| [12] |
Khan MM, Motto DG, Lentz SR, et al. ADAMTS13 reduces VWF-mediated acute inflammation following focal cerebral ischemia in mice[J]. J Thromb Haemost, 2012, 10(8): 1665-1671. DOI:10.1111/j.1538-7836.2012.04822.x |
| [13] |
Gandhi C, Motto DG, Jensen M, et al. ADAMTS13 deficiency exacerbates VWF-dependent acute myocardial ischemia/reperfusion injury in mice[J]. Blood, 2012, 120(26): 5224-30. DOI:10.1182/blood-2012-06-440255 |
| [14] |
Andreyev J. Gastrointestinal complications of pelvic radiotherapy: are they of any importance?[J]. Gut, 2005, 54(8): 1051-1054. DOI:10.1136/gut.2004.062596 |
| [15] |
Dimitrievich GS, Fischer-Dzoga K, Griem ML. Radiosensitivity of vascular tissue. Ⅰ. Differential radiosensitivity of capillaries: a quantitative in vivo study[J]. Radiat Res, 1984, 99(3): 511-535. |
| [16] |
Xu N, Jiang S, Persson PB, et al. Reactive oxygen species in renal vascular function[J]. Acta Physiol (Oxf), 2020, 229(4): e13477. DOI:10.1111/apha.13477 |
| [17] |
Kremer Hovinga JA, Coppo P, Lämmle B, et al. Thrombotic thrombocytopenic purpura[J]. Nat Rev Dis Primers, 2017, 3: 17020. DOI:10.1038/nrdp.2017.20 |
| [18] |
Popa M, Tahir S, Elrod J, et al. Role of CD40 and ADAMTS13 in von Willebrand factor-mediated endothelial cell-platelet-monocyte interaction[J]. Proc Natl Acad Sci USA, 2018, 115(24): E5556-E5565. DOI:10.1073/pnas.1801366115 |
 2022, Vol. 42
2022, Vol. 42


