2. 中国科学院大学附属肿瘤医院(浙江省肿瘤医院)I期临床试验病房 中国科学院基础医学与肿瘤研究所,杭州 310022;
3. 中山大学附属第一医院放射治疗科,广州 510080;
4. 中山大学肿瘤防治中心,广州 510060
2. Department of Phase I Clinical Trail Ward, The Cancer Hospital of the University of Chinese Academy of Sciences(Zhejiang Cancer Hospital), Institute of Basic Medicine and Cancer(IBMC), Chinese Academy of Sciences, Hangzhou 310022, China;
3. Department of Radiation Therapy, First Affiliated Hospital of Sun Yat-sen University, Guangzhou 510080, China;
4. Sun Yat-sen University Cancer Center, Guangzhou 510060, China
以表皮生长因子受体-酪氨激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor, EGFR-TKI)为代表的肺癌靶向药物疗效显著,但多数患者在1~2年内发生不可逆转的耐药,早期辅以强有力的局部治疗,理论上会获得更好的疗效[1]。
克唑替尼(crizotinib)作为抑制ALK/Met/ROS的小分子多靶点蛋白激酶抑制剂,用于晚期非小细胞肺癌(non-smallcelllungcancer,NSCLC)的一线治疗,虽然只有3%~5%的NSCLC是间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)重排阳性[2],但这仍意味着全世界有相当多的患者受到影响。研究表明,克唑替尼联合放疗治疗ALK阳性肺癌有更强的抗肿瘤作用[3-4]。克唑替尼联合放疗治疗NSCLC患者是一种有潜力的治疗模式。放射性肺损伤是限制肺癌放疗疗效提高的主要因素之一[5]。有研究表明,将放疗与小分子酪氨激酶抑制剂(TKI)联合,会增加放射性肺损伤发生的概率[6]。2019年,本课题组首次报道了克唑替尼同步胸部放疗治疗ALK阳性NSCLC患者时会显著增加放射性肺炎的发生[7]。为明确克唑替尼与放疗联合对急性放射性肺损伤的影响及其可能机制,本研究应用急性放射性肺损伤小鼠模型进行了研究和探讨。
材料与方法1.主要试剂和仪器:小动物精准放疗研究平台(美国XStrahl公司);SimpliAmp PCR仪、7500型实时荧光定量PCR仪(美国ABI公司);小型垂直蛋白电泳仪(美国Bio-Rad公司);Azure c500凝胶成像(美国Azure Biosystems公司);SIX51光学显微镜(日本Olympus公司);克唑替尼(美国Pfizer公司);羟甲基纤维素钠(上海Aladdin公司);TRIzol Reagent、RT-qPCR试剂盒(日本TaKaRa公司);髓过氧化物酶(MPO)、细胞间黏附分子1(ICAM-1)、转化生长因子β1(TGF-β1)(英国Abcam公司);β-肌动蛋白、辣根过氧化物酶标记的山羊抗小鼠二抗(美国Sigma公司);磷酸盐缓冲液(PBS)、Western blot试剂盒(北京Biosharp公司);电化学发光(ECL)液、聚氰基丙烯酸正丁酯(BCA)蛋白检测试剂盒、牛血清蛋白(BSA,上海Beyotime公司)。
2.实验动物分组与照射方法:SPF级雌性8周C57BL/6J小鼠,体重18~20 g,购于上海斯莱克实验动物有限公司,实验动物生产许可证号:SCXK(沪)2017-0005,合格证号:20170005018546,以SPF级标准饲养,环境温度(24±2)℃,相对湿度50%,昼夜12 h交替,本实验经浙江中医药大学实验动物管理与伦理委员会审查批准。应用随机数字表将72只小鼠随机分为4组:健康对照组(NC组,12只),灌胃给予每天0.2 ml羟甲基纤维素钠;克唑替尼组(CRZ组,12只),灌胃给予每天25 mg/kg克唑替尼;单纯照射组(RT组,24只),全肺单次12Gy照射+灌胃给予0.2 ml羟甲基纤维素钠;照射+克唑替尼组(RT+CRZ组,24只),全肺单次12 Gy照射+同步给予每天25 mg/kg克唑替尼。CRZ组和RT+CRZ组小鼠第1次给药开始于照射前1周。用1%戊巴比妥钠(50 mg/kg)以腹腔注射的方式麻醉小鼠,采用220 kV X射线,吸收剂量率4 Gy/min,源皮距333 mm,单次全肺照射12 Gy。照射后的第1、2、4、8周,RT组和RT+CRZ组各取6只、NC组和CRZ组各取3只解剖留取标本实验。
3.肺支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)及蛋白浓度测定:辐照后第1、2、4、8周通过颈椎脱臼法处死受照后的小鼠,解剖并暴露肺组织,结扎左肺,进行开放性气管切开术,将1 ml注射器针管插入气管。将预冷的PBS注入肺部,每次0.2~0.5 ml,重复2~3次,直至总体积达到1 ml。BALF离心(1 500×g,15 min,4℃)后,上清利用BCA蛋白浓度测定试剂盒检测肺泡灌洗液中蛋白质浓度。细胞沉淀重悬于1 ml PBS溶液中,在光学显微镜下计数有核细胞的总数。
4.HE及Masson染色
(1) HE染色:将左肺置于10%甲醛溶液中固定24 h,梯度乙醇脱水,石蜡包埋,4 μm切片,脱蜡,苏木精-伊红染色,常规脱水后透明并封片。镜下观察各时间点肺泡破损程度及炎性细胞浸润程度。
(2) Masson染色:切片常规脱蜡至水,Weigert铁苏木素染色,酸性乙醇分化液分化并水洗。用Masson蓝化液返蓝,丽春红品红染色。磷钼酸溶液洗1~2 min,苯胺蓝染色,常规脱水,透明并用中性树胶封片。观察各时间点肺组织胶原纤维沉积程度。
5.免疫组织化学法:切片脱蜡,封闭,加1 ∶200稀释的一抗4℃孵育过夜,PBS冲洗后加入1 ∶200稀释的二抗37℃孵育过夜,冲洗后二氨基联苯胺(DAB)显色3 min,苏木精复染,脱水、透明、封片。在显微镜下观察靶蛋白在肺组织中的定位及表达水平,每张切片在200倍镜下随机选择5个视野,以染色强度和阳性细胞的百分比进行评分,总分为两者乘积。染色强度:无棕色颗粒为0分;淡黄色颗粒为1分;棕黄色颗粒为2分;大量棕色或褐色颗粒为3分。阳性细胞比例:无阳性细胞为0分,< 25%为1分,25%~50%为2分,50%~80% 为3分,>80%为4分。
6.实时荧光定量(qPCR)检测:TRIzol法提取小鼠肺组织总RNA约70 mg,提取总RNA在Nanodrop2000(美国Thermo公司)上测定吸光度(A260/A280=1.8~2.0)以确定纯度及浓度并定量,取500 ng RNA进行反转录反应,条件为37℃ 15 min,85℃ 5s。取1 μl反转录产物行qPCR,条件为95℃预变性30 s,95℃ 5 s,60℃ 34 s共40个循环。ΔCt=Ct各模板-Ctβ-肌动蛋白,ΔΔCt值=实验组ΔCt-对照组ΔCt,采用2-ΔΔCt法计算各基因相对内参的表达量。每个样本重复3次。引物序列如下:β-肌动蛋白正向引物为5′TGACAACTTTGGCATTGTG 3′,反向引物为5′CATACTTGGCAGGTTTCTCC 3′;TGF-β1正向引物为5′CTCCCGTGGCTTCTAGTG C 3′,反向引物为5′GCCTTAGTTTGGACAGGATCTG 3′;ICAM-1正向引物为5′GTGATGCTCAGGTATCCATCCA 3′,反向引物为5′CACAGTTCTCAAAGCACAGC G 3′。
7.蛋白免疫印迹法(Western blot)检测:使用放射免疫沉淀测定(RIPA)裂解液和苯甲基磺酰氟(PMSF)(江苏凯基生物公司,按100∶1体积混合)提取肺组织的总蛋白,通过BCA法测定样本蛋白浓度后,取40 μg蛋白,于10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中电泳,转膜至聚偏二氟乙烯膜(PVDF)膜上,于5%BSA封闭2~3 h后,分别加入用5%BSA稀释的一抗TGF-β1(1 ∶1 000)、Smad3(1 ∶2 000)、p-Smad3(1 ∶2 000)、ICAM-1(1 ∶2 000)及内参β-肌动蛋白(1 ∶5 000),4℃孵育过夜。洗膜3次后,加入HRP标记的对应二抗,室温孵育1~2 h,采用ECL法显色,于Azure c500凝胶成像系统进行拍照,ImageJ进行图像分析,目的蛋白条带的灰度值与内参蛋白条带灰度值的比值表示目的蛋白的相对表达量。
8.统计学处理:采用SPSS 25.0软件行统计分析,计量数据符合正态分布,两组间在同一时间的差异比较采用独立样本t检验。多组间在同一时间的差异比较数据符合方差齐性,采用Kruskal-Wallis检验。P < 0.05为差异具有统计学意义。
结果1.克唑替尼加重小鼠急性放射性肺损伤:HE染色结果显示,NC组和CRZ组的小鼠肺组织结构清晰,肺泡形态正常,肺泡壁薄,无渗出和出血。而RT组表现为肺泡壁轻度增厚,肺间质及肺泡毛细血管扩张伴少量出血,可见淋巴细胞等炎症细胞浸润。在各个时间点上,RT+CRZ组肺组织炎症、渗出等病理表现显著加重。MASSON染色结果显示,NC组和CRZ组的未见明显蓝色胶原沉积,而RT+CRZ组和RT组在照后1、2、4周,小支气管外膜和血管外膜的蓝色胶原分布明显(图 1)。
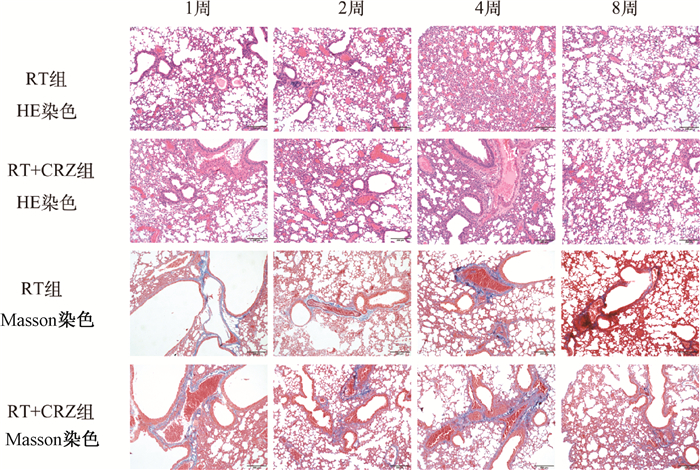
|
注:RT. 单纯照射组;CRZ. 克唑替尼组 图 1 克唑替尼对小鼠急性放射性肺损伤的病理观察 ×100 Figure 1 Pathological observation of the influence of crizotinib on acute radiation-induced lung injury in mice ×100 |
RT+CRZ组的肺泡灌洗细胞总数在第2、4、8周均高于其他组(图 2A、B),与RT组相比,第4周差异明显(t=-5.031,P < 0.05);同时,RT+CRZ组肺泡灌洗液中的蛋白含量在各时间点也均高于其他组,与RT组相比第4周增高明显(t=-2.814,P < 0.05);其灌洗液细胞总数及蛋白含量第4周达到峰值,第8周时有所回落,RT组的变化与之相似。

|
注:a与同一时间NC组比较,t=-8.043、-5.534、-3.101、-5.966,-8.767、-9.133、-7.230、-8.204,-8.800、-6.295、-5.116、-7.233,-8.704、-10.070、-4.135、-4.136,-41.43、-18.88、-29.03、-6.799、-16.64、-15.71,-7.848、-44.75、-32.53、-29.27、-17.44,P < 0.05;b与同一时间RT组比较,t=-5.031,-2.695,-2.726、-6.847、-5.379,-4.803、-6.051,-4.720、-8.056,-14.85、-9.449,P < 0.05;c与同一时间CRZ组比较,t=-7.730、-4.568,-4.686、-6.975,-8.744,-8.342、-9.074,-12.10、-13.85、-25.32,-44.58、-32.22,P < 0.05;NC. 健康对照组;RT. 单纯照射组;CRZ. 克唑替尼组 图 2 各组小鼠照后1、2、4、8周肺泡灌洗液细胞总数、所含蛋白变化及肺组织中相关因子表达情况 A,B.肺泡灌洗液中细胞总数及蛋白含量;C,D.肺组织中TGF-β1和ICAM-1 mRNA的相对表达水平;E,F.肺组织中ICAM-1和MPO免疫组织化学评分 Figure 2 The total number of cells and protein contents in BALF, and the expressions of related factors in lung tissue at 1, 2, 4 and 8 weeks after irradiation in each group A, B. Total number of cells and protein contents in BALF; C, D. Relative expression levels of TGF-β1 and ICAM-1 mRNA in lung tissue; E, F. Immunohistochemical score of ICAM-1 and MPO in lung tissue |
2.小鼠肺组织中TGF-β1和ICAM-1 mRNA水平的表达量:与RT组小鼠相比,在各个时间点,RT+CRZ组小鼠肺组织中的TGF-β1及ICAM-1的表达量上升,其中照射后第1、4、8周TGF-β1表达增高明显(t=-2.687、-7.032、-5.221,P < 0.05),照射后第2、4周ICAM-1表达增高明显(t=-4.819、-6.057,P < 0.05);二者均于第4周达到峰值,第8周时表达量有所下降(图 2C、D)。
3.免疫组织化学检测肺组织中ICAM-1和MPO蛋白表达:镜下结果显示,未照射小鼠的肺组织中ICAM-1、MPO的表达水平极低甚至无分布,RT组的肺组织中只有少量的肺泡上皮和单核吞噬细胞表达ICAM-1,肺间质中散在表达MPO。RT+CRZ组中ICAM-1和MPO出现明显阳性甚至强阳性表达。免疫组织化学评分结果与PCR结果类似。与RT组小鼠相比,第1~4周时,RT+CRZ组小鼠肺组织中的ICAM-1及MPO的表达量明显上升(tICAM-1=-4.064、-4.086、-4.814,P < 0.05;tMPO= -5.941、-4.720、-3.070,P < 0.05);并于第4周达到峰值,第8周时表达量明显下降(图 2E、F,图 3)。

|
注:ICAM-1. 细胞间黏附分子1;MPO. 髓过氧化物酶;NC. 健康对照组;RT. 单纯照射组;CRZ. 克唑替尼组 图 3 各组小鼠肺组织第4周的ICAM-1及MPO蛋白表达 免疫组织化学染色 ×200 Figure 3 Expressions of ICAM-1 and MPO protein in lung tissue of each group at 4 week after irradiation Immunohistochemical staining ×200 |
4.Western blot检测TGF-β1、Smad3、p-Smad3、ICAM-1在第4周时的蛋白表达情况:4组小鼠Smad3蛋白表达差异无统计学意义(P>0.05)。RT+CRZ组小鼠肺组织内的TGF-β1、p-Smad3、ICAM-1蛋白含量及p-Smad3/Smad3蛋白灰度比均高于其他3组,差异具有统计学意义(F=14.74、10.03、35.29、22.94,P < 0.05,见图 4)。
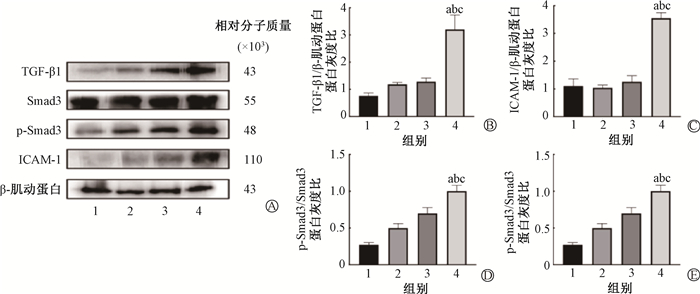
|
注:1.NC组;2.CRZ组;3.RT组;4.RT+CRZ组。a与NC组比较,t=-4.477、-7.398、-3.587、-8.759,P < 0.05;b与RT组比较,t=-3.486、-7.731、-2.831、-2.780,P < 0.05;c与CRZ组比较,t=-3.752、-11.31、-3.009、-5.064,P < 0.05 图 4 各组小鼠肺组织TGF-β1、Smad3、p-Smad3、ICAM-1在第4周时的蛋白表达 A.Westernblot检测TGF-β1、Smad3、p-Smad3、ICAM-1的蛋白表达;B.各组TGF-β1/β-肌动蛋白蛋白灰度比;C.各组ICAM-1/β-肌动蛋白蛋白灰度比;D.各组p-Smad3/β-肌动蛋白蛋白灰度比;E.各组p-Smad3/Smad3蛋白灰度比 Figure 4 The expressions of TGF-β1, Smad3, p-Smad3 and ICAM-1 protein in lung tissue of each group at 4 weeks after irradiation A. Western blot detection of expression of TGF-β1, Smad3, p-Smad3 and ICAM-1 protein; B. The ratio of TGF-β1/β-actin in each group; C. The ratio of ICAM-1/β-actin protein in each group; D. The ratio of p-Smad3/ β-actin in each group; E.The ratio of p-Smad3/Smad3 in each group |
讨论
靶向治疗联合放疗是NSCLC治疗的一大热点。然而,ALK抑制剂联合放疗治疗NSCLC的研究不多,其疗效和安全性仍在探索中。动物移植瘤模型实验结果表明,联合应用对肿瘤生长的抑制作用更强,导致肿瘤细胞凋亡增加。克唑替尼可以上调Bcl-2家族的促凋亡成员Bim的表达,同时下调凋亡蛋白家族抑制剂Survivin的表达,导致肿瘤细胞凋亡增加[8]。二者的联合调节了凋亡途径上的某些重要蛋白。克唑替尼可以抑制ALK、AKT、STAT3和ERK1/2的磷酸化,而放疗会激活ALK、AKT和STAT3。克唑替尼联合放疗后,ALK不再被激活,AKT和ERK的激活也明显减弱。与肿瘤发生发展关系密切的STAT3和PI3K/AKT信号通路在放射性肺损伤发生发展中也起着重要的作用。Yu等[9]研究表明,STAT3抑制情况下,TGF-β1 mRNA水平也会下降。另外,也有研究证实PI3K/AKT信号通路的激活能增强TGF-β1下游Smad3蛋白的转录活性[10]。这表明二者联合可能涉及辐射后的其他信号通路或关键蛋白的激活[3-4]。当然,仍需要更进一步的细胞机制研究。
本研究进行了克唑替尼联合照射对急性肺损伤影响的探索。结果显示,克唑替尼联合放疗可加重放射性肺损伤的程度,同时炎症因子存在时间相关性,从第1周开始炎症逐渐加重至第4周达到峰值,而后有所回落。这一发现与Rube等[11]和谢丛华团队[12-13]研究中放射性肺损伤相关炎症因子,如TGF-β1、ICAM-1 mRNA水平及肺组织的病理学变化结果相似。TGF-β1的过高表达可促进炎症反应,还能通过诱导活性氧的释放诱导氧化应激,在放射性肺损伤发生发展过程中发挥重要作用,作为放射性肺损伤最具代表性的炎症因子,其升高被认为是放射性肺损伤的标志[14]。既往研究表明,Smad3可能在早期放射性肺炎阶段发挥作用,同时Smad3敲除型小鼠还可以抵抗放射线、博莱霉素等各种原因引起的纤维化改变[15-17]。在信号传导过程中,只有磷酸化的Smads才能将TGF-β的刺激信号从胞浆迅速导入胞核,磷酸化Smads的水平可以反映TGF-β信号传导的强度[18]。在本研究中,根据炎症因子PCR结果,选择组间差异最大的第4周的小鼠进行Western blot实验检测TGF-β1、Smad3、p-Smad3蛋白表达情况,Smad3的表达在4组小鼠间没有明显差异,相较于RT组,RT+CRZ组的肺炎程度更加严重,并且TGF-β1及p-Smad3蛋白表达增强。提示克唑替尼可能是通过上调TGF-β1信号通路来加重急性放射性肺损伤。
急性炎症期的主要特征在于将多种免疫细胞募集到肺泡间隔,导致肺泡间隔增厚以及肺泡完整性的破坏[19]。白细胞表面的LFA-1/Mac受到相应刺激后迅速上调,与内皮细胞上表达的ICAM-1相互作用,介导白细胞粘附到内皮细胞上,最后通过上皮细胞间的间隙向黏膜组织外的其他炎症部位介导白细胞跨血管内皮迁移。但其在受辐照细胞中如何被调控以及哪些信号通路参与ICAM-1的表达调控,仍未有确切的机制。已有研究证明,ICAM-1和ICAM-1 mRNA在受辐照的人脐静脉内皮细胞(HUVEC)中高表达可能受TGF-β1调控,并参与纤维化的发生发展过程[20-21]。并且Yang等[22]和Kiyohara等[23]通过X射线照射HUVEC证实ICAM-1的一部分是通过TGF-β1信号通路调控的。而另一部分则可能是电离辐射激活NF-κB途径刺激各种粘附分子如ICAM-1、VCAM-1等产生[24]。外界刺激可导致中性粒细胞聚集,从而释放髓过氧化酶,受辐照后的内皮细胞表达ICAM-1和PECAM-1的增加促进嗜中性粒细胞向受损肺组织的迁移[25]。本研究显示,无论是蛋白质水平还是在mRNA水平上,在辐照和药物的双重影响下,小鼠肺组织的TGF-β1和ICAM-1表达在RT+CRZ组均明显增加,且在第4周具有明显差异,同时中性粒细胞的粘附趋势与TGF-β1及ICAM-1的变化相一致,三者之间存在一定联系。
综上,本研究探讨了克唑替尼对急性放射性肺损伤的影响,结果显示,12 Gy X射线单次照射小鼠全肺,克唑替尼联合照射后肺组织炎症、渗出等病理表现显著加重,与RT组相比,CRZ组肺组织中的ICAM-1、TGF-β1、MPO在照后1~4周表达逐渐上升,至第4周达高峰,第8周时表达下降;在照后第4周,RT+CRZ组TGF-β1、p-Smad3、ICAM-1蛋白均明显上调。因此,克唑替尼联合放疗会加重肺组织的损伤,其机制可能是通过上调TGF-β1信号通路对ICAM-1的表达产生影响,增加炎性细胞的粘附,加重了放射性肺炎的程度。
利益冲突 无
作者贡献声明 杭青青负责动物辐照、实验操作、数据整理及论文撰写;应航洁、金佳男、方敏参与动物辐照、实验研究操作及部分数据整理;包勇、陈明、彭芳在实验方案设计、结果分析和论文修改过程中给予指导
| [1] |
Zhuang H, Zhao X, Zhao L, et al. Progress of clinical research on targeted therapy combined with thoracic radiotherapy for non-small-cell lung cancer[J]. Drug Des Devel Ther, 2014, 8: 667-675. DOI:10.2147/DDDT.S61977 |
| [2] |
Kwak EL, Bang YJ, Camidge DR, et al. Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer[J]. N Engl J Med, 2010, 363(18): 1693-1703. DOI:10.1056/NEJMoa1006448 |
| [3] |
Sun Y, Nowak KA, Zaorsky NG, et al. ALK inhibitor PF02341066 (crizotinib) increases sensitivity to radiation in non-small cell lung cancer expressing EML4-ALK[J]. Mol Cancer Ther, 2013, 12(5): 696-704. DOI:10.1158/1535-7163.MCT-12-0868 |
| [4] |
Dai Y, Wei Q, Schwager C, et al. Synergistic effects of crizotinib and radiotherapy in experimental EML4-ALK fusion positive lung cancer[J]. Radiother Oncol, 2015, 114(2): 173-181. DOI:10.1016/j.radonc.2014.12.009 |
| [5] |
Hanania AN, Mainwaring W, Ghebre YT, et al. Radiation-induced lung injury: assessment and management[J]. Chest, 2019, 156(1): 150-162. DOI:10.1016/j.chest.2019.03.033 |
| [6] |
Chang CC, Chi KH, Kao SJ, et al. Upfront gefitinib/erlotinib treatment followed by concomitant radiotherapy for advanced lung cancer: a mono-institutional experience[J]. Lung Cancer, 2011, 73(2): 189-194. DOI:10.1016/j.lungcan.2010.12.007 |
| [7] |
Peng F, Bao Y, Chen L, et al. Increased radiation pneumonitis after crizotinib and concurrent thoracic radiotherapy in patients with ALK-positive non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2019, 105(1): S148-S149. |
| [8] |
Tanizaki J, Okamoto I, Okamoto K, et al. MET tyrosine kinase inhibitor crizotinib (PF-02341066) shows differential antitumor effects in non-small cell lung cancer according to MET alterations[J]. J Thorac Oncol, 2011, 6(10): 1624-1631. DOI:10.1097/JTO.0b013e31822591e9 |
| [9] |
Yu J, Yuan X, Liu Y, et al. Delayed administration of WP1066, an STAT3 inhibitor, ameliorates radiation-induced lung injury in mice[J]. Lung, 2016, 194(1): 67-74. DOI:10.1007/s00408-015-9821-8 |
| [10] |
Wu CT, Chen WC, Lin PY, et al. Androgen deprivation modulates the inflammatory response induced by irradiation[J]. BMC Cancer, 2009, 9: 92. DOI:10.1186/1471-2407-9-92 |
| [11] |
Rübe CE, Wilfert F, Uthe D, et al. Increased expression of pro-inflammatory cytokines as a cause of lung toxicity after combined treatment with gemcitabine and thoracic irradiation[J]. Radiother Oncol, 2004, 72(2): 231-241. DOI:10.1016/j.radonc.2004.05.004 |
| [12] |
谢丛华, 周云峰, 彭纲, 等. 当归调控放射性肺损伤TGF-β1表达水平的研究[J]. 中华放射医学与防护杂志, 2005, 25(2): 143-146. Xie CH, Zhou YF, Peng G, et al. Modulation role of Angelica Sinensis on transforming growth factor beta 1 (TGF-β1) expression induced by radiation in the lung tissue[J]. Chin J Radiol Med Prot, 2005, 25(2): 143-146. DOI:10.3760/cma.j.issn.0254-5098.2005.02.017 |
| [13] |
韩光, 周云峰, 彭敏, 等. 当归调控小鼠放射性肺损伤中ICAM-1表达水平的实验研究[J]. 中华放射肿瘤学杂志, 2007, 16(1): 71-73. Han G, Zhou YF, Peng M, et al. Modulation role of Angelica Sinensis on intercellular cell adhesion molecule-1 (ICAM-1) expression induced by radiation in the lung tissue[J]. Chin J Radiat Oncol, 2007, 16(1): 71-73. DOI:10.3760/j.issn:1004-4221.2007.01.018 |
| [14] |
Khalil N, Bereznay O, Sporn M, et al. Macrophage production of transforming growth factor beta and fibroblast collagen synthesis in chronic pulmonary inflammation[J]. J Exp Med, 1989, 170(3): 727-737. DOI:10.1084/jem.170.3.727 |
| [15] |
Flanders KC. Smad3 as a mediator of the fibrotic response[J]. Int J Exp Pathol, 2004, 85(2): 47-64. DOI:10.1111/j.0959-9673.2004.00377 |
| [16] |
Schnabl B, Kweon YO, Frederick JP, et al. The role of Smad3 in mediating mouse hepatic stellate cell activation[J]. Hepatology, 2001, 34(1): 89-100. DOI:10.1053/jhep.2001.25349 |
| [17] |
胡凯, 岳海英, 刘文其, 等. 肿节风在小型猪放射性肺损伤过程中对TGF-β1/Smads表达水平的影响[J]. 中华放射医学与防护杂志, 2016, 36(3): 178-185. Hu K, Yue HY, Liu WQ, et al. Effect of Sarcandra Glabra on the expression of TGF-β1/Smads in miniature pig of radiation-induced lung injury[J]. Chin J Radiol Med Prot, 2016, 36(3): 178-185. DOI:10.3760/cma.j.issn.0254-5098.2016.03.004 |
| [18] |
Huang CY, Lee CY, Chen MY, et al. Stromal cell-derived factor-1/CXCR4 enhanced motility of human osteosarcoma cells involves MEK1/2, ERK and NF-kappaB-dependent pathways[J]. J Cell Physiol, 2009, 221(1): 204-212. DOI:10.1002/jcp.21846 |
| [19] |
Guo T, Zou L, Ni J, et al. Regulatory T cells: an emerging player in radiation-induced lung injury[J]. Front Immunol, 2020, 11: 1769. DOI:10.3389/fimmu.2020.01769 |
| [20] |
Suzuki Y, Tanigaki T, Heimer D, et al. TGF-beta 1 causes increased endothelial ICAM-1 expression and lung injury[J]. J Appl Physiol (1985), 1994, 77(3): 1281-1287. DOI:10.1152/jappl.1994.77.3.1281 |
| [21] |
Boothe DL, Coplowitz S, Greenwood E, et al. Transforming growth factor β-1 (TGF-β1) is a serum biomarker of radiation induced fibrosis in patients treated with intracavitary accelerated partial breast irradiation: preliminary results of a prospective study[J]. Int J Radiat Oncol Biol Phys, 2013, 87(5): 1030-1036. DOI:10.1016/j.ijrobp.2013.08.045 |
| [22] |
Yang HJ, Youn H, Seong KM, et al. Psoralidin, a dual inhibitor of COX-2 and 5-LOX, regulates ionizing radiation (IR)-induced pulmonary inflammation[J]. Biochem Pharmacol, 2011, 82(5): 524-534. DOI:10.1016/j.bcp.2011.05.027 |
| [23] |
Kiyohara H, Ishizaki Y, Suzuki Y, et al. Radiation-induced ICAM-1 expression via TGF-β1 pathway on human umbilical vein endothelial cells; comparison between X-ray and carbon-ion beam irradiation[J]. J Radiat Res, 2011, 52(3): 287-292. DOI:10.1269/jrr.10061 |
| [24] |
Liu T, Zhang L, Joo D, et al. NF-κB signaling in inflammation[J]. Signal Transduct Target Ther, 2017, 2: 17023-17023. DOI:10.1038/sigtrans.2017.23 |
| [25] |
Giuranno L, Ient J, De Ruysscher D, et al. Radiation-induced lung injury (RILI)[J]. Front Oncol, 2019, 9: 877. DOI:10.3389/fonc.2019.00877 |
 2022, Vol. 42
2022, Vol. 42


