2. 中国人民解放军军事科学院军事医学研究院生命组学研究所,北京 100850
2. Beijing Institute of Lifeomics, Academy of Military Sciences, Beijing 100850, China
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)是治疗恶性血液病和部分良性血液病的最有效方法之一,但其疗效受到移植相关并发症的限制,其中急性移植物抗宿主病(acute graft-versus-host disease, aGVHD)是allo-HSCT最严重的并发症之一,同时也是造成患者移植后死亡的主要原因之一[1-2]。皮质类固醇激素是aGVHD的一线治疗方案,但是其最佳应答率仅为40%~60%,一旦发展为类固醇抵抗型移植物抗宿主病(SR-aGVHD),患者的预后将明显变差[3-5]。目前二线治疗方案的选择依然非常有限,且完全缓解率仅为30%左右[6-7]。因此,迫切需要探索新的aGVHD调控分子,为aGVHD预防和治疗提供新靶点。
去泛素化酶BRCC3是BRISC复合体的核心组分,BRISC可以通过控制NLRP3的去泛素化进而调节NLRP3炎症小体的组装[8]。在aGVHD小鼠模型中,特异性敲除NLRP3可以有效减轻aGVHD[9]。BRISC可以稳定JAK2通路[10],而靶向JAK1/2通路的抑制剂芦可替尼已经被证明可以有效减轻aGVHD[11-12]。这些研究表明BRCC3可能是调控aGVHD的重要分子。本研究评估了在aGVHD小鼠模型中,BRCC3的敲除对aGVHD的作用,为aGVHD的靶向药物开发提供新思路。
材料与方法1. 实验动物及移植条件:BRCC3敲除小鼠由本研究团队以C57BL/6J为背景制备。BABL/c雄性小鼠,8~10周龄,购自于北京斯贝福生物技术有限公司,许可证号:SCXK(京)2019-0010。所有小鼠均保持在无特定病原体和控制温、湿度的微隔离笼中,12 h光/暗循环。所有动物实验均通过军事医学研究院实验动物管理和使用委员会的审查和批准(IACUC-DWZX-2021-749)。探究受体BRCC3的缺失对aGVHD小鼠的作用时,C57BL/6J为背景的受体小鼠共12只分为野生型(WT)和BRCC3-/-型(KO),WT和KO小鼠经4.5 Gy + 4.5 Gy 60Co(军事科学院军事医学研究院钴源放射中心)全身照射(TBI),即给予第1次4.5 Gy剂量的TBI后,让小鼠休息30 min,再给予第2次4.5 Gy剂量的TBI。于照射后6 h通过尾静脉移植BALB/c小鼠1×107个骨髓细胞和8×106个脾脏细胞。进行反向移植时将WT或KO小鼠的脾脏细胞与骨髓细胞悬液移植到经6.5 Gy TBL的BABL/c小鼠体内。
2.仪器与试剂:Rabbit monoclonal anti-BRCC3抗体购自美国CST公司;RPMI 1640购自美国GIBCO公司;红细胞裂解液购自美国Biolegend公司;胎牛血清(FBS)购自美国ExCellBio公司;多聚甲醛购自武汉塞维尔生物技术公司;Percoll购自美国Cytive公司;IL-1β ELISA试剂盒及IL-18 ELISA试剂盒购自美国Abcam公司;Th1/Th2/Th17 CBA试剂盒购自美国BD公司;流式抗体Anti-mouse H2-Kb、Anti-mouse H2-Kd购自美国BD公司;Anti-mouse CD4、Anti-mouse CD8、Anti-mouse CD25、Anti-mouse CD69及Anti-mouse Foxp3购自美国Biolegend公司。流式细胞仪LSRFortessa型购自美国BD公司;倒置荧光显微镜购自日本Olympus公司;高通量组织研磨器SCIENTZ-48型购自宁波新芝公司。
3. Western blot:取适量肝脏和小肠组织放入装有500 μl直接裂解液的1.5 ml EP管中,置于组织研磨器中研磨,冰上裂解15 min,12 000 r/min,离心半径8.6 cm,离心10 min,沸水浴15 min,进行SDS-PAGE凝胶电泳。5%脱脂牛奶室温封闭1 h,BRCC3和GAPDH抗体4℃过夜孵育,用1×等渗盐吐温缓冲液(TBST)洗涤4次,每次6 min;室温下二抗摇床孵育1 h,1×TBST洗3次,每次7 min;暗室显影。
4. 小鼠肝脏淋巴细胞的分离:颈脱臼处死小鼠,取出新鲜的肝脏组织,剪碎,在40 μm细胞过滤器上研磨过滤至50 ml管中。4℃,50×g离心5 min,取上清,弃沉淀。补加2% FBS的RPMI 1640至40 ml,4℃,800×g离心7 min,弃上清。补加2% FBS的RPMI 1640至45 ml,4℃,800×g离心7 min,弃上清。加入7 ml 35% percoll溶液,重悬并吹打均匀,将重悬液斜着缓缓加入装有7 ml 75% Percoll的15 ml离心管中,可以看到溶液分为两层。室温下800 × g离心30 min,转速设置为快升缓降。离心结束后可以看到分3层,用1 ml移液器小心吸取中间层细胞于新的15 ml管中,补加2%FBS的RPMI 1640至15 ml。4℃,800 × g离心5 min,弃上清。用1 ml 2% FBS的RPMI 1640重悬并转移至1.5 ml EP管中,室温下2 000 r/min,离心半径8.6 cm,离心5 min,弃上清。加入300 μl 1×红细胞裂解液,室温裂解5 min,加入1 ml含2%FBS的磷酸盐缓冲液(PBS)终止裂红。室温下2 000 r/min,离心半径8.6 cm,离心5 min,弃上清。加入1 ml含2%FBS的PBS重悬,计数,流式抗体标记及检测。
5. 小鼠小肠淋巴细胞的分离:颈脱臼处死小鼠,完整取出小肠,置于预冷的PBS中。使用带灌胃针的注射器,用预冷的PBS冲洗肠道内壁,纵向切开肠管。将小肠横切成5~10 mm小块,置于含有25 ml 37℃预热的10% FBS RPMI 1640的50 ml管中。将二硫苏糖醇(DTT)添加到含有肠片的培养基中,其最终浓度为1 mmol/L。室温持续振荡孵育40 min。室温下500 × g离心5 min,弃上清。加入10 ml预热的10%RPMI 1640,中速涡旋5 min。研磨通过100 μm细胞过滤器,收集到50 ml管中。室温下500 × g离心5 min,弃上清。加入7 ml 35% Percoll溶液,重悬并吹打均匀,加入装有7 ml 75% Percoll的15 ml管中,可以看到溶液分为两层。室温下700 × g离心30 min,转速设置为快升缓降。离心结束后可以看到分5层,取中间层细胞于新的15 ml管中,补预热的10%RPMI 1640至15 ml,室温下700 × g离心5 min,弃上清。1 ml PBS重悬,40 μm细胞过滤器过滤。计数,流式抗体标记及检测。
6.血清中细胞因子水平:收集小鼠外周血至1.5 ml EP管中,4℃静置过夜,室温2 000 r/min,离心半径8.6 cm,离心20 min,吸取上清,于-80℃冻存备用。采用细胞因子微球检测技术(CBA),按照TH1/TH2/TH17 CBA试剂盒操作说明书,处理血清样本,使用流式细胞仪对样本中白介素(IL)、肿瘤坏死因子(TNF)、γ干扰素(IFN-γ)的水平进行测定,数据使用FCAP ArrayTM对数据进行分析。按照ELISA试剂盒操作说明书对血清样本中IL-18、IL-1β水平进行测定。
7.流式抗体的标记:细胞膜上流式抗体的标记,用80 ~100 μl PBS重悬待测细胞,将目标抗体加入样本中,室温避光标记15 min。加入1 ml PBS洗涤未标记上的抗体,室温下600 × g离心5 min,弃上清后加入350 μl PBS重悬细胞上机检测。细胞核内流式抗体的标记,细胞膜上流式抗体标记完成后,按照破核膜试剂盒说明书对待测细胞进行透膜,透膜后加入Foxp3流式抗体,4℃避光标记40 min。加入1 ml PBS洗涤未标记上的抗体,室温下600 × g离心5 min,弃上清后加入350 μl PBS重悬细胞上机检测。
8.统计学处理:流式数据使用FlowJoV10软件对流式数据进行分析,使用GraphPad Prism 7.00软件对其他数据进行处理和分析。计量资料符合正态分布,数据用x ±s表示。采用非配对t检验比较两组之间的差异,生存率差异采用Log-Rank检验。P < 0.05为差异有统计学意义。
结果1. BRCC3敲除小鼠的鉴定:在肝脏和小肠中检测BRCC3蛋白的表达情况,结果显示,在WT小鼠肝脏和小肠中,BRCC3高水平表达,KO小鼠中则检测不到BRCC3蛋白的表达(图 1),表明BRCC3-/-小鼠中BRCC3基因被成功敲除。

|
注:1. WT小鼠肝脏组织;2. WT小鼠小肠组织;3. KO小鼠肝脏组织;4.KO小鼠小肠组织 图 1 Western blot检测WT和KO小鼠肝脏和小肠组织中BRCC3的表达 Figure 1 Western blot assay for the expression of BRCC3 in liver and small intestine of WT and KO mice |
2.BRCC3在受体小鼠中的缺失导致aGVHD受体小鼠的生存率明显下降:生存分析结果显示,BRCC3-/-小鼠的生存期明显缩短(P < 0.05),在移植后50 d,WT受体小鼠仍有50%存活,而BRCC3-/-受体小鼠仅有10%存活;WT受体小鼠的中位生存期为44 d,BRCC3-/-受体小鼠中位生存期仅为7 d,结果表明受体BRCC3敲除导致aGVHD更加严重,图 2。
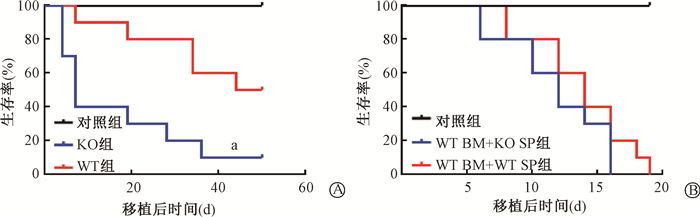
|
注:a与WT组比较,P < 0.05 图 2 aGVHD小鼠模型中供体或受体特异性敲除BRCC3移植后的生存分析 A. BALB/c小鼠作为供体,BRCC3-/-(KO)和野生型(WT)小鼠作为受体,受体小鼠移植1×107骨髓细胞和8×106脾脏细胞,对照组仅移植1×107骨髓细胞;B. KO和WT小鼠作为供体,BALB/c小鼠作为受体,受体小鼠移植WT小鼠1×107骨髓细胞和WT小鼠5×106脾脏细胞,或WT小鼠1×107骨髓细胞和KO小鼠5×106脾脏细胞,对照组仅移植WT小鼠1×107骨髓细胞 Figure 2 Survival analysis of donor or recipient of knockout BRCC3 post-transplantation in aGVHD mouse model A. Kaplan-Meier analysis of the survival of wild-type (WT) and BRCC3-/-(KO) recipient mice transplanted with 1×107BM plus 8×106 splenocytes derived from BALB/c mice. Control group transplanted with 1×107BM only. B.Kaplan-Meier analysis of the survival of BALB/c recipient mice transplanted with WT 1×107BM plus 5×106 KO splenocytes or 1×107 WT BM plus 5×106 WT splenocytes. Control group was transplanted with 1×107 WT BM only |
3. BRCC3在供体T细胞中的缺失不影响aGVHD的发生发展:生存分析结果显示,两组小鼠在移植后第19天全部死亡,中位生存期分别为12和14 d,差异无统计学意义(P>0.05,图 2B),结果表明供体小鼠T细胞中BRCC3的缺失可能不影响aGVHD的发生发展。
4.移植后9 d肝脏病理检测:移植后9 d肝脏组织病理检测结果显示KO组肝脏病理切片可见肝细胞肿大,细胞结构不清,汇管区中央静脉和肝血窦扩张淤血,较重的标本可见肝细胞坏死变性,肝小叶结构被破坏,伴大量淋巴细胞浸润;WT组肝脏的病理损伤明显轻于KO组(图 3)。
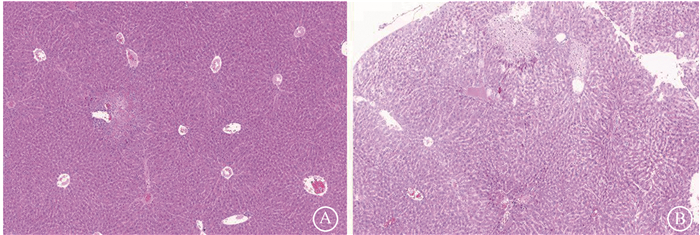
|
图 3 小鼠移植后9 d肝脏病理切片 HE染色 ×15 A. WT小鼠;B. KO小鼠 Figure 3 Pathological sections of mouse liver at 9 d post-transplantation HE staining ×15 A. WT mouse; B. KO mouse |
5. 血清中aGVHD相关细胞因子水平检测:本研究分别检测了移植后第4天和移植后第9天小鼠IL-17A、TNF、IFN-γ、IL-2、IL-18、IL-1β在血清中的水平。结果显示,在移植后第4天KO组血清中IL-18水平明显升高(t=8.43,P < 0.05),第9天KO组血清中TNF和IL-1β水平明显降低(t=3.33、5.47,P < 0.05);其余检测的细胞因子在两组中差异均无统计学意义(P>0.05),见表 1。
|
|
表 1 小鼠移植后不同时间血清中各种细胞因子的水平(pg/ml, x ±s) Table 1 Levels of different cytokines in the serum of mice at different time post-transplantation (pg/ml, x ±s) |
6. 受体BRCC3的缺失促进脾脏中供体CD8+ T细胞增殖活化:供体活化的T细胞是导致靶器官损伤的主要效应细胞,通过流式细胞学技术检测脾脏中供体T细胞的比例以及活化情况。脾脏流式细胞学分析圈门策略如图 4所示,流式结果如表 2所示。WT组和KO组脾脏中供体来源的CD45+细胞数差异无统计学意义(P>0.05);CD4+ T细胞各项检测指标在两组中差异均无统计学意义(P>0.05);KO组供体CD8+ T细胞占供体细胞的比例明显升高,CD8+CD25+ T细胞占供体细胞的比例明显升高(t=6.53、5.52,P < 0.05);Treg(CD4+CD25+Foxp3+)细胞检测在两组中差异无统计学意义(P>0.05)。提示BRCC3在受体小鼠中的缺失促进了供体CD8+ T细胞在脾脏中的增殖与活化。
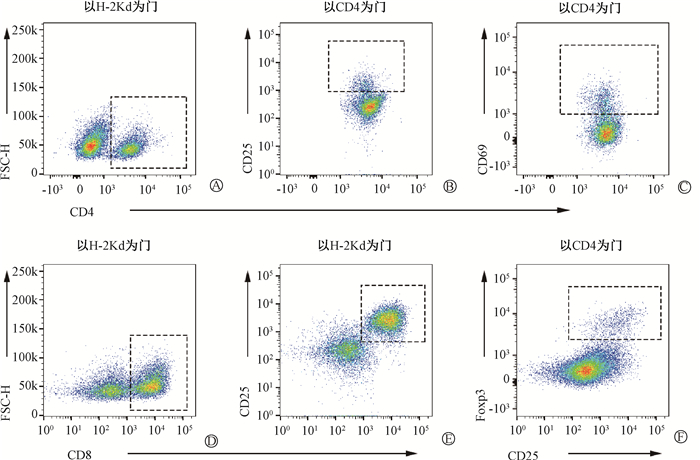
|
图 4 小鼠脾脏流式圈门策略 A. CD4+ T细胞; B. CD4+CD25+ T细胞; C. CD4+CD69+ T细胞; D. CD8+ T细胞; E. CD8+CD25+ T细胞; F. Treg细胞(CD4+CD25+Foxp3+) Figure 4 Flow cytometry gating strategy for mice spleen A. CD4+ T cells; B. CD4+CD25+ T cells; C. CD4+CD69+ T cells; D. CD8+ T cells; E. CD8+CD25+ T cells; F.Treg cells (CD4+CD25+Foxp3+) |
|
|
表 2 小鼠脾脏细胞流式细胞学检测(%, x ±s) Table 2 Flow cytometric analysis of mice splenocytes(%, x ±s) |
7.受体BRCC3的缺失促进供体CD8+ T细胞在肝脏中的浸润和活化:进一步检测了aGVHD的重要靶器官肝脏中供体T细胞的浸润以及活化情况。流式细胞检测结果如表 3所示,供体来源的CD45+细胞数在两组中差异无统计学意义(P>0.05);CD4+ T细胞各项指标在两组中差异均无统计学意义(P>0.05);KO组供体CD8+ T细胞占供体细胞的比例明显升高,CD8+CD25+ T细胞占供体细胞的比例明显升高(t=3.74、3.19,P < 0.05)。结果提示BRCC3在受体小鼠中的缺失促进了供体CD8+ T细胞在肝脏中的浸润和活化。
|
|
表 3 小鼠肝脏淋巴细胞流式细胞学检测(%, x ±s) Table 3 Flow cytometric analysis of mice liver lymphocytes(%, x ±s) |
8. 受体BRCC3的缺失促进供体CD8+ T细胞在小肠中的浸润与活化:小肠淋巴细胞流式检测结果如表 4所示,细胞计数结果显示CD45+细胞在两组中差异无统计学意义(P>0.05);尽管KO组CD4+ T细胞的比例明显降低(t=3.39,P < 0.05),但其CD25的表达和CD4效应T细胞的比例明显升高(t=17.69,P < 0.05);KO组供体CD8+ T细胞占供体细胞的比例明显升高,CD8+CD25+ T细胞和CD8+CD69+ T细胞占供体细胞的比例明显升高(t=3.52、4.06、3.29,P < 0.05)。结果表明,BRCC3在受体小鼠中的缺失主要促进了供体CD8+ T细胞在小肠中的浸润与活化。
|
|
表 4 小鼠小肠淋巴细胞流式细胞学检测(%, x ±s) Table 4 Flow cytometric analysis ofmice small intestine lymphocytes(%, x ±s) |
讨论
本研究发现受体小鼠BRCC3的缺失可导致更严重的aGVHD,表现为生存率明显下降,肝脏病理损伤明显加重,靶器官的供体CD8+ T细胞浸润增加以及供体CD8+ T细胞活化明显上调。以上结果表明,BRCC3是aGVHD重要的调控分子,可能成为aGVHD预防和治疗的新靶点。
本团队前期研究发现,BRISC复合体可以通过去泛素化促进NLRP3炎症小体的激活,抑制BRISC复合体活性可有效减轻NLRP3炎症小体相关疾病的发生[13],而NLRP3炎症小体的敲除和抑制均可以有效减轻aGVHD[8-9],因此推测BRCC3敲除很可能会抵抗aGVHD。令人意外的是,本研究结果显示受体小鼠敲除BRCC3之后,反而加重了aGVHD,这提示BRCC3调节aGVHD可能存在NLRP3以外的作用机制。另一方面,有研究报道,BRCC3参与形成的BRISC复合体可以稳定和激活JAK2通路,而JAK1/JAK2通路的抑制可以有效减轻aGVHD[10-11],但在本研究中特异性敲除供体BRCC3并不影响aGVHD的发生,这说明BRCC3通过JAK2通路调节aGVHD的作用有限。
本研究显示,受体小鼠中敲除BRCC3可导致供体来源的T细胞大量增殖活化。文献报道IL-17A、TNF、IFN-γ、IL-2、IL-18、IL-1β等细胞因子的上调可以加重aGVHD[14]。本研究结果显示,只有IL-18在KO组血清中的水平明显高于WT组。有研究表明IL-18的升高可以促进CD8效应T细胞的植入而加重GVHD,IL-18还可以阻止Tregs对GVHD的抑制作用[15];另外,在小鼠肿瘤模型中,IL-18在肿瘤中CD8+T细胞中大量富集可以激活T细胞进而增强抗肿瘤免疫[16]。这些研究结果提示BCRR3敲除受体小鼠GVHD模型中CD8+ T细胞的增殖活化可能与IL-18的上调有关。此外,有研究报道其他多种细胞因子如IL-4、转化生长因子β(TGF-β)、IL-21、IL-12、IL-10等以及转录因子T-bet、RORct、RORa、IRF4等在CD8+ T细胞增殖活化中发挥重要作用[17],那么BRCC3敲除是否导致多种其他细胞因子及重要分子的改变,需要进一步的确认。值得注意的是,以往的研究表明BRCC3的缺失可以影响DNA损伤修复[18],提示BRCC3可能影响了小鼠的放射敏感性。因此,深入探索BRCC3敲除导致GVHD加重的分子机制研究,可能会揭示BRCC3的新功能。
综上所述,本研究发现aGVHD小鼠模型中受体BRCC3的缺失促进了供体CD8+ T细胞在靶器官的浸润与活化,使aGVHD明显加重。本研究为进一步探索BRCC3调节aGVHD的机制奠定了基础,也为预防和治疗aGVHD靶向药物的研发提供了新的潜在靶点。
利益冲突 无
作者贡献声明 李欣负责实验操作和论文撰写;赵珂参与实验操作和论文修改;孙慧颖参与实验操作;任广明、高慧英指导论文修改;李长燕、宁红梅提供研究思路和指导论文修改
| [1] |
Zeiser R, Blazar BR. Acute Graft-Versus-Host Disease-biologic process, prevention, and therapy[J]. N Engl J Med, 2017, 377(22): 2167-2179. DOI:10.1056/NEJMra1609337 |
| [2] |
Nassereddine S, Rafei H, Elbahesh E, et al. Acute graft versus host disease: a comprehensive review[J]. Anticancer Res, 2017, 37(4): 1547-1555. DOI:10.21873/anticanres.11483 |
| [3] |
Macmillan ML, Weisdorf DJ, Wagner JE, et al. Response of 443 patients to steroids as primary therapy for acute graft-versus-host disease: comparison of grading systems[J]. Biol Blood Marrow Transplant, 2002, 8(7): 387-394. DOI:10.1053/bbmt.2002.v8.pm12171485 |
| [4] |
Macmillan ML, Robin M, Harris AC, et al. A refined risk score for acute graft-versus-host disease that predicts response to initial therapy, survival, and transplant-related mortality[J]. Biol Blood Marrow Transplant, 2015, 21(4): 761-767. DOI:10.1016/j.bbmt.2015.01.001 |
| [5] |
Westin JR, Saliba RM, De Lima M, et al. Steroid-refractory acute GVHD: predictors and outcomes[J]. Adv Hematol, 2011, 2011: 601953. DOI:10.1155/2011/601953 |
| [6] |
Hill L, Alousi A, Kebriaei P, et al. New and emerging therapies for acute and chronic graft versus host disease[J]. Ther Adv Hematol, 2018, 9(1): 21-46. DOI:10.1177/2040620717741860 |
| [7] |
Malard F, Huang XJ, Sim J. Treatment and unmet needs in steroid-refractory acute graft-versus-host disease[J]. Leukemia, 2020, 34(5): 1229-1240. DOI:10.1038/s41375-020-0804-2 |
| [8] |
Py BF, Kim MS, Vakifahmetoglu-Norberg H, et al. Deubiquitination of NLRP3 by BRCC3 critically regulates inflammasome activity[J]. Mol Cell, 2013, 49(2): 331-338. DOI:10.1016/j.molcel.2012.11.009 |
| [9] |
Jankovic D, Ganesan J, Bscheider M, et al. The Nlrp3 inflammasome regulates acute graft-versus-host disease[J]. J Exp Med, 2013, 210(10): 1899-1910. DOI:10.1084/jem.20130084 |
| [10] |
Donaghy R, Han X, Rozenova K, et al. The BRISC deubiquitinating enzyme complex limits hematopoietic stem cell expansion by regulating JAK2 K63-ubiquitination[J]. Blood, 2019, 133(14): 1560-1571. DOI:10.1182/blood-2018-10-877563 |
| [11] |
Spoerl S, Mathew NR, Bscheider M, et al. Activity of therapeutic JAK 1/2 blockade in graft-versus-host disease[J]. Blood, 2014, 123(24): 3832-3842. DOI:10.1182/blood-2013-12-543736 |
| [12] |
Carniti C, Gimondi S, Vendramin A, et al. Pharmacologic inhibition of JAK1/JAK2 signaling reduces experimental murine acute GVHD while preserving GVT effects[J]. Clin Cancer Res, 2015, 21(16): 3740-3749. DOI:10.1158/1078-0432.CCR-14-2758 |
| [13] |
Ren GM, Li J, Zhang XC, et al. Pharmacological targeting of NLRP3 deubiquitination for treatment of NLRP3-associated inflammatory diseases[J]. Sci Immunol, 2021, 6(58): eabe2933. DOI:10.1126/sciimmunol.abe2933 |
| [14] |
Hill GR, Koyama M. Cytokines and costimulation in acute graft-versus-host disease[J]. Blood, 2020, 136(4): 418-428. DOI:10.1182/blood.2019000952 |
| [15] |
Carroll RG, Carpenito C, Shan X, et al. Distinct effects of IL-18 on the engraftment and function of human effector CD8 T cells and regulatory T cells[J]. PLoS One, 2008, 3(9): e3289. DOI:10.1371/journal.pone.0003289 |
| [16] |
Zhou T, Damsky W, Weizman OE, et al. IL-18BP is a secreted immune checkpoint and barrier to IL-18 immunotherapy[J]. Nature, 2020, 583(7817): 609-614. DOI:10.1038/s41586-020-2422-6 |
| [17] |
Mittrucker HW, Visekruna A, Huber M. Heterogeneity in the differentiation and function of CD8(+) T cells[J]. Arch Immunol Ther Exp (Warsz), 2014, 62(6): 449-458. DOI:10.1007/s00005-014-0293-y |
| [18] |
Rabl J, Bunker RD, Schenk AD, et al. Structural basis of BRCC36 function in DNA repair and immune regulation[J]. Mol Cell, 2019, 75(3): 483-497. DOI:10.1016/j.molcel.2019.06.002 |
 2022, Vol. 42
2022, Vol. 42


