宫颈癌是一种常见的妇科肿瘤,根据美国癌症学会公布的2020年全球恶性肿瘤数据,宫颈癌发病率在全部恶性肿瘤中排名第9位,其发病率和死亡率在女性恶性肿瘤中均排名第4位[1]。在中国,宫颈癌发病率在所有恶性肿瘤中排名第8位[2]。新版国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期将淋巴结转移情况纳入分期标准[3-4],Ⅲ期分为ⅢA、ⅢB、ⅢC1、ⅢC2期,对于Ⅲ期患者,许多指南与专家共识推荐根治性放疗联合同步含铂类化疗作为主要治疗,但在临床上,仍有很多Ⅲ期患者选择以手术为主的治疗。本研究通过比较两种不同方案治疗Ⅲ期宫颈癌患者的不良反应及预后,为临床选择治疗方案提供参考。
资料与方法1. 病例资料:回顾性收集2010年1月至2020年12月苏州大学附属第一医院收治的FIGO2018分期为Ⅲ期宫颈癌患者的临床资料。纳入标准:①病理确诊为宫颈鳞癌、腺癌或腺鳞癌的患者。②初治患者,临床资料完整。③2018FIGO分期为Ⅲ期。④治疗方法为宫颈癌根治术+放疗±化疗或根治性放疗±化疗。排除标准:①病理确诊为小细胞癌、神经内分泌癌、未分化癌等少见病理学类型。②阴道、外阴、子宫内膜来源的转移性宫颈癌。③合并其他恶性肿瘤。排除失访、因其他疾病或不明原因死亡的患者,共纳入194例。194例患者的年龄为22~83岁,中位年龄51岁。ⅢA期16例,ⅢB期23例,ⅢC1期136例,ⅢC2期19例。本研究已获得苏州大学附属第一医院医学伦理委员会认证,审批号(2022)伦研批第016号。所有患者均已签署治疗相关知情同意书。
2. 放疗:81例患者行根治性放疗。采用适形放疗和调强放疗,采用CT模拟定位,基本靶区勾画。大体肿瘤区(gross tumor volume, GTV)为肉眼或影像学所见肿瘤病灶。临床靶区(clinical target volume, CTV)为子宫、宫颈、宫旁、阴道上1/2(如肿瘤侵犯阴道上1/3,包括上2/3阴道;如侵犯阴道上1/2及以上,包括整个阴道)以及宫旁、髂内、髂外、闭孔、髂总及骶前盆腔淋巴引流区,腹主动脉旁淋巴结视具体情况选择性勾画该区域。危及器官为小肠、膀胱、直肠、股骨头、脊髓等。外照射总剂量为45~50 Gy,1.8~2 Gy/次,盆腹腔阳性淋巴结区可增加10~15 Gy。后装治疗采用铱192作为照射源,A点剂量为25~30 Gy,按2 Gy分次等效总剂量≥87 Gy,具体放疗方案根据患者自身情况调整。
3. 化疗与手术:184例患者接受紫杉醇+铂类方案化疗,1例患者采用紫杉醇单药化疗,化疗1~8个周期,中位化疗周期数为4次。103例患者采用紫杉醇类或铂类单药同步周化疗,周化疗1~8次,中位5次。113例患者接受宫颈癌根治术,根治术包括广泛全子宫与双附件切除、盆腔淋巴结清扫,视情况行阴道部分切除和腹主动脉旁淋巴结切除。
4. 分组:194例患者按照治疗方案分为根治性放疗±化疗组(81例)和根治术+放疗±化疗组(113例)。81例根治性放疗±化疗组患者中,74例患者接受紫杉醇类+铂类方案化疗,45例患者在放疗时接受紫杉醇类或铂类方案的同步化疗。113例根治术+放疗±化疗组患者中,110例患者接受紫杉醇类+铂类方案化疗,1例接受单药紫杉醇方案化疗,58例接受紫杉醇类或铂类方案的同步化疗。
5. 观察指标和随访:记录各组患者的不良反应,包括血常规、血生化、直肠黏膜炎、非感染性膀胱炎、阴道瘘、肠梗阻等相关指标,根据美国卫生和公共服务部发布的常见不良反应术语评定标准5.0版对其进行分级。随访患者的生存和疾病进展情况,总生存时间(overall survival,OS)的定义为开始治疗至患者死亡或随访截至时间,无进展生存时间(progression-free survival,PFS)的定义为开始治疗至疾病进展或患者死亡。采用电话和门诊复查相结合的方式对患者进行随访,所有患者随访至2021年12月,随访时间为13~143个月,中位随访时间为49个月。
6. 统计学处理:采用SPSS 26.0软件进行统计学分析,数据以例数表示,采用χ2检验比较不同治疗组之间不良反应发生率的差异。采用Kaplan-Meier法进行生存分析,并行Log rank检验,用Graphpad prism 8.0软件绘制生存曲线。P<0.05为差异有统计学意义。
结果1. 不良反应分析:194例不同治疗方式Ⅲ期宫颈癌患者的不良反应主要包括血液学不良反应、肝肾功能异常以及消化道反应等(表 1)。根治性放疗±化疗组患者更容易发生3~4级血红蛋白下降(χ2=10.68,P=0.004)、直肠黏膜炎(χ2=14.41,P=0.001)以及阴道瘘(χ2=7.16,P=0.012)。根治术+放疗±化疗组患者更容易出现天门冬氨酸氨基转移酶(χ2=10.96,P=0.002)和丙氨酸氨基转移酶(χ2=8.49,P=0.010)升高。
|
|
表 1 194例不同治疗方式Ⅲ期宫颈癌患者的不良反应发生情况 Table 1 Incidence of adverse reactions of 194 cervical cancer patients with stage Ⅲ cervical cancer in different treatment groups |
对136例ⅢC1期患者进行分析的结果显示,根治性放疗±化疗组患者更容易发生直肠黏膜炎(χ2=13.25,P=0.003),根治术+放疗±化疗组患者更容易出现天门冬氨酸氨基转移酶升高(χ2=6.18,P=0.046),见表 2。
|
|
表 2 136例不同治疗方式ⅢC1期宫颈癌患者的不良反应发生情况 Table 2 Incidence of adverse reactions of 136 cervical cancer patients with stage ⅢC1 cervical cancer in different treatment groups |
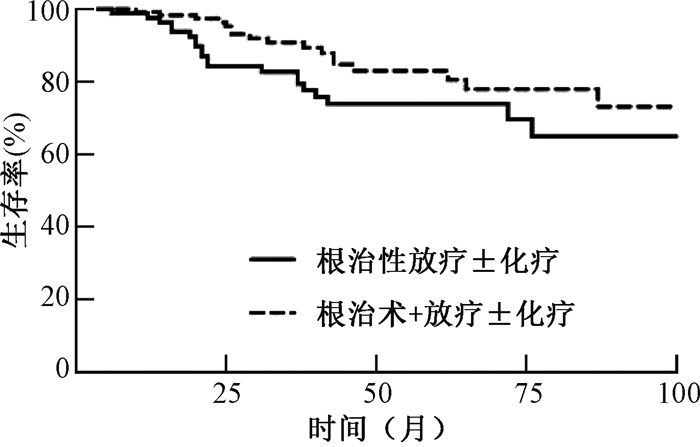
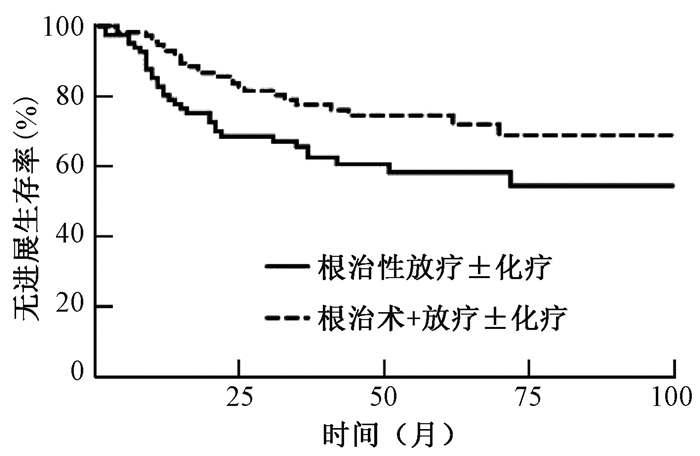
2. 预后分析:194例患者的生存时间为6~143个月,中位生存时间为41个月。根治性放疗±化疗组和根治术+放疗±化疗组分别有20(24.7%)和17(15.0%)例患者死亡,32(39.5%)和27(23.9%)例患者疾病进展。根治性放疗±化疗组和根治术+放疗±化疗组患者的5年生存率分别为73.8%和82.9%,差异无统计学意义(χ2=2.77,P=0.096),见图 1;5年无进展生存率分别为58.3%和74.5%(χ2=5.33,P=0.021),见图 2。39例ⅢA和ⅢB期患者均为根治性放疗±化疗组患者,有13例(33.3%)例患者死亡,17例(43.6%)患者疾病进展,5年生存率为65.9%,5年无进展生存率为54.9%。
|
图 1 194例不同治疗方式Ⅲ期宫颈癌患者的生存曲线 Figure 1 Survival curves of patients with stage Ⅲ cervical cancer |
|
图 2 194例不同治疗方式Ⅲ期宫颈癌患者的无进展生存曲线 Figure 2 Progression-free survival curves of patients with stage Ⅲ cervical cancer |
136例ⅢC1期患者的生存时间为14~143个月,中位生存时间为44.5个月。根治性放疗±化疗组和根治术+放疗±化疗组分别有5(14.7%)和13(12.7%)例患者死亡,有11(32.4%)和22(21.6%)例患者疾病进展。根治性放疗±化疗组和根治术+放疗±化疗组患者的5年生存率分别为85.5%和86.3%,差异无统计学意义(P=0.893)。5年无进展生存率分别为65.6%和77.1%,差异无统计学意义(P=0.244)。
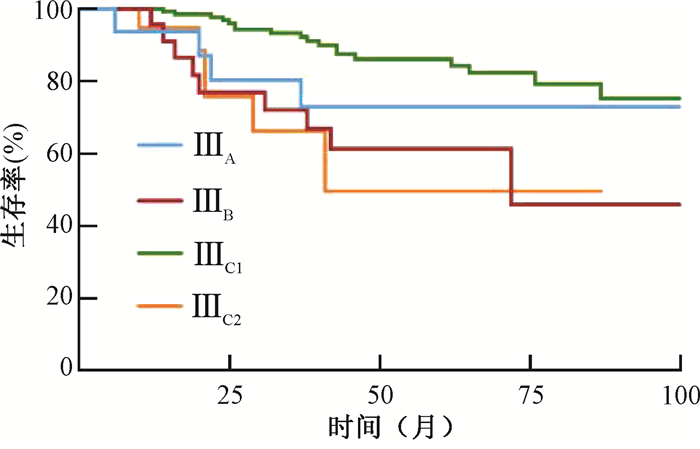
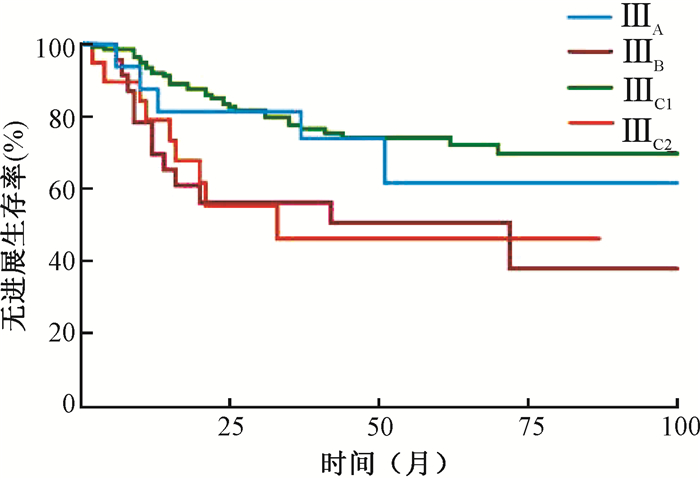
ⅢA、ⅢB、ⅢC1和ⅢC2期患者的5年生存率分别为73.1%、61.4%、86.2%和49.7%,差异有统计学意义(χ2=16.15,P=0.001),见图 3;5年无进展生存率分别为61.6%、50.6%、74.0%和46.1%,差异有统计学意义(χ2=14.08,P=0.003),见图 4。ⅢC1期患者的5年生存率和5年无进展生存率均高于ⅢB患者(χ2=10.45,P=0.001;χ2=9.06,P=0.003)和ⅢC2期患者(χ2=12.46,P < 0.001;χ2=8.62,P=0.003)。
|
图 3 不同分期Ⅲ期宫颈癌患者的生存曲线 Figure 3 Survival curves of patients with different stages of cervical cancer |
|
图 4 不同分期Ⅲ期宫颈癌患者的无进展生存曲线 Figure 4 Progression-free survival curves of patients with different stages of cervical cancer |
讨论
临床上一般推荐Ⅲ期宫颈癌患者行根治性放疗+同步含铂类化疗,有多项研究证明可使其生存获益[5-6],美国国家综合癌症网(National Comprehensive Cancer Network,NCCN)指南也将其作为Ⅲ期宫颈癌的标准治疗[7]。但临床结果显示,部分患者诊断为Ⅲ期后仍首先选择手术治疗,对于手术和放疗为主的不同治疗方案带来的生存效益以及不良反应的争议,也一直存在。
在对194例患者的不良反应分析中,根治性放疗±化疗组相较根治术+放疗±化疗组更容易发生更高级别的血红蛋白下降、直肠黏膜炎、阴道瘘,而根治术+放疗±化疗组更容易发生更高级别的天门冬氨酸氨基转移酶和丙氨酸氨基转移酶升高。根治性放疗±化疗组和根治术+放疗±化疗组患者的5年生存率和5年无进展生存率的差异均无统计学意义,但是根治性放疗±化疗组较根治术+放疗±化疗组更容易发生进展。那么,这是否意味着Ⅲ期患者更适合根治术+放疗±化疗的治疗模式呢,为此,本研究的194例患者中,ⅢC1期患者有136例,其生存和进展情况均优于ⅢB期。39例ⅢA期和ⅢB期患者全部接受根治性放疗±化疗方案,其中17例发生进展,13例死亡,考虑这些患者局部进展明显,一般情况差,因此可能会拉低根治性放疗±化疗组患者的生存率和无进展生存率。由于ⅢA期、ⅢB期患者病例数少且组间分布不均衡,本研究未进行进一步比较。而在Fanfani等[8]的一项回顾性分析中,ⅢA期和ⅢB期患者接受放化疗+根治性手术与根治性放化疗相比无病生存时间和总生存时间差异均无统计学意义。ⅢC2期患者的生存与进展情况也劣于ⅢC1期,为尽量减少分期带来的偏倚,本研究没有对其行进一步分析。Kesic等[9]研究表明,对于主动脉旁淋巴结阳性的ⅠB期患者,即2018FIGO分期ⅢC2期患者,采取手术和放疗相结合的治疗,会使并发症种类和发生率增加,导致随后的发病率高于单独使用任意一种方式。在ⅢC1期患者中,两组不良反应差异与总体患者的分析类似,但是两组进展情况的差异不复存在。Darus等[10]针对旧版FIGO分期ⅠB期患者的回顾性队列研究显示,放化疗组出现更多的胃肠道不良反应,但是与放化疗+子宫切除术组相比差异无统计学意义,两组患者生存差异也同样无统计学意义。Cetina等[11]针对80例旧版ⅠB2~ⅡB期宫颈癌患者的匹配性回顾研究显示,接受根治性放化疗的患者有更多的慢性直肠炎,而接受根治术和放疗的患者则更多发生手术和肾积水的急性并发症。两组的总生存时间和无进展生存时间相同。这些报告都与本研究结果类似,但是由于分期标准和手术方式的差异,参考价值相应降低。Hsu等[12]对既往进行手术或放疗的旧版FIGOⅠB、ⅡA期宫颈癌患者进行问卷调查,结果显示,根治性手术组更易出现盆腔神经功能障碍,根治性放疗组更容易出现肠道功能障碍,而两组患者的长期生活质量相似。遗憾的是,手术联合放疗的患者被该研究排除在外。Cohen等[13]等认为,Ⅱ~ⅣA期宫颈癌的标准治疗应为根治性放疗,因为手术无法治愈,根治性手术结合放化疗将导致不良事件和慢性病发生的风险增加。为减少联合治疗导致的并发症,一些专家主张行腹腔镜下淋巴结切除术来识别淋巴结转移,从而避免根治性手术[14]。2020年有研究报告了根治性子宫切除术应用于术中检测到阳性淋巴结的宫颈癌患者的治疗结局,提示根治性子宫切除术并不能改善淋巴结转移阳性宫颈癌患者的肿瘤学结局;不论肿瘤大小,肿瘤类型或其他风险因素如何,均无研究亚组患者在根治性子宫切除术中获益,建议如果术中发现淋巴结转移,应考虑放弃进一步的根治性手术,并应转诊患者进行根治性放疗(化疗)[15]。如今,影像学技术的发展使影像学诊断淋巴结转移的准确性越来越高,Luo等[16]在一项回顾性研究中发现,MRI联合CT诊断ⅠA~ⅠB期宫颈癌淋巴结转移的敏感性、特异性和诊断符合率高达78.13%、87.50%和83.75%,诊断ⅡA~ⅡB期早期宫颈癌淋巴结转移的敏感性、特异性和诊断符合率高达91.66%、82.81%和88.13%。因此,现在可以应用影像学手段充分评估,从而避免淋巴结阳性患者行根治性手术。此外,对于肥胖、高龄或有严重合并症的患者来说,放疗更易实施,可以避免麻醉、疤痕以及医源性死亡的风险。对于因经济原因无法负担手术费用的患者来说,放疗也具有价格上的优势。
在194例患者的分析中,两组患者各倾向于发生不同的不良反应,并无突出的优势,但是根治性放疗±化疗组患者的无进展生存情况差于根治术+放疗±化疗组,这个结果考虑为ⅢA期、ⅢB期患者在组间分布不均衡所致。单独对ⅢC1期患者进行分析,发现两组不良反应与全部患者的分析结果类似,但是组间进展差异消失。考虑手术所带来的一定风险和经济负担,更推荐ⅢC1期患者行根治性放化疗。对于ⅢA、ⅢB、ⅢC2期患者,需要进一步的探索来推荐合适的治疗方案。
本研究的局限性在于为回顾性研究,随机纳入符合条件的病例,虽符合临床实际情况,但是样本的分期不均衡,大部分为ⅢC1期患者,两种治疗组的人数差异也较大,这些都会对结果产生一定程度的偏倚,因此,还需更大样本量、多中心的研究行进一步探索。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 袁晨阳负责设计和实施研究、采集与分析数据、论文撰写;周菊英指导研究和论文修改
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Bhatla N, Berek JS, Cuello Fredes M, et al. Revised FIGO staging for carcinoma of the cervix uteri[J]. Int J Gynaecol Obstet, 2019, 145(1): 129-135. DOI:10.1002/ijgo.12749 |
| [4] |
Corrigendum to "Revised FIGO staging for carcinoma of the cervix uteri" [J]. Int J Gynaecol Obstet, 2019, 147(2): 279-280. DOI: 10.1002/ijgo.12969.
|
| [5] |
Monk BJ, Tewari KS, Koh WJ. Multimodality therapy for locally advanced cervical carcinoma: state of the art and future directions[J]. J Clin Oncol, 2007, 25(20): 2952-2965. DOI:10.1200/JCO.2007.10.8324 |
| [6] |
Gaffney DK, Erickson-Wittmann BA, Jhingran A, et al. ACR appropriateness criteria® on advanced cervical cancer expert panel on radiation oncology-gynecology[J]. Int J Radiat Oncol Biol Phys, 2011, 81(3): 609-614. DOI:10.1016/j.ijrobp.2010.11.005 |
| [7] |
Koh WJ, Abu-Rustum NR, Bean S, et al. Cervical cancer, Version 3.2019, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2019, 17(1): 64-84. DOI:10.6004/jnccn.2019.0001 |
| [8] |
Fanfani F, Vizza E, Landoni F, et al. Radical hysterectomy after chemoradiation in FIGO stage Ⅲ cervical cancer patients versus chemoradiation and brachytherapy: complications and 3-years survival[J]. Eur J Surg Oncol, 2016, 42(10): 1519-1525. DOI:10.1016/j.ejso.2016.05.011 |
| [9] |
Kesic V. Management of cervical cancer[J]. Eur J Surg Oncol, 2006, 32(8): 832-837. DOI:10.1016/j.ejso.2006.03.037 |
| [10] |
Darus CJ, Callahan MB, Nguyen QN, et al. Chemoradiation with and without adjuvant extrafascial hysterectomy for IB2 cervical carcinoma[J]. Int J Gynecol Cancer, 2008, 18(4): 730-735. DOI:10.1111/j.1525-1438.2007.01095.x |
| [11] |
Cetina L, Garcia-Arias A, Candelaria M, et al. Brachytherapy versus radical hysterectomy after external beam chemoradiation: a non-randomized matched comparison in Ⅰ B2-Ⅱ B cervical cancer patients[J]. World J Surg Oncol, 2009, 7: 19. DOI:10.1186/1477-7819-7-19 |
| [12] |
Hsu WC, Chung NN, Chen YC, et al. Comparison of surgery or radiotherapy on complications and quality of life in patients with the stage Ⅰ B and Ⅱ A uterine cervical cancer[J]. Gynecol Oncol, 2009, 115(1): 41-45. DOI:10.1016/j.ygyno.2009.06.028 |
| [13] |
Cohen PA, Jhingran A, Oaknin A, et al. Cervical cancer[J]. Lancet, 2019, 393(10167): 169-182. DOI:10.1016/S0140-6736(18)32470-X |
| [14] |
Denschlag D, Gabriel B, Mueller-Lantzsch C, et al. Evaluation of patients after extraperitoneal lymph node dissection for cervical cancer[J]. Gynecol Oncol, 2005, 96(3): 658-664. DOI:10.1016/j.ygyno.2004.08.053 |
| [15] |
Cibula D, Dostalek L, Hillemanns P, et al. 806O Radical hysterectomy in cervical cancer patients with intraoperatively detected positive lymph node: ABRAX multicentric retrospective cohort study (ENGOT-Cx3/CEEGOG CX2)[J]. Ann Oncol, 2020, 31: S610. DOI:10.1016/j.annonc.2020.08.945 |
| [16] |
Luo L, Luo Q, Tang L. Diagnostic value and clinical significance of MRI and CT in detecting lymph node metastasis of early cervical cancer[J]. Oncol Lett, 2020, 19(1): 700-706. DOI:10.3892/ol.2019.11180 |
 2022, Vol. 42
2022, Vol. 42


