2. 北京大学第三医院肿瘤放疗科,北京 100191
2. Department of Radiation Oncology, Peking University Third Hospital, Beijing 100191, China
据2020年全球最新癌症负担数据统计,中国胃癌的年新发病例数为48万,占全球的44%,死亡人数为37万,占全球胃癌死亡人数的48%[1]。中国胃癌大数据调查显示,65.44%~78.7%的患者为Ⅲ-ⅣA期[2],这部分患者即使进行根治性D2切除术,局部复发率仍然高达60%~80%[3]。目前现有的研究证据显示,局部晚期胃癌的治疗呈现一种多元化模式,接受术前/术后同步放化疗联合围手术期化疗的治疗模式,有望获得进一步改善局部复发、局部区域复发和无病生存率。然而,放疗的适应症、放疗范围以及放疗时机尚未形成普遍的共识。本文回顾性分析了接受D2根治术的局部晚期胃癌进行术前或术后同步放化疗的疗效和不良反应,旨在为Ⅲ-ⅣA期胃癌患者探讨合适的放疗时机。
资料与方法1. 病例临床资料:回顾性分析2012—2019年郑州大学附属肿瘤医院收治的Ⅲ-ⅣA期胃癌患者。纳入标准:①病理证实为胃腺癌。②治疗前经多学科会诊,由团队中固定的2-3位副主任医师以上职称的放射科专家进行阅片,以最终达成的意见确诊临床分期为Ⅲ-ⅣA期(美国癌症联合委员会癌症分期手册第8版)。③进行D2根治术并达到R0切除,淋巴结清扫数量在15枚以上。④完成全部放化疗及手术过程。⑤无其他肿瘤病史或放化疗史。排除标准:①肉眼或显微镜下切缘阳性的患者。②接受姑息性手术者。③双原发恶性肿瘤患者。本研究经医院伦理委员会同意,所有纳入患者均签署知情同意书。
2. 研究方法:比较入组患者的无病生存期(disease-free survival,DFS)、总生存期(overall survival,OS)、局部复发率、远处转移率和不良反应。
3. 放疗:放疗方式为6 MV直线加速器实施的调强照射治疗(intensity modulated radiation therapy,IMRT)或容积旋转调强照射治疗(volume modulated arc therapy,VMAT)技术。所有患者接受剂量为45~50.4 Gy/1.8~2.0 Gy/25~28次/5~6周的照射。临床靶区(clinical target volume,CTV)按照美国放射治疗学和肿瘤学学会(ASTRO)[4]和急性放射反应评分标准(EORTC-ROG)[5]专家共识进行勾画,由增强CT或术后标记确定的瘤床/病变、吻合口和区域淋巴结引流/转移区。按照肿瘤所在位置包括的区域淋巴结有胃周、腹腔、脾门、脾动脉、肝十二指肠或肝门、部分胰后及腹主动脉旁淋巴结。计划靶区(planning target volume,PTV) 为CTV外扩0.6~1.2 cm,并对其进行优化以确保处方剂量超过95%的PTV。每个肾脏的平均剂量 < 18 Gy,肝脏平均剂量 < 25 Gy。接受>45 Gy的小肠体积≤195 cm3,脊髓最大剂量≤45 Gy。放疗方案由两位10年以上放疗经验的临床医生决定。治疗前对照射野、照射剂量、手术病理报告及肿瘤的影像学均进行了复核。每周一次锥形束CT(CBCT)位置验证。
4. 分组:共两组。A组(术前同步放化疗组):同步化疗方案为CAPOX方案:奥沙利铂130 mg/m2, d1, 静脉滴注2 h;卡培他滨1 000 mg/m2,口服,每日2次,第1~14天。在放疗的第1天和第29天实施。B组(术后同步放化疗组):同步化疗方案为INT0116方案:氟尿嘧啶400 mg ·m-2 ·d-1, 亚叶酸钙20 mg ·m-2 ·d-1, d1~5; 放疗进行的前4天和最后3天实施。
5. 围手术期化疗:所有纳入患者除同步放化疗外均接受4~6周期氟尿嘧啶类联合奥沙利铂的双药方案化疗。
6. 信息采集:收集所有患者的临床和病理特征,包括年龄、性别、肿瘤位置、肿瘤浸润深度、阳性淋巴结个数、治疗前后血红蛋白和血清白蛋白,治疗中不良反应,以及复发和生存情况。
7. 随访:所有患者自诊断之日起随访至死亡。前2年每3个月随访1次,然后每6个月1次,直到5年,之后每年1次。复查包括完整的病史采集和体格检查,血清肿瘤生物标志物,颈部至盆腔CT扫描,每年做1次内窥镜检查。观察患者肿瘤控制情况,分析DFS、OS、局部复发率和远处转移率。治疗不良反应评价使用通用不良事件术语标准(CTCAE) 4.0。定义DFS为从诊断到复发或死亡的时间。
8. 统计学处理:所有统计分析均使用SPSS 25.0软件。采用Kaplan-Meier方法分析OS和DFS,t检验分析血清白蛋白及血红蛋白差异,等级变量分析消化道不良反应及骨髓抑制,χ2检验用于分析组间转移及复发的差异。P < 0.05为差异有统计学意义。
结果1. 患者临床特征分析:2012年至2019年共收集A组术前放化疗患者27例:2例治疗中断(1例肺部炎症,1例不明原因发热放弃治疗),最终分析25例,治疗完成率92.6%。收集B组术后放化疗患者29例:4例治疗中断(其中1例放疗5次因个人原因停止治疗,1例因心肌梗塞终止,2例放疗20次以上无法耐受终止),最终纳入22例进行数据分析,治疗完成率73.3%。基线特征见表 1。
|
|
表 1 47例Ⅲ-ⅣA期胃癌患者基本临床资料 Table 1 Basic clinical data of 47 patients with stage Ⅲ-ⅣA gastric cancer |
2. 治疗结果分析:截至2022年1月,中位随访时间48个月(3~72个月),全组患者死亡31例,A组12例,B组19例。A组术前放化疗后病理完全缓解率为12%(3/25),pN0率为48%(12/25)。A组1年、2年、3年的OS分别为92.0%、72.0%、56.0%;B组1年、2年、3年的OS分别为54.5%、45.5%、40.9%。进行术前放化疗的患者1年OS显著优于术后放化疗者(92.0% vs. 54.5%,χ2=5.68,P=0.017),差异有统计学意义;两组3年OS为56% vs. 40.9%,差异无统计学意义(P>0.05)。两组患者3年DFS为51.4% vs.31.8%,差异无统计学意义(P>0.05)。见图 1。
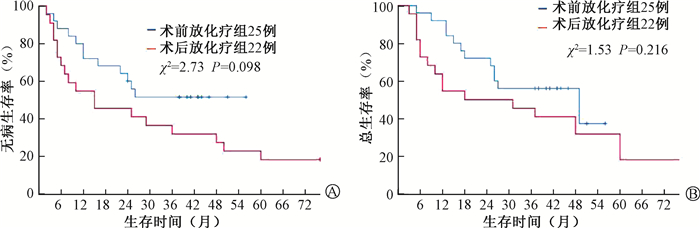
|
A.无病生存率;B.总生存率 图 1 47例胃癌患者术前和术后同步放化疗生存率比较 A. Disease-free survival; B. Overall survival Figure 1 Comparison of survival rates between preoperative and postoperative concurrent chemoradiotherapy of 47 gastric cancer patients |
3. 复发转移情况分析:采集患者的病史和体格检查、CT及内镜检查,将两组患者的失败情况进行了分析。全组出现复发转移患者共34例,其中A组13例,分别为:局部复发8例,远处转移7例,复发并转移2例;B组21例,分别为:局部复发9例,远处转移14例,复发并转移2例。两组患者局部复发率相当,差异无统计学意义(P>0.05);A组远处转移率显著低于B组,差异有统计学意义(χ2=6.012,P=0.014)。
4. 安全性分析:两组患者治疗中均出现不同程度的消化道反应,包括恶心、呕吐、纳差、腹泻等,按照CTCAE进行分级后50%~60%的患者为1~2级消化道反应,4.5%~8%的患者出现3~4级消化道反应,两组之间差异无统计学意义(P>0.05)。1~2级骨髓抑制的发生率为80.0%~81.8%,3~4级为4.5%~8%,两组之间差异无统计学意义(P>0.05)。A组血清白蛋白治疗后较治疗前显著下降,和B组相比,差异有统计学意义(t=-2.04,P=0.048),提示术前放化疗较术后放化疗患者营养状况下降明显。A组血红蛋白治疗后较治疗前明显升高,与B组相比,差异有统计学意义(t=4.89,P=0.001),提示术前放化疗有助于贫血的改善。具体见表 2。
|
|
表 2 47例胃癌患者放化疗后胃肠道不良反应和血液毒性 Table 2 Gastrointestinal adverse reactions and hematological toxicity of 47 gastric cancer patients after chemoradiotherapy |
讨论
目前多项大型随机对照研究已证实,对于局部进展期胃癌进行辅助或新辅助治疗有助于改善患者DFS与OS[6-10],但是最佳治疗方案尚未达成共识。美国学者Macdonald等[10]总结的INT 0116临床研究结果表明,接受术后辅助放化疗组患者较单纯手术组无复发生存率提高了11个月,中位OS延长了9个月。由于该研究中90%的患者没有进行目前常规采用的D2根治术,从而凸显了术后放疗的局部控制作用。韩国一项研究结果[6-7]显示,D2根治术后放疗的加入并没有比单纯的术后化疗提高5年OS和DFS,但是该研究中58%是Ⅰ~Ⅱ期的患者,并不能体现出放疗的局部控制优势,并且在亚组分析中发现,有淋巴结转移和肠型胃癌的患者依然可以从放疗中获益。即使在后期ARTIST2研究中由于包含了32%的Ⅱ期患者也不能完全说明辅助放疗在Ⅲ~ⅣA期胃癌患者中发挥的作用[8]。术前放疗方面,一项来自荷兰的8所医疗中心参与的CROSS研究结果显示,局晚期食管胃交界部腺癌可以从新辅助放化疗中获得OS和DFS的改善[9]。德国POET研究观察了126例局部进展期食管胃交界部腺癌患者,随机分为新辅助化疗组(64例,顺铂+氟尿嘧啶+甲酰四氢叶酸)与新辅助放化疗组(62例,顺铂+氟尿嘧啶+甲酰四氢叶酸/ 30 Gy+),结果显示新辅助放疗可将3年OS从27.7%提高至47.4%[11]。其他国际上关于远端胃癌新辅助放疗的临床研究目前正在进行中。因此,对于D2根治术后T4或高淋巴结转移率N2-3的局晚期胃癌患者应该进行术前新辅助放疗还是术后的辅助放疗目前尚缺乏定论。
本研究中所有入组患者均为接受D2根治术并达R0切除的Ⅲ-ⅣA期的局晚期胃癌。根据美国国家癌症数据库报告,ⅢA、ⅢB和Ⅳ期患者根治术后3年生存率分别为27%、14%和10%[12]。Che等[13]通过分析SEER数据库中6 890例IB~ⅢC期胃癌患者的临床资料,发现Ⅲ期胃癌若合并以下任何一项:组织学Ⅲ/Ⅳ级、弥漫性或远端胃癌、肿瘤>34 mm,淋巴结阳性,术后辅助放化疗较单纯辅助化疗可以带来生存的获益。本研究中辅助放化疗的3年OS为40.9%,远高于单纯手术的20%,但低于ARTIST2研究中报道的72.8%[8]和CLASSIC中报道的74%[14],考虑上述两项研究中Ⅲ期的胃癌患者不足50%,所以不能真正反映出放疗对于Ⅲ-ⅣA期患者的贡献。
与此同时,越来越多的研究开始关注局部进展期胃癌的新辅助治疗。多个研究结果已经评估了术前新辅助放化疗具有提高PCR率、局部控制率,并最终转化成生存的优势[9, 13, 15]。Li等[16]分析了95例T3/4N+的胃癌患者,进行新辅助放化疗后3年DFS和OS分别为60.7%和62.3%,略高于本研究的51.4%和56%,分析原因考虑为该研究围手术期化疗大都采用FLOT或ECF等3药方案,T4患者占56.8%。而本研究中采用CAPOX双药方案,且术前治疗组68%的患者为T4患者,其中一部分界定为难以手术的潜在可切除患者,通过术前新辅助放化疗转化为可切除病例,并最终实现了R0切除,PCR率达12%(3/25), pN0率为48%(12/25),最终转化为生存获益。
对比两组生存率,术前放化疗组1年OS显著高于术后放化疗组,而3年OS差异无统计学意义。考虑与入组例数较少,术前放化疗组患者总体随访时间短于术后组,且一半以上患者尚未达到随访终点。该结果与Yang等[17]研究结论相似。在失败模式分析中,发现术前放化疗组的远处转移率低于术后组,考虑为术前同步放化疗增加了奥沙利铂,从而提高了全身控制作用,这和Bang等[14]的报道结果是一致的。
不良反应方面,既往研究结果显示,放疗加入到围手术期化疗中并没有导致不良反应的显著加重[8, 18]。本研究中术前放化疗组由于高瘤负荷及加入奥沙利铂等因素,导致了消化道反应发生率高于术后放化疗组,虽差异没有达到统计学意义,但却导致了血清白蛋白水平的显著下降,提示术前新辅助治疗对患者的营养状况影响较大。通过术前放化疗使76%因肿瘤导致慢性贫血的患者得到了控制,而慢性贫血为胃癌的一个不良预后因素[19]。
由于这是一项回顾性分析,所以存在一些可能影响结果的缺陷。首先,对于胃癌没有进行诊断性腹腔镜检查,临床分期可能不准确。即使已经考虑到胃癌的临床分期与病理分期的符合度仅有60%~70%[20-22],而采取同一MDT团队结合CT、PET-CT及超声胃镜对两组患者基线状态进行临床分期,但是依然可能存在术前放化疗组分期的偏倚,进而影响治疗决策并导致预后偏差。其次,由于采取的是研究时常用方案,术前和术后治疗组的化疗方案不一致,可能影响了远期预后,事实上在远处转移率上确实看到了差异。最后,本研究中的病例数据来自单一中心,患者数量可能不足。且术前放化疗患者入组较晚,因此随访时间较短,应在更大的样本量更长的随访时间中进一步验证结果。
对于能够接受D2根治术的Ⅲ-ⅣA期的胃癌患者,本研究认为术前与术后进行同步放化疗的疗效及安全性相当,且术前放化疗患者的1年总生存率和远处转移率优于术后放化疗者。针对由于肿瘤导致慢性贫血的局晚期胃癌患者,可以考虑进行术前的新辅助治疗。
利益冲突 无
作者贡献声明 卜珊珊负责文献整理、数据分析和论文撰写;王俊杰负责论文修改;王婷、许刚、刘海龙负责病例管理或收集;宋涛负责影像学分析;王修身指导研究设计
| [1] |
Wild CP, Weiderpass E, Stewart BW. World cancer report: cancer research for cancer prevention. International Agency for Research on Cancer[R]. Geneva: World Health Organization, 2020.
|
| [2] |
Wu Z, Li Z, Ji J. Quality improvement of diagnosis and treatment of gastrointestinal cancer: establishment and implementation of the China Gastrointestinal Cancer Surgery Union Database[J]. Chin J Gastro Surg, 2020, 23(1): 26-32. DOI:10.3760/cma.j.issn.1671-0274.2020.01.005 |
| [3] |
Li J, Zhang S, Liu J, et al. Review of clinical investigation on recurrence of gastric cancer following curative resection[J]. Chin Med J (Engl), 2012, 125(8): 1479-1495. DOI:10.3760/cma.j.issn.0366-6999.2012.08.022 |
| [4] |
Smalley SR, Gunderson L, Tepper J, et al. Gastric surgical adjuvant radiotherapy consensus report: rationale and treatment implementation[J]. Int J Radiat Oncol Biol Phys, 2002, 52(2): 283-293. DOI:10.1016/s0360-3016(01)02646-3 |
| [5] |
Oscar M, Erich G, Zvi B, et al. EORTC-ROG expert opinion: radiotherapy volume and treatment guidelines for neoadjuvant radiation of adeno carcinomas of the gastroesophageal junction and the stomach[J]. Radiother Oncol, 2009, 92: 164-175. DOI:10.1016/j.radonc.2009.03.018 |
| [6] |
Lee J, Lim DH, Kim S, et al. Phase Ⅲ trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection: the ARTIST trial[J]. J Clin Oncol, 2012, 30(3): 268-273. DOI:10.1200/JCO.2011.39.1953 |
| [7] |
Se HP, Tae SS, Jeeyun L, et al. Phase Ⅲ trial to compare adjuvant chemotherapy with capecitabine and cisplatin versus concurrent chemoradiotherapy in gastric cancer: final report of the adjuvant chemoradiotherapy in stomach tumors trial, including survival and subset analyses[J]. J Clin Oncol, 2015, 33(28): 3130-3136. DOI:10.1200/JCO.2014.58.3930 |
| [8] |
Park SH, Lim DH, Sohn TS, et al. A randomized phase Ⅲ trial comparing adjuvant single-agent S1, S-1 with oxaliplatin, and postoperative chemoradiation with S-1 and oxaliplatin in patients with node-positive gastric cancer after D2 resection: the ARTIST 2 trial[J]. Ann Oncol, 2021, 32(3): 368-374. DOI:10.1016/j.annonc.2020.11.017 |
| [9] |
Shapiro J, van Lanschot J, Hulshof M, et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomized controlled trial[J]. Lancet Oncol, 2015, 16(9): 1090-1098. DOI:10.1016/S1470-2045(15)00040-6 |
| [10] |
Macdonald JS, Smalley SR, Benedetti J, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction[J]. N Engl J Med, 2001, 345(10): 725-730. DOI:10.1056/NEJMoa010187 |
| [11] |
Stahl M, Walz MK, Riera-Knorrenschild J, et al. Preoperative chemotherapy versus chemoradiotherapy in locally advanced adenocarcinomas of the oesophagogastric junction (POET): Longterm results of a controlled randomised trial[J]. Eur J Cancer, 2017, 81: 183-190. DOI:10.1016/j.ejca.2017.04.02712 |
| [12] |
Hundahl SA, Phillips JL, Menck HR. The National Cancer Data Base Report on poor survival of U.S. gastric carcinoma patients treated with gastrectomy: Fifth Edition American Joint Committee on Cancer staging, proximal disease, and the 'different disease' hypothesis[[J]. Cancer, 2000, 88(4): 921-932. |
| [13] |
Che K, Liu F, Wu N, et al. Individualized prediction of survival benefits from perioperative chemoradiotherapy for patients with resectable gastric cancer[J]. Cancer Med, 2020, 9(19): 7137-7150. DOI:10.1002/cam4.3350 |
| [14] |
Bang YJ, Kim YW, Yang HK, et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomised controlled trial[J]. Lancet, 2012, 379(9813): 315-321. DOI:10.1016/S0140-6736(11)61873-4 |
| [15] |
Allen CJ, Blumenthaler AN, Smith GL, et al. Chemotherapy versus chemotherapy plus chemoradiation as preoperative therapy for resectable gastric adenocarcinoma: a propensity score-matched analysis of a large, single-institution experience[J]. Ann Surg Oncol, 2021, 28(2): 758-765. DOI:10.1245/s10434-020-08864-1 |
| [16] |
Li N, Wang X, Tang Y, et al. Down-staging depth score could be a survival predictor for locally advanced gastric cancer patients after preoperative chemoradiotherapy[J]. Chin J Cancer Res, 2021, 33(4): 447-456. DOI:10.21147/j.issn.1000-9604.2021.04.02 |
| [17] |
Yang W, Zhou M, Li G, et al. Preoperative chemoradiotherapy versus postoperative chemoradiotherapy for patients with locally advanced gastric cancer: a retrospective study based on propensity score analyses[J]. Front Oncol, 2020, 10: 560115. DOI:10.3389/fonc.2020.560115 |
| [18] |
Leong T, Smithers BM, Haustermans K, et al. TOPGEAR: a randomized, phase Ⅲ trial of perioperative ECF chemotherapy with or without preoperative chemoradiation for resectable gastric cancer: interim results from an international, intergroup trial of the AGITG, TROG, EORTC and CCTG[J]. Ann Surg Oncol, 2017, 24(8): 2252-2258. DOI:10.1245/s10434-017-5830-6 |
| [19] |
Liu X, Qiu H, Huang Y, et al. Impact of preoperative anemia on outcomes in patients undergoing curative resection for gastric cancer: a single-institution retrospective analysis of 2 163 Chinese patients[J]. Cancer Med, 2018, 7(2): 360-369. DOI:10.1002/cam4.1309 |
| [20] |
Fairweather M, Jajoo K, Sainani N, et al. Accuracy of EUS and CT imaging in preoperative gastric cancer staging[J]. J Surg Oncol, 2015, 111(8): 1016-1020. DOI:10.1002/jso.23919 |
| [21] |
Hallinan JT, Venkatesh SK. Gastric carcinoma: imaging diagnosis, staging and assessment of treatment response[J]. Cancer Imaging, 2013, 13(2): 212-227. DOI:10.1102/1470-7330.2013.0023 |
| [22] |
Takeo F, Hitoshi K, Junki M, et al. A prospective multi-institutional validity study to evaluate the accuracy of clinical diagnosis of pathological stage Ⅲ gastric cancer (JCOG1302A)[J]. Gastric Cancer, 2018, 21(1): 68-73. DOI:10.1007/s10120-017-0701-1 |
 2022, Vol. 42
2022, Vol. 42


