2. 法兰克福高等研究院 西电-FIAS 国际联合研究中心,法兰克福 60438,德国
2. Frankfurt Institute for Advanced Studies & Xidian-FIAS International Joint Research Center, Frankfurt am Main 60438, Germany
唾液腺癌(salivary gland carcinoma,SGC)是头颈部较为罕见的恶性肿瘤,约占全身恶性肿瘤的0.3%,约占头颈部恶性肿瘤的5%[1-2]。淋巴结转移是唾液腺癌患者预后不佳的重要因素[3]。但与口腔鳞状细胞癌不同,唾液腺癌颈部淋巴结转移中隐匿性转移占比高达40%[4];且唾液腺癌颈部淋巴结转移易出现跳跃性转移,这也为临床早期发现唾液腺颈部淋巴结转移带来了困难。因此,准确判断术前颈部淋巴结转移状态可以为临床治疗决策提供重要信息,如是否需行颈淋巴结清扫术以及清扫术的范围等。目前,计算机断层成像(CT)和磁共振成像(MRI)是临床上对于唾液腺癌颈部淋巴结评估的常用方法,然而,唾液腺癌病理类型复杂、生物学行为上异质性明显,其对淋巴结转移状态的诊断并不理想[5]。氟代脱氧葡萄糖正电子发射计算机断层显像(18F-FDG PET/CT)对淋巴结转移状态的诊断有一定优势[5-6],然而单纯的标准摄取值(SUV)很难在组织水平刻画异质性特征。
近年来,基于大数据的影像组学研究对肿瘤术前淋巴结状态的评估表现出巨大潜能。基于影像组学的方法,通过对病灶进行勾画、提取特征并建立模型来预测淋巴结转移的研究,在多种恶性肿瘤都取得了较好的辨别效果[7-9]。然而, 目前尚无基于影像组学的研究用于评估唾液腺癌颈部淋巴结转移情况。因此,本研究拟构建以唾液腺癌患者原发肿瘤为感兴趣区(ROI)的基于18F-FDG PET/CT的影像组学模型,探讨其在预测唾液腺癌颈部淋巴结转移中的应用价值。
资料与方法1.研究对象:回顾性收集了2007年10月至2020年10月于北京大学口腔医院就诊的唾液腺癌患者的临床、病理及18F-FDG PET/CT影像资料。纳入标准:病理诊断为唾液腺癌;具有完整的临床病理资料;具有治疗前完整的18F-FDG PET/CT影像。排除标准:合并其他部位恶性肿瘤病史;影像缺乏或质量差无法评估者。本研究经本院医学伦理委员会批准并取得患者知情同意(批准号:PKUSSIRB-201949137)。
2. 18F-FDG PET/CT检查方法:患者于不同机构的不同仪器进行18F-FDG PET/CT检查,扫描前禁食6 h以上,血糖水平在3.9~11.0 mmol/L,按照3.70~4.4 MBq/kg注射18F-FDG,休息60~70 min后行检查。
3.临床病理特征及淋巴结转移诊断标准:根据美国癌症联合委员会(AJCC)癌症分期手册第8版进行TNM分期,根据第4版世界卫生组织(WHO)《头颈部肿瘤病理学和遗传学分类》进行组织学分级。PET/CT报告的淋巴结状态(cN)由两名分别具有5年及10年以上经验的核医学影像医师进行评估,是否为临床转移淋巴结依赖于解剖信息模式和18F-FDG摄取,没有使用特定的SUV值截断。所有淋巴结转移患者均通过病理检查或影像学随访得到证实。
4.影像组学分析
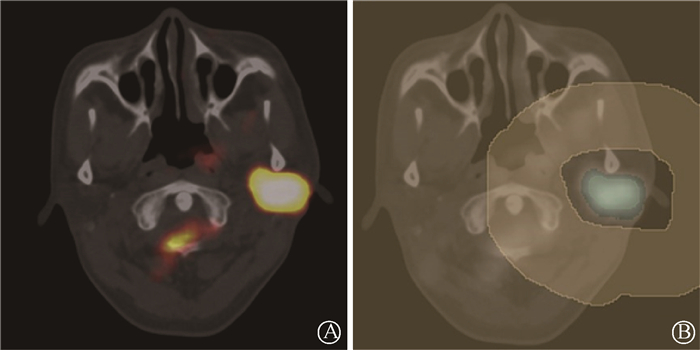
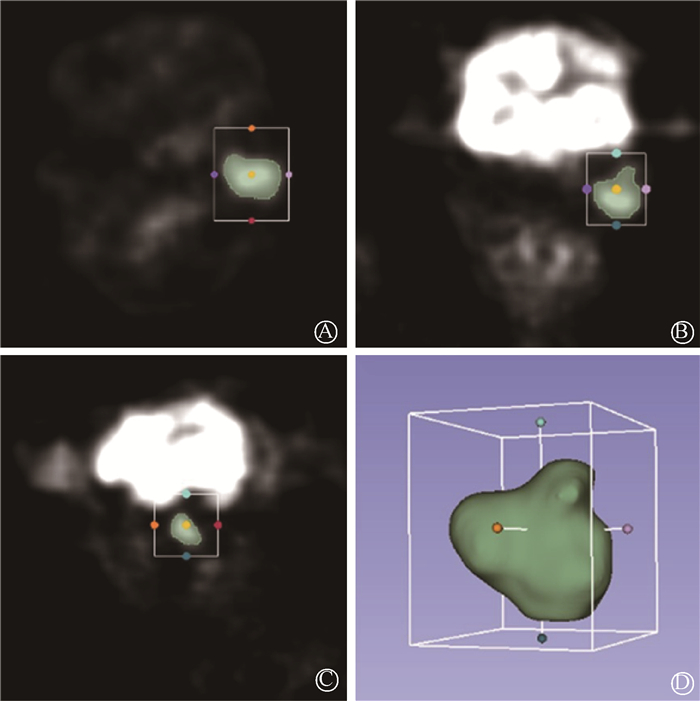
(1) 图像采集和分割:获取DICOM格式的18F-FDG PET/CT图像,导入免费开源软件3 D Slicer(4.10.2;https://www.slicer.org/)中,先由一名具有5年经验的口腔颌面部肿瘤专业医师在每个连续层面上人工粗略地划定高摄取值区和非摄取值区,然后利用Grow From Seeds算法将PET图像分割为前景感兴趣区域(ROI)和背景区域,如图 1。去除背景和周围孤立的前景像素,得到用来提取影像组学特征的ROI,如图 2。勾画者对所勾画患者临床信息不知情。另有一名具有10年经验的口腔颌面部肿瘤专业医师对随机抽取的20例患者独立进行ROI勾画,以评估模型预测的观察者间变异性。
|
A.勾画前;B.勾画后 图 1 1例左腮腺癌患者感兴趣区域勾画 A. Before delineation; B. After delineation Figure 1 ROI delineation of one case of left parotid carcinoma |
|
A.水平位; B.冠状位; C.矢状位; D.3D 图 2 感兴趣区域分割 A. Axial; B. Coronal; C. Sagittal; D. 3D Figure 2 Segmentation of region of a ROI |
(2) 特征提取:通过免费开源的工具包Pyradiomics(Python3.7)[10]从每个ROI中提取影像组学特征。
(3) 特征筛选与降维:计算两名医师的组间相关系数(ICC),ICC >0.75认为特征一致性较好,不同分割结果对病灶特征提取影响不显著。然后在MATLAB 2021a (MathWorks)中进行主成分分析(PCA),将原始特征的完整度q设置为0.99,在不破坏原始数据推导的情况下对特征进行降维。
(4) 模型构建与验证:在MATLAB 2021a中,设计3层的人工神经网络(ANN)模型。将合并或不合并cN的影像组学特征组分别作为输入添加到输入层。利用特定的隐藏层和单一的输出层对数据进行处理,得到不同权重下的结果值。将患者随机分为训练组(40例)、验证组(14例)和测试组(14例)。训练过程中对神经网络模型均使用K-折交叉验证以避免过拟合。
5.统计学处理:采用SPSS 25.0软件分析数据。符合正态分布的计量资料两组间比较采用独立样本t检验,无序分类变量两组间比较采用χ2检验,有序分类变量两组间比较采用Wilcoxon秩和检验。应用MATLAB 2021a软件计算受试者工作特征(ROC)曲线、ROC曲线下方面积(AUC)、准确度、灵敏度、特异度。对各个模型ROC曲线进行Delong检验来比较模型间的效能差异。P<0.05为差异有统计学意义。
结果1.病例资料:纳入2007年10月至2020年10月符合标准的患者68例,男40人,女28人,年龄25~82岁(中位年龄52岁),淋巴结转移患者16例(23.5%),非淋巴结转移患者52例(76.5%),见表 1。淋巴结转移组与淋巴结非转移组间,临床N分期差异具有统计学意义(Z=-3.31,P<0.05)。
|
|
表 1 入组患者的临床基线资料 Table 1 Clinical baseline information of patients included |
2.特征筛选及预测模型的建立:采用pyradiomics共获取包括三维形状、一阶统计学特征、纹理特征在内的共计1 223个影像组学特征。通过一致性分析筛选出385个特征,构建出一个ANN模型即影像组学模型(RAD)。另外结合PET/CT报告的淋巴结状态(cN)构建一个ANN模型即联合模型(cNRAD)。总数据集划分出腺样囊性癌(ACC)组、大唾液腺(MSG)组进行分层分析。
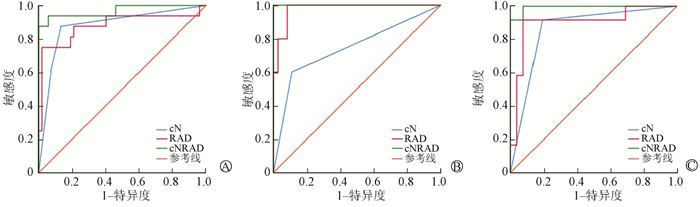
3.模型的预测效能:各模型预测的AUC值、准确度、灵敏度、特异度见表 2。各组ROC曲线见图 3。Delong检验显示在总共68例患者及ACC、MSG亚组中,联合模型与cN差异有统计学意义(总体:Z=2.27、2.04、2.51,P<0.05),而联合模型与影像组学模型间差异无统计学意义(P>0.05)。
|
|
表 2 三种模型预测的特异度、灵敏度、准确度及AUC值 Table 2 Specificity, sensitivity, accuracy, and AUC of three models |
|
注:cN. PET/CT报告的淋巴结状态;RAD.影像组学模型;cNRAD.联合模型 A.总体组;B.腺样囊性癌组;C.大唾液腺组 图 3 3种模型的ROC曲线 A. General group; B. Group ACC; C. Group MSG Figure 3 ROC curves of three models |
讨论
颈部淋巴结转移是唾液腺癌患者预后不良因素。唾液腺癌颈部淋巴结转移率据文献报道约为13%[3],然而一旦发生颈部淋巴结转移,患者生存率可降低50%[11]。治疗前准确及时地诊断颈部淋巴结转移,对患者的临床分期、临床医师选择合适的治疗方式以及患者的预后都具有积极重要的意义。
鉴于唾液腺癌的低发病率和广泛的异质性,目前尚无随机对照试验来指导治疗。而唾液腺癌颈部隐匿性转移率文献报道0~60%不等[12],而且可能发生跨区转移,使得临床上早期发现转移十分困难。目前美国国立综合癌症网络(NCCN)指南仅推荐对大唾液腺高级别或T3/T4肿瘤进行临床N0(cN0)的颈淋巴清扫,而对小唾液腺肿瘤没有明确的指导,选择性颈淋巴清扫仍然存在一定的争议。如果治疗前能更准确地识别出淋巴结转移患者,则对于唾液腺癌患者能够选择更好的颈部处理方式。目前,增强CT和MRI作为术前淋巴结分期临床程序,其准确性并不令人满意。18F-FDG PET/CT对淋巴结转移状态的诊断有一定优势,其灵敏度据报道可达88.2%,高于增强CT的52.9%[5]。然而,唾液腺癌病理类型达20余种,不同病理类型间生物学行为差异很大,即使同一病理类型也表现出较明显的异质性,因此单纯SUV值很难在组织水平刻画异质性特征和淋巴结转移状态。同时,不同医师的诊断之间具有较大的个体差异,且诊断过程较为耗时。因此,需要改进治疗前淋巴结分期预测工具。
影像组学概念由荷兰学者Lambin教授于2012年首次提出。它是指应用自动化、高通量的数据特征提取算法,将影像图像转化为高维度的影像定量特征数据,挖掘可用于指导治疗决策的信息[13-14]。影像组学技术为肿瘤淋巴结转移的无创定量评估开辟了新的思路。基于影像组学的方法,通过对病灶进行勾画、提取特征并建立模型来预测淋巴结转移的研究在甲状腺癌、非小细胞肺癌、口腔癌等方面都取得了较好的辨别效能[7-9]。然而,目前基于影像组学预测唾液腺癌淋巴结转移的研究尚无报道。但在在唾液腺癌方面,Wu等[15]将基于18F-FDG PET/CT的纹理分析用于预测局部晚期唾液腺癌间质近距离放射治疗患者的预后分析;Cheng等[16]设计了一种基于18F-FDG PET/CT影像组学的预后模型,可能有助于改善小唾液腺癌患者的预后预测。由此可见,基于18F-FDG PET/CT影像组学方法应用于预测唾液腺癌淋巴结转移的可行性。
因此,本研究构建出基于18F-FDG PET/CT的预测唾液腺癌患者颈部淋巴结转移的影像组学模型。本研究构建的影像组学模型的AUC为0.88,与PET/CT报告的淋巴结状态无明显差异。该模型的灵敏度为75%,显著高于文献报道的CT、MRI的50%[6],可见该影像组学模型可以达到有经验的核医学专科医师的诊断水平,对于唾液腺癌颈部淋巴结转移的预测效能优于CT和MRI。而影像组学特征和PET/CT报告的淋巴结状态相结合构建的联合模型的AUC为0.97,特异度可达到100%,其预测效能优于单纯核医学专科医师的诊断。
目前,大多数临床医生和影像医生单纯通过触诊和影像图像上可见的淋巴结来评估颈部淋巴结状态,而原发肿瘤的大小、组织学类型、分级等因素影响颈部淋巴结转移,在临床评估颈部淋巴结状态常被忽视。基于影像组学对头颈部鳞癌淋巴结转移预测的研究,也大多集中在淋巴结水平[17-18]。而Zhong等[9]构建的基于人工神经网络的影像组学模型,则将舌鳞癌原发肿瘤的CT影像组学与传统的淋巴结状态评估相结合,结果在测试集中,准确度、灵敏度、特异度和AUC分别达到84.1%、93.1%、76.5% 和0.943。本研究与Zhong等[9]的研究相类似,也将原发肿瘤的影像组学与传统的淋巴结状态评估相结合进行预测,因此构建的联合模型中可能嵌入了原发肿瘤相关的淋巴结转移影像因素,与传统方法相比更方便、无创,且更准确。由此可见,本研究构建的模型在临床实践中具有一定的应用价值。
腺样囊性癌是最常见的唾液腺恶性肿瘤病理类型之一,以浸润性生长和神经周围播散为特征,被称为头部和颈部最具生物破坏性和不可预测的肿瘤之一[19]。在Min等[20]的研究中,ACC颈部淋巴结转移与总生存率下降相关,也是随后肺转移的一个强有力的预测因素。对于原发或复发的临床淋巴结阳性患者,建议根治性颈淋巴清扫术,术后放疗。因此,本研究划分了一个ACC亚组,采用构建的模型对41例ACC患者进行预测,结果显示联合模型的AUC为1,预测效能优于PET/CT报告的淋巴结状态。同时,还划分了大唾液腺亚组,联合模型也体现了良好的预测效果。
本研究的局限性在于:样本量较小,模型采用交叉验证的方式,可能产生模型过拟合,需进一步扩大样本量,并进行多中心内部、外部验证模型性能;采用回顾性的研究方法,后续需结合前瞻性研究,提高模型泛化能力。
本研究创新性地应用基于18F-FDG PET/CT影像组学的方法,结合PET/CT报告的淋巴结状态构建的人工神经网络模型,可对唾液腺癌患者颈部淋巴结转移状态进行无创性预测,且其诊断效能优于PET/CT报告,可对临床医生治疗决策提供参考。
利益冲突 所有研究者未因进行该研究而进行任何不正当的职务和财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 延涵负责收集、分析数据和论文撰写;钟奕伟、伍文杰协助完善数据及指导ROI勾画;王凌霄负责模型代码编写;张杰、张建国、黄明伟负责研究设计及论文写作指导
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Pinkston JA, Cole P. Incidence rates of salivary gland tumors: results from a population-based study[J]. Otolaryngol Head Neck Surg, 1999, 120(6): 834-840. DOI:10.1016/s0194-5998(99)70323-2 |
| [3] |
彭歆, 郝杨, 高敏, 等. 涎腺癌颈淋巴结转移的临床分析[J]. 中国耳鼻咽喉头颈外科, 2011, 18(3): 118-120. Peng X, Hao Y, Gao M, et al. Cervical lymph node metastasis in salivary gland carcinoma[J]. Chin Arch Otolaryngol-Head Neck Surg, 2011, 18(3): 118-120. DOI:10.16066/j.1672-7002.2011.03.003 |
| [4] |
Yoo SH, Roh JL, Kim SO, et al. Patterns and treatment of neck metastases in patients with salivary gland cancers[J]. J Surg Oncol, 2015, 111(8): 1000-1006. DOI:10.1002/jso.23914 |
| [5] |
Park MJ, Oh JS, Roh JL, et al. 18F-FDG PET/CT versus contrast-enhanced CT for staging and prognostic prediction in patients with salivary gland carcinomas[J]. Clin Nucl Med, 2017, 42(3): e149-e156. DOI:10.1097/rlu.0000000000001515 |
| [6] |
Westergaard-Nielsen M, Rohde M, Godballe C, et al. Up-front 18F-FDG PET/CT in suspected salivary gland carcinoma[J]. Ann Nucl Med, 2019, 33(8): 554-563. DOI:10.1007/s12149-019-01362-9 |
| [7] |
Lu W, Zhong L, Dong D, et al. Radiomic analysis for preoperative prediction of cervical lymph node metastasis in patients with papillary thyroid carcinoma[J]. Eur J Radiol, 2019, 118: 231-238. DOI:10.1016/j.ejrad.2019.07.018 |
| [8] |
Ouyang ML, Wang YR, Deng QS, et al. Development and validation of a18F-FDG PET-based radiomic model for evaluating hypermetabolic mediastinal-hilar lymph nodes in non-small-cell lung cancer[J]. Front Oncol, 2021, 11: 710909. DOI:10.3389/fonc.2021.710909 |
| [9] |
Zhong YW, Jiang Y, Dong S, et al. Tumor radiomics signature for artificial neural network-assisted detection of neck metastasis in patient with tongue cancer[J]. J Neuroradiol, 2021, 49(2): 213-218. DOI:10.1016/j.neurad.2021.07.006 |
| [10] |
van Griethuysen JJM, Fedorov A, Parmar C, et al. Computational radiomics system to decode the radiographic phenotype[J]. Cancer Res, 2017, 77(21): e104-e107. DOI:10.1158/0008-5472.CAN-17-0339 |
| [11] |
马大权, 高岩. 唾液腺癌的诊治进展[J]. 中华口腔医学杂志, 2015, 50(5): 257-260. Ma DQ, Gao Y. Progress in diagnosis and treatment of salivary gland carcinoma[J]. Chin J Stomatol, 2015, 50(5): 257-260. DOI:10.3760/cma.j.issn.1002-0098.2015.05.001 |
| [12] |
Vartanian JG, Gonçalves Filho J, Kowalski LP, et al. An evidence-based analysis of the management of N0 neck in patients with cancer of the parotid gland[J]. Expert Rev Anticancer Ther, 2019, 19(10): 899-908. DOI:10.1080/14737140.2019.1674143 |
| [13] |
Lambin P, Rios-Velazquez E, Leijenaar R, et al. Radiomics: extracting more information from medical images using advanced feature analysis[J]. Eur J Cancer, 2012, 48(4): 441-446. DOI:10.1016/j.ejca.2011.11.036 |
| [14] |
Lambin P, Leijenaar R, Deist TM, et al. Radiomics: the bridge between medical imaging and personalized medicine[J]. Nat Rev Clin Oncol, 2017, 14(12): 749-762. DOI:10.1038/nrclinonc.2017.141 |
| [15] |
Wu WJ, Li ZY, Dong S, et al. Texture analysis of pretreatment 18F-FDG PET/CT for the prognostic prediction of locally advanced salivary gland carcinoma treated with interstitial brachytherapy[J]. EJNMMI Res, 2019, 9(1): 89. DOI:10.1186/s13550-019-0555-0 |
| [16] |
Cheng NM, Hsieh CE, Fang YD, et al. Development and validation of a prognostic model incorporating 18F-FDG PET/CT radiomics for patients with minor salivary gland carcinoma[J]. EJNMMI Res, 2020, 10(1): 74. DOI:10.1186/s13550-020-00631-3 |
| [17] |
Ho TY, Chao CH, Chin SC, et al. Classifying neck lymph nodes of head and neck squamous cell carcinoma in MRI images with radiomic features[J]. J Digit Imaging, 2020, 33(3): 613-618. DOI:10.1007/s10278-019-00309-w |
| [18] |
Chen L, Zhou Z, Sher D, et al. Combining many-objective radiomics and 3D convolutional neural network through evidential reasoning to predict lymph node metastasis in head and neck cancer[J]. Phys Med Biol, 2019, 64(7): 075011. DOI:10.1088/1361-6560/ab083a |
| [19] |
Khan AJ, Digiovanna MP, Ross DA, et al. Adenoid cystic carcinoma: a retrospective clinical review[J]. Int J Cancer, 2001, 96(3): 149-158. DOI:10.1002/ijc.1013 |
| [20] |
Min R, Siyi L, Wenjun Y, et al. Salivary gland adenoid cystic carcinoma with cervical lymph node metastasis: a preliminary study of 62 cases[J]. Int J Oral Maxillofac Surg, 2012, 41(8): 952-957. DOI:10.1016/j.ijom.2012.04.023 |
 2022, Vol. 42
2022, Vol. 42


