2. 北京大学肿瘤医院暨北京市肿瘤防治研究所医学影像科恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142;
3. 北京大学肿瘤医院暨北京市肿瘤防治研究所头颈肿瘤外科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
2. Key Laboratory of Carcinogenesis and Translational Research (Ministry of Education, Beijing), Department of Radiology, Peking University Cancer Hospital & Institute, Beijing 100142, China;
3. Key Laboratory of Carcinogenesis and Translational Research (Ministry of Education, Beijing), Department of Head and Neck Surgery, Peking University Cancer Hospital & Institute, Beijing 100142, China
下咽癌发病时多为局部进展期,患者一般状况差,常合并基础疾病和营养不良问题,治疗难度大。诱导化疗(induction chemotherapy,IC)联合根治性放疗是初治局部晚期下咽癌器官功能保留治疗方案之一。IC的疗效可预测同步放化疗(concurrent chemoradiotherapy, CCRT)的疗效。1~2个周期IC后达到完全缓解的患者具有更高的生存率[1-2]。本研究旨在分析完成IC联合根治性放疗的局部晚期下咽鳞癌(hypopharyngeal squamous cell carcinoma, HPSCC)患者的复发模式和生存结果。
资料与方法1. 患者筛选:从北京大学肿瘤医院病历系统中筛选出2008年8月至2019年12月确诊为HPSCC的患者,共220例接受放疗。入选标准:①肿瘤位于下咽,包括梨状窝、环后区和咽后壁。②病理证实为SCC的局部晚期下咽癌,无远处转移。③确诊后均完成IC联合根治性放疗,根治性放疗阶段联合同步化疗或同步靶向或无同步治疗。其中,104例被排除(初诊治疗模式不符合条件83例,初诊远处转移13例,放疗中断8例);其余116例满足入选标准,治疗前均完成系统病史采集、体格检查、血常规、生化全项、肿瘤标志物、甲状腺功能、咽喉镜检查和原发灶活检、上消化道内镜、颈部+胸部CT、颈部和腹部超声(如颈部淋巴结转移则可行细针穿刺细胞学检查)。除非患者情况不允许或拒绝,局部晚期HPSCC患者均行气管镜检查。采用美国癌症联合会(AJCC)第8版分期[3]。治疗前均签署了本院伦理委员会批准的放疗、化疗和/或靶向治疗知情同意书。研究方案遵循赫尔辛基宣言中概述的准则,并通过了北京大学肿瘤医院伦理委员会的审批(批件号:2019YJZ76)。116例患者中位年龄59岁(39~79岁);初诊时已有体重下降的患者占33.6%(39例);75.0%(87例)的患者有吸烟史,68.1%(79例)的患者有嗜酒史。表 1列出了患者临床基本特征。
|
|
表 1 116例下咽鳞癌患者一般特征和资料 Table 1 General characteristics of 116 patients |
2. 治疗方式:本研究116例患者为局部晚期HPSCC,均接受IC联合以放疗为基础的根治性治疗方案。本研究为回顾性研究,且10年前IC方案并无共识;根据年龄、一般状况、经济情况、分期和心肺基础疾病,患者接受了不同的IC方案:紫杉+铂类+氟尿嘧啶类69例,紫杉+铂类29例,紫杉+铂类+尼妥珠单抗3例,铂类+氟尿嘧啶类15例。IC 3周为1个周期。共1~4个周期, 中位2个周期。每2个周期IC后根据实体瘤疗效评估标准(RECIST)1.1[4]进行疗效评估, 除外18例只接受1周期IC的患者。IC后,116例患者均完成了根治性放疗,其中54例患者接受了同步化疗(铂类),13例接受了同步靶向治疗(尼妥珠单抗), 另外49例接受了单纯放疗。根治性放疗后,24例患者接受了铂类为基础的辅助化疗。诱导治疗阶段和放疗同步阶段使用尼妥珠单抗的患者均签署了超药品说明书用药知情同意书。
放疗于IC结束后2~3周开始。患者采用仰卧位,头颈肩膜固定。CT定位层厚3 mm。除非患者情况不允许或拒绝,CT定位时使用静脉对比剂。将定位图像传至瓦里安计划系统中勾画靶区。大体肿瘤体积(gross tumor volume,GTV)包括所有临床查体、影像学检查和内镜检查可见的肿瘤病灶。分为原发灶GTV(GTVp)和阳性淋巴结GTV(GTVnd)两部分。阳性淋巴结定义:食管旁淋巴结短径≥5 mm,其他淋巴结短径≥10 mm;淋巴结包膜外侵犯;淋巴结明显坏死或强化;淋巴结成簇(≥3个);淋巴结PET图像SUVmax≥2.5;细针穿刺细胞学确诊[5]。根据美国肿瘤放射治疗协作组(RTOG)颈部淋巴结分区的定义[6]评估阳性淋巴结的位置。临床靶体积(clinical target volume,CTV)包括原发灶临床靶体积(CTVp)、阳性淋巴结所在引流区和其他有转移风险的淋巴引流区(CTVnd)。CTVp由GTVp水平外扩15~20 mm,纵向外扩20~30 mm,根据病变位置、周围侵犯和解剖屏障适当修改。CTVnd根据转移淋巴结的位置勾画。如颈部无阳性淋巴结,CTVnd包括双侧Ⅱ、Ⅲ、Ⅳ区和咽后淋巴结区(ⅦA)。如果阳性淋巴结位于舌骨上,CTVnd的上界要勾画至颅底(ⅦB)。如果Ⅱ区阳性淋巴结包膜外侵或短径超过3 cm,CTVnd需要勾画同侧的Ⅰ B区。如果阳性淋巴结位于Ⅱ区或Ⅲ区颈鞘后方,或者位于Ⅳ区,CTVnd需要包括同侧部分Ⅴ区。如果肿瘤原发梨状窝或环后区,CTVnd需要包括ⅥB区。计划大体肿瘤体积(planning GTV,PGTV)和计划靶体积(planning target volume,PTV)为GTV和CTV水平外扩3 mm,纵向外扩5 mm。危及器官包括脊髓、腮腺、甲状腺、肺、心脏、喉、气管和颞下颌关节。脊髓外扩5 mm形成计划危及器官体积(planning risk volume,PRV)。
采用6~8 MV光子射线调强放疗。完成的95%PGTV处方剂量70 Gy/33次;完成的95%PTV处方剂量60 Gy/33次。1次/d,每周放疗5次。
3. 治疗监测和随访:IC后、放疗结束时和治疗结束时均进行评估。随访时间安排:放疗结束1个月时,2年内每3个月复查1次,3~5年内每6个月复查1次,5年后每年复查1次。每次复查评估包括:全面体格检查、血常规、生化、肿瘤标志物、甲状腺功能、内镜检查、颈部+胸部CT、颈部+腹部超声。根据国家癌症研究所通用不良事件术语标准4.03版[7]进行不良反应分级。
4. 失败模式定义:RECIST版本1.1 [4]用于疗效评估和定义失败模式。疗效评估结果包括完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、疾病稳定(stable disease, SD) 和疾病进展(progressive disease, PD)。客观有效率(objective response rate, ORR) 包括CR和PR。治疗失败模式定义为:①局部失败为原发灶复发或进展。②区域失败为区域淋巴结复发或进展。③远处转移为血行播散至远处器官或组织,以及非区域淋巴结转移。
5. 统计学处理:数据分析采用SPSS 19.0软件。无局部复发生存(local recurrence-free survival, LRFS)、无区域复发生存(regional recurrence-free survival, RRFS)、无远处转移生存(metastasis-free survival, MFS) 和无进展生存(progress free survival, PFS)时间从治疗第1天开始计算,至事件发生或末次随访时间为止;总生存(overall survival, OS)时间从治疗第1天开始计算,至死亡或末次随访时间为止。Kaplan-Meier法计算生存率,并Log-rank法检验、Cox回归法进行预后因素分析。P < 0.05为差异有统计学意义。
结果1. 患者临床特征:116例局部晚期HPSCC患者的临床特征见表 1。
2. 治疗结果:IC的ORR(CR+PR)为55.2%(64/116)。IC后47例患者评效SD,5例患者PD;这52例患者并未接受挽救性手术,原因包括:大血管和/或椎前筋膜侵犯(T4B or N3B, 27例),保喉意愿(21例),手术禁忌症(4例)。
中位随访时间为34.6个月(95%CI : 28.7~40.5个月)。随访期间59例患者病情进展:54例下咽癌进展且死亡,1例下咽癌进展但死于车祸,1例下咽癌进展但死于第二原发肿瘤,3例下咽癌进展但尚未死亡。65例患者死亡,死因分别为肿瘤进展(54例)、下咽局部出血(4例)、喉部水肿窒息(3例)、下咽+肺部感染(1例)、第二原发肿瘤(2例)和车祸(1例)。IC应答患者的3年LRFS(77.4% vs. 44.5%,χ2=12.52,P < 0.05)、RRFS(89.8% vs. 73.6%,χ2=5.16,P < 0.05)、PFS (60.8% vs.30.3%, χ2=13.19,P < 0.05)和OS (57.1% vs.25.8%,χ2=11.72,P < 0.05)高于非应答患者,两组差异有统计学意义,而两组患者的3年MFS差异无统计学意义(76.0% vs. 75.4%,P=0.40)(图 1)。总人群的中位PFS和OS分别为26.1和28.0个月。3年LRFS、RRFS、MFS、PFS和OS分别为63.5%、82.8%、75.2%、47.3%和43.1%。
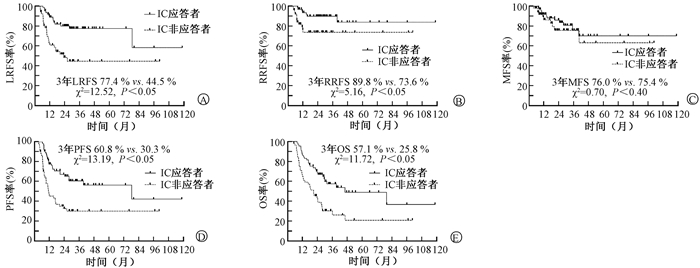
|
注:IC.诱导化疗; LRFS.无局部复发生存; MFS.无远处转移生存; OS.总生存; PFS.无进展生存; RRFS.无区域复发生存 A. LRFS;B. RRFS;C. MFS;D. PFS;E. OS 图 1 IC应答者和非应答者的预后参考指标对比 A. LRFS; B. RRFS; C. MFS; D. PFS; E. OS Figure 1 Comparison of prognostic indices of IC responders and non-responders. |
3. 失败模式:随访过程中,59例患者治疗后复发/转移。其中22、5、12、10、3、6和1例患者分别发生局部复发、区域复发、远处转移、局部区域复发、区域复发远处转移、局部复发远处转移、局部区域复发远处转移。根据RTOG颈部淋巴结分区定义,标识出19例患者的34个区域复发淋巴结。最常见的淋巴结复发区域为Ⅱ区(14例)和Ⅲ区(11例),其余为Ⅳ区(2例)、咽后淋巴结ⅦA区(3例)、ⅥB区(2例)、Ⅴ区(1例)和上纵隔区(1例)。22例远处转移患者中,转移部位包括肺(14例)、骨(8例)、肝(2例)、脑(1例)、腋窝(1例)和肾(1例)。
4. 不良反应:最常见的不良反应为1~2级急性反应。IC期间,3~4级急性白细胞减少、中性粒细胞减少、血小板减少、贫血、转氨酶升高、乏力、恶心呕吐、腹泻和黏膜炎的发生率分别为13.8%(16/116)、24.1%(28/116)、1.7%(2/116)、0、0、0、0.9%(1/116)、0和0。放疗期间,3~4级急性白细胞减少、中性粒细胞减少、血小板减少、贫血、转氨酶升高、乏力、恶心呕吐、黏膜炎(包括咽炎)、皮肤反应和口干的发生率分别为6.9%(8/116)、6.0%(7/116)、0.9%(1/116)、0.9%(1/116)、0、0、1.7%(2/116)、13.8%(16/116)、6.9%(8/116)和0。
讨论IC联合根治性放疗的治疗方式是保喉策略的一部分,IC同时也能降低远处转移发生率。已有多项研究报道下咽癌或喉癌的IC可提高保喉率。一项大样本的Ⅲ期研究证实了与手术相比,IC提高保喉率、降低远处转移发生率的同时并未降低OS [2]。欧洲癌症治疗研究组织(EORTC)头颈肿瘤协作组发起的前瞻性随机Ⅲ期研究也得到相似的结果[8]。基于这些研究数据,EORTC目前将IC联合根治性放疗作为保喉Ⅲ期临床研究的标准治疗。
RTOG 91-11研究提示对于T4喉癌/下咽癌,在保喉率和局部区域控制方面,CCRT优于IC联合根治性放疗和单纯根治性放疗[9]。而EORTC, PARADIGM和DeCIDE研究均证实IC联合CCRT可降低局部晚期头颈鳞癌的远处转移率,并可获得与CCRT相似的PFS和OS[8, 10-11]。意大利研究组(GSTTC) 开展了一项Ⅱ~Ⅲ期研究对比IC联合CCRT和CCRT的疗效(414例局部晚期头颈鳞癌,其中97例HPSCC),发现IC组CR率、局部区域控制率、PFS和OS均高于非IC组,而且同步化疗的完成率并未因IC而降低[12]。
另外,已有研究证实下咽癌对IC的应答与否能够预测生存预后。2~3周期IC后CR和PR的局部晚期下咽癌患者的PFS和OS均明显高于SD和PD的患者[13]。Ryu[14]发起的一项包含98例局部晚期下咽癌患者的临床研究显示,患者接受2个周期铂类为基础的IC后,根据疗效结果分为4组。第1组:7例CR患者接受放疗;第2组:59例PR患者接受同步放化疗;第3组:19例非应答患者接受手术+术后放疗;第4组:13例非应答患者接受同步放化疗。中位随访38个月,5年OS分别为51.4%、39.6%、52.6%、23.1%。IC非应答患者选择手术+ 术后放疗的预后与IC后CR的患者预后相当。IC可以作为一个预测因子,筛选出对放化疗敏感的下咽癌人群,避免不必要的全喉切除手术,满足患者的保喉意愿。
正是基于筛选放疗敏感患者、提高保喉功能和降低远处转移率的考虑,本研究治疗局部晚期下咽癌的方案为在多学科讨论的基础上明确诊断和分期,参照患者保喉功能的意愿,IC后根据疗效评价的结果,结合病情和患者意愿,选择非手术的根治性放疗/放化疗或者手术治疗。IC后如疗效达CR,可选择根治性放疗或同步放化疗;若为PR,可选择同步放化疗或手术治疗;若为SD和PD时,推荐行手术治疗。这与目前国内外治疗指南中保喉功能的治疗推荐是一致的(美国国立综合癌症网络NCCN头颈部肿瘤指南和中国临床肿瘤学会CSCO头颈部肿瘤诊疗指南)。但在临床实践中需要结合患者保喉意愿、有无手术禁忌和手术可行性等多种因素,经多学科讨论综合考量后给出个体化的推荐方案。正如本研究中IC后52例患者评效SD或PD,并未接受挽救性手术,主要原因包括大血管和/或椎前筋膜侵犯、保喉意愿和手术禁忌证。这也相应地降低了总体患者的疗效和生存率。
下咽癌患者明确诊断后,放疗定位和放疗计划制定需要1~2周的时间。对于肿瘤负荷比较大的局部晚期下咽癌患者,可先给予1~2周期系统IC以降低肿瘤负荷、提高局部区域控制率、降低远处转移发生率。本研究116例局部晚期HPSCC患者中,ⅣA和ⅣB期患者分别占51.7%和43.1%,明显高于既往文献报道的数据[8, 11-12],提示放疗计划制定等待过程中局部区域进展和远处转移风险更高。因此,本研究中的T4患者接受了IC + CCRT/RT作为治疗模式。本研究中IC后的ORR为55.2% (64/116)。IC应答患者的LRFS、RRFS、PFS和OS均显著高于IC非应答患者,这与既往研究结果是一致的[10]。但是IC应答和非应答患者的MFS并无差异,考虑与样本量偏小、随访时间偏短有关。本研究中患者肿瘤负荷大、分期晚,3年PFS和OS分别为47.3%和43.1%,略差于EORTC研究和GSTTC研究(43.0%和57.0%;47.0% 和57.5%) [8, 12]。
本研究随访中,非下咽癌肿瘤进展原因导致的死亡占比为16.9%,主要集中在因误吸呛咳或其他晚期反应导致的感染、出血、窒息等原因。这从另外一个方面反映了下咽癌治疗的难度大且风险高。有文献报道下咽癌非手术根治性放化疗后随访中出血、感染和窒息的发生率为15.6%[15]。这些治疗后出现的急性或晚期危重并发症是造成下咽癌患者非肿瘤进展导致死亡的重要原因之一,这对临床治疗和护理工作提出了更高的要求。下咽癌常常合并第二原发肿瘤,常见的第二原发肿瘤部位为上呼吸道和消化道[16]。本研究中第二原发肿瘤的发生率为29.3%(34/116),与既往文献类似,并有2例患者死于第二原发肿瘤。
另外,本研究分析了局部晚期下咽癌患者接受IC+根治性放疗后的失败模式,这在其他研究中是没有被详细报道过的。局部和/或区域复发是最常见的失败模式,发生率为40.5% (47/116),区域失败中最常见的是Ⅱ、Ⅲ、Ⅳ和ⅦA区。远处转移率为19.0% (22/116),最常见的远处转移部位是肺。这对局部晚期HPSCC临床治疗模式的选择和优化有指导和借鉴意义。
下咽癌发病率低,通常合并到头颈鳞癌中报道。本研究为回顾性、单中心,样本量相对小,下咽癌的最优治疗模式和生存数据需要更大样本量的前瞻性研究进一步证实。
本研究结果显示,IC联合根治性放疗治疗局部晚期HPSCC可获得相当的疗效。局部区域复发是最常见的失败模式,最常见的远处转移部位是肺。IC应答患者的预后明显优于IC非应答患者。需要前瞻性的大型临床研究进一步探讨局部晚期HPSCC的最佳治疗模式。
利益冲突 无
作者贡献声明 赵丹负责论文撰写和分析;万萌、刘伟欣、徐晓龙负责数据采集、处理和验证;郑宝敏、肖绍文负责方法、管理和数据校对;高顺禹、张彬负责研究设计;王维虎指导实验设计;孙艳负责论文审校
| [1] |
Urba SG, Wolf GT, Eisbruch A, et al. Single-cycle induction chemotherapy selects patients with advanced laryngeal cancer for combined chemoradiation: a new treatment paradigm[J]. J Clin Oncol, 2006, 24(4): 593-598. DOI:10.1200/JCO.2005.01,2047 |
| [2] |
Department of Veterans Affairs Laryngeal Cancer Study Group, Wolf GT, Fisher SG, et al. Induction chemotherapy plus radiation compared with surgery plus radiation in patients with advanced laryngeal cancer[J]. N Engl J Med, 1991, 324(24): 1685-1690. DOI:10.1056/NEJM199106133242402 |
| [3] |
Amin MB, Greene FL, Edge SB, et al. AJCC cancer staging manual. 8th ed[M]. New York: Springer, 2017.
|
| [4] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [5] |
Sgourakis G, Gockel I, Lyros O, et al. Detection of lymph node metastases in esophageal cancer[J]. Expert Rev Anticancer Ther, 2011, 11(4): 601-612. DOI:10.1586/era.10.150 |
| [6] |
Gregoire V, Ang K, Budach W, et al. Delineation of the neck node levels for head and neck tumors: A 2013 update. DAHANCA, EORTC, HKNPCSG, NCIC CTG, NCRI, RTOG, TROG consensus guidelines[[J]. Radiother Oncol, 2014, 110(1): 172-181. DOI:10.1016/j.radonc.2013.10.010 |
| [7] |
National Cancer Institute. Common toxicity criteria for adverse events. Version 4.03. Bethesda : National Cancer Institute, 2009. http://evs.nci.nih.gov/ftp1/CTCAE/About.html.
|
| [8] |
Lefebvre JL, Chevalier D, Luboinski B, et al. Larynx preservation in pyriform sinus cancer: preliminary results of a European Organization for Research and Treatment of Cancer phase Ⅲ trial[J]. J Natl Cancer Inst, 1996, 88(13): 890-899. DOI:10.1093/jnci/88.13.890 |
| [9] |
Forastiere AA, Zhang Q, Weber RS, et al. Long-term results of RTOG 91-11: a comparison of three nonsurgical treatment strategies to preserve the larynx in patients with locally advanced larynx cancer[J]. J Clin Oncol, 2013, 31(7): 845-852. DOI:10.1200/JCO.2012.43.6097 |
| [10] |
Cohen EE, Karrison TG, Kocherginsky M, et al. Phase Ⅲ randomized trial of induction chemotherapy in patients with N2 or N3 locally advanced head and neck cancer[J]. J Clin Oncol, 2014, 32(25): 2735-2743. DOI:10.1200/JCO.2013.54.6309 |
| [11] |
Haddad R, O'Neill A, Rabinowits G, et al. Induction chemotherapy followed by concurrent chemoradiotherapy (sequential chemoradiotherapy) versus concurrent chemora-diotherapy alone in locally advanced head and neck cancer (PARADIGM): a randomised phase 3 trial[J]. Lancet Oncol, 2013, 14(3): 257-264. DOI:10.1016/S1470-2045(13)70011-1 |
| [12] |
Ghi MG, Paccagnella A, Ferrari D, et al. Induction TPF followed by concomitant treatment versus concomitant treatment alone in locally advanced head and neck cancer. A phase Ⅱ-Ⅲ trial[J]. Ann Oncol, 2017, 28(9): 2206-2212. DOI:10.1093/annonc/mdx299 |
| [13] |
Han MW, Ryu IS, Lee SW, et al. Can response to induction chemotherapy be a predictive marker for ultimate outcome in hypopharyngeal cancer?[J]. Otolaryngol Head Neck Surg, 2012, 146(1): 74-80. DOI:10.1177/0194599811420357 |
| [14] |
Ryu IS. Usefulness of induction chemotherapy in hypopharynx cancer[J]. Otolaryngol Head Neck Surg, 2010, 143(2): P75-76. |
| [15] |
张永侠, 彭洪华, 张欣欣, 等. 晚期下咽癌119例手术与非手术综合治疗临床分析[J]. 中华耳鼻咽喉头颈外科杂志, 2018, 53(5): 352-358. Zhang YX, Peng HH, Zhang XX, et al. A retrospective study on combined modality therapy with or without surgery for advanced hypopharyngeal squamous cell carcinoma: an analysis of 119 cases[J]. Chin J Otorhinolaryngol Head Neck Surg, 2018, 53(5): 352-358. DOI:10.3760/cma.j.issn.1673-0860.2018.05.005 |
| [16] |
Chu PY, Chang SY, Huang JL, et al. Different patterns of second primary malignancy in patients with squamous cell carcinoma of larynx and hypopharynx[J]. Am J Otolaryngol, 2010, 31(3): 168-174. DOI:10.1016/j.amjoto.2008.12.004 |
 2022, Vol. 42
2022, Vol. 42


